Учебнометодическое пособие к лабораторным работам Красноярск 2018 Составители Иртюго Л. А. Дидух С. Л
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
Контрольные вопросы1. Какие факторы и как влияют на Кдифф и k? 2. Какая стадия лимитирующая при полирующем и селективном травлении? 3. Как зависит от температуры скорость реакции при селективном и полирующем травлении? 4. Каков порядок реакции при травлении кремния в полирующем травителе? 5. В чем заключается причина образования ямок травления? Работа №9 Изучение скорости реакции иодирования ацетона Теоретическое введение Йодирование ацетона катализируется в водных растворах протонами 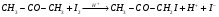 и протекает в две стадии: 1. энолизация ацетона (с образованием промежуточного вещества) 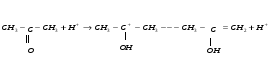 ; ;2. взаимодействие йода с энольной формой  Первая реакция протекает значительно медленнее второй, поэтому скорость процесса определяется скоростью первой стадии. Скорость реакции йодирования ацетона зависит от концентрации ацетона и ионов водорода, но не йода. В результате реакция проходит по второму порядку. Реакция проходит автокаталитически, так как ускоряется одним из продуктов реакции (Н+). В нейтральном разбавленном водном растворе она протекает очень медленно. Скорость расходования ацетона выражается кинетическим уравнением второго порядка в соответствии с уравнением лимитирующей стадии: 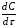 = k (C0 – Cх)(C0H+ + Cx), (9.1) = k (C0 – Cх)(C0H+ + Cx), (9.1)где C0 – начальная концентрация ацетона; C0H+ – начальная концентрация ионов водорода (кислоты); Cх – концентрация ацетона, подвергающаяся превращению за время t (убыль концентрации); t – время от начала реакции до данного измерения. Интегрирование выражения (10.1) дает уравнение константы скорости процесса:  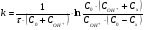 . (9.2) . (9.2)Для графической проверки это уравнение используют в линейной форме: 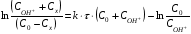 . (9.3) . (9.3)Экспериментальная часть Реактивы, приборы, посуда: - раствор фосфорной кислоты, - раствор I2 0,1 N в 4% КI, - ацетон, - NaNO3, Na2HPO4, - колбы объемом 25 мл, - спектрофотометр «SPEKOL 1300». Последовательность выполнения работы. В работе исследуется зависимость константы скорости реакции от начальной концентрации катализатора, а также изучается первичный и вторичный солевой эффект. Эксперимент проводят при четырех разных концентрациях фосфорной кислоты. В каждую из четырех 25 мл мерных колб вливают 1 мл 0,1 N раствора йода в 4 %-ном растворе КI, прибавляют к нему 3 мл фосфорной кислоты такой концентрации, чтобы концентрация ее в колбе составила от 0,01 до 0,1 N (по указанию преподавателя) и разбавляют дистиллированной водой, не доводя до метки. Затем вливают 1 мл ацетона и начинают отсчет времени. Момент вливания ацетона принимают за начало реакции. Доводят полученный раствор до метки водой, перемешивают. Помещают реакционный раствор в кювету спектрофотометра, сразу же определяя концентрацию йода. Аналогичную процедуру проделывают с остальными растворами йода с интервалом в 2 – 3 мин. Последующие измерения целесообразно проводить через каждые 3 – 5 мин. Чем меньше концентрация кислоты, тем реже следует проводить измерения. Эксперимент заканчивают при установлении постоянных значений концентрации. Анализ проб проводят с помощью спектрофотометра «SPEKOL 1300». Градуировочная зависимость «оптическая плотность – концентрация йода, ммоль/г-экв» внесена в память прибора. Подробная инструкция по работе с прибором «SPEKOL 1300» приведена в Приложении 2. По окончании эксперимента проводят: 1. Расчет константы скорости по уравнению (9.2) для каждой пробы и находят среднее значение. 2. Используя линейную форму уравнения (9.3), строят графики в координатах 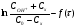 . Из наклона каждой прямой находят значения констант скорости и сравнивают с рассчитанными kср. Исходное количество ацетона (C0) определяют по навеске, ионов водорода (C0H+) – по количеству взятого раствора кислоты определенной концентрации, количество израсходованного ацетона (Cx) – по убыли йода, определенного из оптической плотности раствора. . Из наклона каждой прямой находят значения констант скорости и сравнивают с рассчитанными kср. Исходное количество ацетона (C0) определяют по навеске, ионов водорода (C0H+) – по количеству взятого раствора кислоты определенной концентрации, количество израсходованного ацетона (Cx) – по убыли йода, определенного из оптической плотности раствора.3. Строят график зависимости константы скорости от концентрации кислоты. 4. Данные эксперимента и расчеты помещают в табл. 9.1. Таблица 9.1
Работа 9 а ИЗУЧЕНИЕ ПЕРВИЧНОГO СОЛЕВОГО ЭФФЕКТА Первичный солевой эффект заключается в увеличении каталитического действия кислоты при прибавлении нейтральной соли, не имеющей общего аниона с катализирующей реакцию кислотой. При постоянной начальной концентрации фосфорной кислоты проводят 4 опыта, аналогично первой части работы. Добавляя в реакционную колбу нейтральную соль в таком количестве, чтобы концентрация ее в реакционной смеси изменялась в пределах от 0,025 до 0,1 N. При этом навеску соли следует помещать в колбу в первую очередь и растворять в минимальном количестве воды. Полученные опытные и расчетные данные помещают в табл. 9.1. Определяют значения констант скорости аналитически и графически, как и в первой части работы. Строят зависимость константы скорости реакции от концентрации соли, с константой скорости данной реакции без добавок нейтральной соли, полученной в первой части опыта. Работа 9 б ИЗУЧЕНИЕ ВТОРИЧНОГО СОЛЕВОГО ЭФФЕКТА Вторичный солевой эффект заключается в том, что при добавлении в реакционную смесь соли катализирующей кислоты каталитическое действие последней может сначала уменьшаться, а затем возрастать с увеличением концентрации соли. Катализатором здесь служит фосфорная кислота (для всех опытов концентрация кислоты остается постоянной), добавками – фосфат натрия. При постоянной температуре проводят 8 опытов, причем максимальная концентрация соли в реагирующей смеси не должна превышать 0,2 N. Несколько опытов должны быть сделаны в пределах до 0,02 N концентрации соли, так как характерный для изучаемого эффекта минимум наблюдается примерно при 0,01 N соли. Проведение эксперимента и обработка экспериментальных данных проводится аналогично первичному солевому эффекту. Контрольные вопросы 1. Почему скорость реакции йодирования ацетона не зависит от концентрации йода? 2. Каков порядок реакции йодирования ацетона? 3. Какие координаты, кроме предложенных в уравнении (9.3), можно использовать для графической проверки уравнения (9.2)? 4. Чем обусловлен первичный солевой эффект? 5. чем обусловлен вторичный солевой эффект? 6. Какие соли необходимо добавлять в реакционную смесь для изучения солевых эффектов? 7. Какой вид имеет кривая автокаталитической реакции? 8. Какова зависимость константы скорости реакции от ионной силы раствора? Работа №10 Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение Перекись водорода в водных растворах самопроизвольно медленно разлагается по уравнению: Н2О2 ® Н2О + 0,5О2. Реакция заметно протекает при комнатной температуре только в присутствии катализаторов. Ими могут быть некоторые катионы и анионы в растворе, а также ряд твердых веществ. В соответствии с этим катализ разложения Н2О2 подразделяется на гомогенный и гетерогенный. ГОМОГЕННО КАТАЛИТИЧЕСКИЙ РАСПАД Н2О2 В ПРИСУТСТВИИ ИОНОВ Сr2О72- Разложение перекиси водорода в растворе под действием ионов Сr2О72- происходит в две стадии. В первой стадии реакции обратимо образуется промежуточное соединение: 2Н2О2 + Сr2О72-«Cr2О92- + 2Н2О, которое далее необратимо распадается с выделением кислорода и исходного иона Сr2О72-. Полагая, что лимитирующей стадией процесса является относительно медленный распад промежуточного соединения, общую скорость процесса можно считать пропорциональной концентрации промежуточного вещества: 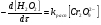 , ,где 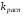 – константа скорости распада промежуточного вещества ( – константа скорости распада промежуточного вещества (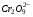 ). Концентрацию промежуточного вещества можно найти, используя константу равновесия первой стадии: ). Концентрацию промежуточного вещества можно найти, используя константу равновесия первой стадии: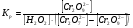 , (10.1) , (10.1)где 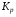 – константа равновесия; [Cr2O72-] – исходная концентрация катализатора; [Cr2O72-] – [Cr2O92-] – концентрация катализатора при равновесии. Вода находится в большом избытке, и ее концентрацию можно считать постоянной. – константа равновесия; [Cr2O72-] – исходная концентрация катализатора; [Cr2O72-] – [Cr2O92-] – концентрация катализатора при равновесии. Вода находится в большом избытке, и ее концентрацию можно считать постоянной.Из уравнения (10.1) получаем: 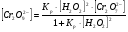 , ,откуда 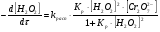 . (10.2) . (10.2)Из последнего уравнения следует, во-первых, что скорость процесса пропорциональна начальной концентрации катализатора и, во-вторых, что в общем случае порядок реакции дробный и может изменяться от 0-го до 2-го. Действительно, если равновесие сдвинуть в сторону образования промежуточного продукта, т.е. Кp[H2O2] >> 1, порядок реакции равен нулевому по исходному веществу: 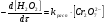 . .Когда Кp[H2O2] << 1, т.е. равновесие сдвинуто в сторону исходного вещества, 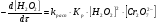 , ,и порядок реакции будет равен 2. Поскольку сдвиг равновесия в ту или иную сторону зависит от температуры, то и порядок реакции изменяется с температурой. Уравнение (10.2) можно преобразовать в линейную форму; взяв обратное значение скорости: 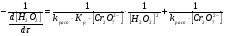 . (10.3) . (10.3)Построив график в координатах 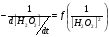 , с учетом , с учетом 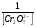 по тангенсу угла наклона прямой можно найти произведение по тангенсу угла наклона прямой можно найти произведение 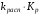 , а по отрезку на оси ординат – значение , а по отрезку на оси ординат – значение 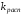 . .Таким образом, из кинетического опыта можно определить константу равновесия и константу скорости реакции. ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЙ РАСПАД Н2О2 НА АКТИВИРОВАННОМ УГЛЕ Реакция разложения Н2О2 на активированном угле идет большей частью по первому или близкому к первому (0,7 – 1,2) порядку. Поэтому для оценки скорости реакции можно пользоваться кинетическим уравнением первого порядка 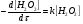 . .Так как изменение концентрации Н2О2 прямо пропорционально количеству выделяющегося кислорода, то при газометрическом измерении скорости реакции константу скорости удобнее определить через объем выделившегося О2: 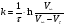 , (10.4) , (10.4)где V¥ – общий объем выделившегося кислорода; Vt – объем О2, выделившийся к моменту времени t. Экспериментальная часть Реактивы, приборы, посуда: - концентрированный раствор перекиси водорода (Н2О2), - раствор перманганата калия (KMnO4) 0,1 N, - серная кислота (Н2SO4) 20%, - раствор бихромата калия (К2Сr2О7) 0,05 – 0,2 N, - активированный уголь, - круглодонная колба с плотно закрывающейся резиновой пробкой с капилляром, - установка для изучения каталитического разложения (рис.9). Последовательность выполнения работы. Одним из наиболее распространенных методов изучения кинетики разложения перекиси водорода является газометрический метод, который используется в нашей работе в обоих случаях. Рис. 10.1. Установка для изучения кинетики каталитических реакций Установка представлена на рис. 10.1 (цифрой 1 обозначен реакционный сосуд). При снятии отсчетов по бюретке (2) необходимо приводить к одному уровню мениски жидкости в бюретке и уравнительной склянке (3), перемещая последнюю. Перед опытом необходимо проверить установку на герметичность. Для этого опускают уравнительную склянку ниже уровня бюретки. Уровень воды в бюретке при этом опустится и установится на некотором делении. Если это положение не изменится в течение 3 мин, установку можно считать герметичной. В противном случае уровень воды в бюретке будет непрерывно расти. В работе следует изучить реакцию распада перекиси водорода на жидком и твердом катализаторах. 1. Изучение гомогенно-каталитического разложения перекиси водорода. Цель данной работы – получение зависимости константы скорости и константы равновесия реакции от концентрации катализатора и нахождение порядка реакций. Нужно приготовить раствор перекиси водорода с концентрацией в пределах 0,1 – 0,2 N (200 – 250 мл). Точная концентрация Н2О2 определяется титрованием перманганатом калия. Для этого наливают пипеткой 2 – 3 мл рабочего раствора (@ 0,15 N) и 1 – 2 мл 20% раствора Н2SO4. Титруют 0,1N раствором КМnO4 до появления слабо-розового окрашивания. При этом протекает реакция 2MnO4- + 6H+ + 5H2O2 ® 2Mn2+ + 8H2O + 5O2. Знание точной концентрации раствора Н2О2 необходимо для сравнения опытного конечного объема выделившегося кислорода и теоретического, которое можно рассчитать по уравнению Клапейрона-Менделеева с учетом давления насыщенного пара воды при температуре опыта. В каждом опыте используют одно и то же количество раствора перекиси водорода в пределах 20 – 25 мл. Проводят 2 – 3 опыта, варьируя концентрацию раствора катализатора К2Сr2О7 в пределах 0,05 – 0,2N, сохраняя одинаковый добавляемый объем 3 мл. Опытные данные вносят в табл. 10.1 и представляют в виде графиков: 1) кинетические кривые 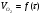 и и 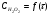 для всех концентраций катализатора; для всех концентраций катализатора; 2) по кривым 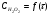 графическим дифференцированием в 7 – 10 точках определяют скорость реакции графическим дифференцированием в 7 – 10 точках определяют скорость реакции 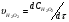 и строят графики в координатах и строят графики в координатах 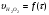 ; ;3) график зависимости 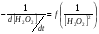 для определения для определения 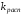 и и 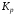 ; ;4) зависимость 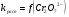 . .2. Изучение гетерогенно-каталитического разложения перекиси водорода. Проводится три опыта с разными навесками активированного угля. Точную концентрацию @ 0,15 N раствора Н2О2 определяют титрованием, как описано в п.1. Затем в реакционную колбу наливают 20 мл раствора перекиси водорода, засыпают навеску активированного угля (0,25 – 1,0 г – задается преподавателем), быстро закрывают пробкой на отводящем шланге, одновременно включают секундомер, начинают интенсивно встряхивать реакционный сосуд (это производят в течение всего опыта с целью исключить влияние процесса диффузии на кинетику реакции) и приступают к отсчетам объема выделившегося кислорода по шкале бюретки. Опытные данные заносят в табл. 10.2 и представляют графически: 1) кинетические кривые 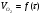 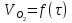 и и 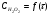 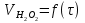 ; ;2) зависимость 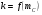 , значения k рассчитывают по формуле (10.4), для построения графиков берут среднее значение; , значения k рассчитывают по формуле (10.4), для построения графиков берут среднее значение;3) графики для определения порядков реакции в координатах 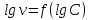 . Скорость расходования перекиси определяют графическим дифференцированием кривых . Скорость расходования перекиси определяют графическим дифференцированием кривых 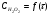 . . Для получения воспроизводимых результатов рекомендуется все опыты дублировать два – три раза. | ||||||||||||||||||