Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
97. Смесь этена с бутаном, с плотностью по водороду 21,5, сожгли. Продукты сгорания 22,4 л этой смеси пропустили через избыток раствора гидроксида кальция. Определите массу выпавшего осадка.98. Оксид углерода (II) смешали с алкеном. Мольная доля оксида равна 60%, а массовая доля 50%. Определите формулу алкена. 99. Смесь бутана, пропана и пропена массой 35,2 г (н.у.) занимает объём 16,8 л (н.у.). Определите состав смеси в %% по объёму, если известно, что массовая доля углерода как элемента в смеси равна 6,96 %. 100. Через 200 г 3% водного раствора брома пропустили смесь метана и этена с плотностью по водороду равной 12. Концентрация брома в водном растворе уменьшилась до 1,02%. Какой объём газовой смеси (н.у.) был пропущен? Растворимостью органических соединений в воде пренебречь.( 101. Через водный раствор брома пропустили 43,6 г газовой смеси, состоящей из бутана, пропена и 2-метилпропена. В реакцию вступило 56 г брома. Определите первоначальный объём (н.у.) газовой смеси и состав смеси ( в %% по объему), если плотность по водороду газовой смеси равна 27,25. %. 102. Смесь этана, этена и 2-метилпропена имеет плотность по аммиаку 2,035. К 5 л этой смеси добавили 5 л водорода и пропустили над нагретым платиновым катализатором. При этом объем смеси уменьшился до 7,5 л. Определите объемные и массовые доли газов в исходной смеси. 103. Смесь алкана и алкена, содержащих 26 и 16 электронов в молекуле соответственно, сожгли в избытке кислорода. На сжигание алкена требуется в три раза больший объем кислорода. Определите состав исходной смеси в массовых долях. Глава 4. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ Диеновые углеводороды – ненасыщенные углеводороды состава СnН2n-2, молекулы которых в углеродном скелете содержат две двойные связи. В зависимости от расположения двойных связей различают алкадиены с кумулированными двойными связями( алкадиены 1,2 или аллены), сопряженные и несопряженные диены. Аллены – это алкадиены, у которых обе двойные связи находятся у одного атома углерода, например, Н2С=С=СН2 . Несопряженные диены – это диены, в которых между двойными связями стоит больше одной одинарной связи, например, гексадиен-1,5 : СН2=СН−СН2−СН2−СН=СН2 . Наибольший интерес представляют сопряженные диены, в которых двойные связи разделены в цепи только одной σ-связью, например, СН2=СН−СН=СН2 СН2=С−СН=СН2 │ СН3 бутадиен-1,3 (дивинил) 2-метилбутадиен-1,3 (изопрен) Сопряженные диены имеют большое практическое значение , так как являются исходным сырьем для получения синтетических полимерных материалов, поэтому далее мы рассмотрим только их. В сопряженных диенах π-электронные облака двойных связей перекрываются между собой, образуя единое π-электронное облако, при этом π-электроны не принадлежат определенным связям, а делокализованы по всем атомам (π – π - сопряжение), как например в молекуле бутадиена: 4.1. Получение сопряжённых алкадиенов 1. Основной промышленный способ получения диенов – дегидрирование алканов. Бутадиен получают из бутан-бутеновой фракции, выделяемой при крекинге нефти: t,Сr2O3 СН3−СН2−СН2−СН3 Аналогичным способом получают изопрен из изопентан-изопентеновой фракции крекинга нефти: t,Cr2O3,Al2O3 СН3−СН(СН3) −СН2−СН3 2. По методу Лебедева бутадиен-1,3 получают в результате одновременно протекающих процессов дегидратации и дегидрирования на смешанных катализаторах: t, Al2O3 / ZnO 2С2Н5ОН 3. Дегидратация диолов : Н3РО4,NаРО3 СН2(ОН) −СН2−СН2−СН2(ОН) Al2O3 СН3−СН(ОН) −СН2−СН2(ОН) │ │ СН3 СН3 Бутадиен-1,3 –легко сжижающийся газ с неприятным запахом. Изопрен- легкокипящая жидкость (t кип =34 0С ). 4.2. Химические свойства алкадиенов Все четыре атома углерода в бутадиене -1,3 находятся в sp2-гибридном состоянии. В результате бокового перекрывания р-орбиталей всех четырех атомов углерода образуется единое π-электронное облако. Это приводит к тому, что для диеновых углеводородов характерны реакции электрофильного присоединения, но из-за сопряжения двойные связи в их молекулах функционируют как единое целое, поэтому в результате присоединения одного моль реагента образуется два продукта: по концам сопряженной системы (1,4- присоединение, с перемещением двойной связи в центр) или к одной из двойных связей (1,2- присоединение). Cоотношение продуктов присоединения зависит от конкретных условий – температуры реакции, природы растворителя. 1. Галогенирование CCI4 2СН2=СН−СН=СН2 + 2Вr2 1,4-дибромбутен-2(80% при 40оС) + ВrСН2СНВrСН =СН2 3,4-дибромбутен-1 (20% при 400C) CCI4 СН2 = СН−СН=СН2 + 2Вr2 1,2,3,4 – тетрабромбутан 2. Гидрогалогенирование - присоединение галогеноводородов ( по правилу Марковникова). СН2=СН−СН=СН2 + НВr 4-бромбутен-2 3-бромбутен-1 СН2=СН−С=СН2 + НВr | | СН3 СН3 3-бром-3-метилбутен-1 | СН3 4-бром-2-метилбутен-2 СН2=СН−СН=СН2 + 2 НВr 1,3-дибромбутан 3. Гидрирование. Рt, t0 СН2=СН−СН=СН2 + Н2 бутен-2 бутен-1 Pt, t0 CH2=CН−СН=СН2 + 2 Н2 4. Полимеризация. Диеновые углеводороды легко полимеризуются в присутствии многих катализаторов, в частности в кислой среде при нагревании: Полимеризация бутадиена-1,3 обычно происходит как 1,4-присоединение, но с примесью 1,2-полимера. СН2=СН−СН=СН2 При полимеризации 2-метилбутадиена-1,3 получают синтетический каучук: СН2=С−СН=СН2 │ │ СН3 СН3 4.3. Примеры решения задач Пример15. При полном каталитическом гидрировании некоторого диенового углеводорода массой 6,8г было получено 7,2г алкана. Определите формулу исходного алкадиена, напишите и назовите не менее четырёх его возможных изомеров. Решение: 1) Напишем уравнение реакции гидрирования диенов: СnН2n-2 + 2Н2 = СnН2n+2 2) Вычислим массу и количество водорода, вступившего в реакцию: m(Н2) = 7,2 -6,8 = 0,4 (г) ; n (Н2) = m(Н2)/М(Н2) = 0,4/2 =0,2 (моль) 3) В соответствии с уравнением, в реакцию гидрирования вступает в 2 раза меньшее количество диена: n(СnН2n-2) =n/(Н2)/ =0,2/2 = 0,1 (моль) 4) Определяем молярную массу и формулу диенового углеводорода: М(СnН2n-2) = m (СnН2n-2)/n (СnН2n-2) =6,8/0,1 =68 (г/моль). 12n + 2n -2 = 68 14n=70, n=5, поэтому формула исходного вещества С5Н8 5) Напишем формулы и назовём его изомеры: СН2 = СН−СН = СН − СН3 пентадиен – 1,3 СН2 = СН – СН2 − СН = СН2 пентадиен – 1,4 СН3 – СН = С = СН – СН3 пентадиен – 2,3 СН2 = С = С(СН3 ) – СН3 3 – метилбутадиен – 1,2 4.4. Задачи и упражнения для самостоятельного решения 104. Сколько диеновых углеводородов изомерно пентину-1? Напишите формулы этих веществ и назовите их по систематической номенклатуре. 105. Напишите структурные формулы изомеров состава С6Н10 и назовите их по систематической номенклатуре. 106. Приведите формулу метилгексадиена, существующего в форме четырех пространственных изомеров. 107. Углеводород Х, подвергающийся полимеризации, в реакции с избытком брома образует соединение состава С5Н8Вч4 , а при гидрировании превращается в разветвленный углеводород С5Н12. Назовите соединение Х и напишите уравнения реакций. 108. Реакции присоединения характерны для каждого из веществ, приведенных в ряду: 1) этин, 2- метилбутен-1, изобутан 2) этен, пропин, бутадиен-1,3 3) 2-бромбутан, пропилен, ацетальдегид 4) формальдегид, пропан, этилен. Выберите правильный ответ. 109. С какими из перечисленных ниже веществ будет взаимодействовать изопрен: Н2, Nа, НВч, Вч2, NаОН, О2 ? Напишите уравнения соответствующих реакций. 110. Исходя из углерода и любых неорганических реагентов получите бутадиен-1,3. 111. Как можно выделить бутадиен-1,3 из его смеси с бутином-1 и этином? 112. Натуральный каучук представляет собой: а) цис-полибутадиен, б)цис-полиизопрен, в) полиметилметакрилат, г)цис-полихлоропрен? Выберите правильный ответ . 113. Какое вещество может быть использовано как исходное для получения синтетического каучука: а) СаС2 ; б)С2Н5ОН; в) С6Н5–СН=СН2; г) природный газ? Выберите правильный ответ. 114. Хлоропреновый каучук получают из: 1) СНС1=СНС1 2) СН2=СС1−СН=СН2 3) СН2=СН−СН=СНС1 4)СН≡СС1. Выберите правильный ответ. 115. При полном гидрировании смеси трех изомеров, один из которых бутадиен-1,3, был получен только один алкан. Предложите структурные формулы соединений, которые могут быть получены при обработке НВr этой смеси изомеров, назовите все соединения. 116. Напишите уравнение реакции присоединения 1 моль брома к 1 моль бутадиена. 117. С какими из перечисленных ниже веществ будет взаимодействовать изопрен: Н2, K, KВr, Cl2, изопрен ? Напишите уравнения соответствующих реакций. 118. Относительная плотность некоторого алкадиена по гелию равна 13,5. Определите углеводород, напишите формулы его изомеров и назовите их. 119. После прохождения смеси бутадиена-1,3 и избытка водорода над нагретым платиновым катализатором ее плотность возросла на 20%. Определите объемную долю бутадиена-1,3 в исходной смеси. 120. Замкнутый сосуд наполнили находящимся в газообразном состоянии алкадиеном. При полном термическом разложении углеводорода на элементы давление в сосуде увеличилось в 4 раза (при неизменной температуре). Укажите все углеводороды, которые могли бы дать подобный результат. 121. Определите объем водорода, который потребуется для полного каталитического гидрирования 45,56 л (н.у.) смеси пропена и бутадиена-1,3, если плотность смеси равна 2,143 г/л (н.у.). 122. Смесь этилена и диенового углеводорода разветвленного строения объемом 4,48 л (н.у.) обесцвечивает 148 мл раствора брома в тетрахлориде углерода с массовой долей брома 15% и плотностью 1,8г/мл. Определите структурную формулу диенового углеводорода, если известно, что при сжигании такого же количества исходной смеси образуется 9 г воды. 123. При полном каталитическом гидрировании некоторого диенового углеводорода массой 24,6 г получено 25,8 г предельного соединения. Определите формулу исходного алкадиена, напишите структурные формулы и назовите не менее пяти его возможных изомеров. 124. На сжигание одного объема паров некоторого диенового углеводорода требуется объем воздуха, в 33,3 раза больший объема паров сожженного углеводорода (объемы газов измерены при одинаковых условиях). Напишите структурные формулы его возможных изомеров и назовите их по систематической номенклатуре. 125. Для полного каталитического гидрирования 3,45 г смеси бутадиена и пропена требуется водород объемом 2,41 л (11оС; 98 кПа). Определите объемные доли газов в исходной смеси. 126. Раствор алкадиена в н- гексане, в котором массовая доля алкадиена составляла ровно 20%, подвергли гидрированию в присутствии никелевого катализатора. После завершения гидрирования массовая доля образовавшегося алкана составила 20,7730%. Определите формулу исходного алкадиена и напишите структурные формулы его изомеров. Глава 5. АЛКИНЫ Алкины- ненасыщенные углеводороды с одной тройной связью, относящиеся к гомологическому ряду соединений с общей формулой CnH2n-2 . Название алкинов образуется из названий соответствующих алканов заменой суффикса -ан на суффикс -ин. Для алкинов возможна структурная изомерия, обусловленная изомерией углеродного скелета, изомерия положения тройной связи и межклассовая изомерия (алкины и алкадиены). По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины С2 –С4 представляют собой бесцветные газы, С5-С16- жидкости, высшие алкины– твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов. Подобно алканам и алкенам, алкины нерастворимы в воде, но растворимы в полярных растворителях. 5.1. Получение алкинов 1. Реакция пиролиза (промышленный способ получения ацетилена путем высокотемпературного крекинга метана): 1500о С 2СН4 1200оС 2 С2Н6 2. Взаимодействие карбидов металлов с водой (получение в лаб. условиях) СаС2 + 2Н2О 3. Прямой синтез (проводится при температурах выше 3000 градусов по Цельсию, реакция проводится на электрической дуге между угольными электродами в атмосфере водорода): 2С + Н2 4. Дегидрогалогенирование дигалогеналканов: КОН,спирт,t СН3−СН2− СНВr2 KOH,спирт,t СН3−СНВr−СН2Вr 5. Из галогеналканов под действием цинка: Zn,пыль СН3Вr2СHВr2 5.2. Химические свойства алкинов Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Атомы углерода при тройной связи находятся в состоянии sр-гибридизации, тройная связь является сочетанием одной сигма и двух пи-связей. Типичными для алкинов являются реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, так как sр-гибридизованные орбитали более электроотрицательны чем sp2 , π-электроны более прочно связаны с ядром углерода и, следовательно, менее активно реагируют с электрофильным агентом, чем алкены и диены. 1. Галогенирование Галогены присоединяются к алкинам в две стадии: НС≡СН + Вr2 НС≡СН +2Вr2 НС=СН +CI2 Хлорирование проводят в инертном растворителе, например, в тетрахлориде углерода ССI4, так как при проведении реакции в газовой фазе происходит разрушение углеродного скелета: С2Н2 + СI2 2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее,чем к двойной. Для активации реакции используется А1С13- сильная кислота Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера- поливинилхлорида: А1СI3 НС≡СН + НСI В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова: AlCI3 СН3−С≡СН + НСI AlCI3 СН3−ССI=СН2 + 2НСI 3. Гидратация. Присоединение воды к алкинам (реакция Кучерова) катализируется кислотой и солями ртути (П). При этом из ацетилена получается этаналь: Hg2+ , H + НС≡СН + Н2О Другие алкины дают кетоны: Hg2+, H+ СН3−С≡СН + Н2О Предполагается, что на первой стадии присоединения воды образуются неустойчивые виниловые спирты (енолы), в которых гидроксогруппа находится непосредственно у атома углерода при двойной связи. Енолы быстро изомеризуются в более стабильные карбонильные соединения. 4. Гидрирование. Алкины присоединяют водород в присутствии металлических катализаторов (Рt, Рd, Ni) при нагревании. Реакция протекает в две стадии, промежуточный алкен при этом трудно выделить: p, Pt, t0 CH3−CH2 − С≡СН + 2 Н2 p, Pt, t0 НС≡СН + 2Н2 5. Димеризация и полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Например, под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен: НС≡СН + НС≡СН Винилацетилен, присоединяя хлороводород, образует хлоропрен, используемый для получения искусственного каучука: СН2=СН−С≡СН + НС1 При пропускании ацетилена над активированным углем при 600оС происходит тримеризация ацетилена с образованием бензола, другие алкины образуют при этом гомологи бензола: Сакт., t0 НС≡СН 3СН3−С≡СН В присутствии катализаторов( CuCl, NH4Cl,H+) образуется винилацетилен: НС≡СН + НС≡СН винилацетилен 6. Кислотные свойства алкинов Алкины с концевой тройной связью в которых атом водорода связан с углеродом, находящимся в sp-гибридном состоянии, способны отщеплять протон под действием сильных оснований, т.е. проявляют слабые кислотные свойства. Алкины в отличие от алканов и алкенов, способны образовывать соли, называемые ацетиленидами: 2R−C≡C−H + NaH Ацетилениды серебра и меди(1) легко образуются и выпадают в осадок при пропускании алкина через аммиачный раствор оксида серебра или хлорида меди(1). Эти реакции используются для обнаружения алкинов с тройной связью на конце цепи: НС≡СН + 2 [Аg( NН3) 2] ОН жёлто-серый осадок или в упрощенной форме: NH3 НС≡СН + Аg2O R−C≡CH + [ Cu(NH3)2]Cl красный осадок Ацетилениды серебра и меди легко разлагаются под действием хлороводородной кислоты с выделением исходного алкина: R−C≡C−Cu + HCl Тем самым, используя реакции образования и разложения ацетиленидов, можно выделять такие алкины из их смесей с другими углеводородами. 7. Окисление Алкины окисляются различными окислителями, например, перманганатом калия. В кислой среде происходит расщепление тройной связи и образо вание карбоновых кислот: 5СН3-С≡С-СН3 +6 KMnO4 +9 Н2 SO4 10СН3СООН +6 MnSO4 +3K2SO4 +4H2O Алкины с концевой тройной связью дают карбоновую кислоту и диоксид углерода: 5CH3−C≡CH +8 KMnO4 + 12 H2SO4 5CH3COOH +5CO2 +12H2О+ 4K2SO4+8MnSO4 8. Горение t0 НС≡СН + 2,5 О2 5.3. Примеры решения задач Пример 16. Разделить смесь, состоящую из пропана, пропена и пропина и выделить компоненты в чистом виде. Решение: Все компоненты смеси газообразные, причем два из них относятся к непредельным соединениям. Пропускание смеси через раствор брома в ССI4 приведет к образованию продуктов присоединения брома к обоим непредельным соединениям, поэтому смесь не удастся полностью разделить. Поэтому сначала смесь нужно пропустить через аммиачный раствор оксида серебра, при этом будет образовываться ацетиленид серебра, который выпадает в осадок: CH≡CH +2[Ag(NH3)2]ОН Или в упрощенном виде: HC≡CH + Ag2O Остальные компоненты смеси – пропан и этен – проходят через раствор. Затем пропустим смесь через раствор брома в ССl4 , при этом этен перейдет в 1,2 – дибромэтан, который останется в растворе: CH2=CH2 + Br2 В результате остается пропан – он проходит через раствор. Чтобы выделить компоненты смеси в чистом виде, обработаем осадок ацетиленида серебра избытком раствора соляной кислоты и получим чистый ацетилен: AgC≡AgC↓ + 2HCI Для выделения этена из 1,2 – дибромэтана обработаем последний цинковой пылью при нагревании: CH2Br−CH2Br + Zn Пример 17. Смесь этана, этена и этина объёмом 15,68 л (н.у.) пропустили через избыток аммиачного раствора оксида серебра, в результате образовалось 36 г. Осадка. При пропускании такого же объёма смеси через раствор брома в четырёххлористом углероде объём смеси газов уменьшился на 5,6 л. (н.у.). Определить состав исходной газовой смеси ( в % по объёму). Решение: При пропускании исходной смеси через аммиачный раствор оксида серебра в реакцию взаимодействия будет вступать этин с образованием осадка ацетиленида серебра: НС ≡ СН +Аg2О 1) Определим количество вещества и объём этина: n (C2H2) = n (Ag2C2) =m (Ag2C2)/ M (Ag2C2) =36/240 = 0,15 (моль ); V (C2H2) = 0,15x 22,4 = 3,36 (л) При пропускании исходной смеси через раствор брома объём смеси газов уменьшается на 5,6 л взаимодействия этина и этена: С2Н2 + 2Вr2 С2Н4 +Вr2 2) Определяем объём этена и этана: V(С2Н4) = 5,6 - V(С2Н2) = 5,6- 3,36 =2,24 (л.), тогда V (С2Н2) = 15,68 – 5,6 = 10,08 (л.). 3) Находим состав исходной смеси: φ(C2H2) = V(C2H2)/15,68 = 3,36/15,68=0,2143 φ(C2H4) = V(C2H4)/15,68 =2,24/15,68 =0,1429 φ(C2H6) = V(C2H6)/15,68 = 10,08/15,68=0,6428 Ответ: φ(C2H2) =0,2143; φ(C2H4) = 0,1429; φ(C2H6) =0,6428. 5.4. Задачи и упражнения для самостоятельного решения 127. Относительная плотность некоторого газообразного алкина по водороду равна 27. Определите формулу алкина. 128. Сколько σ -связей в молекуле четвертого члена гомологического ряда алкинов? 129. Напишите структурные формулы всех алкинов состава С6Н10,имеющих в своем составе только один третичный атом углерода и назовите их. 130. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти атомов и назовите их. 131. Какие из перечисленных углеводородов являются изомерами и какие гомологами: гексин-3, 3-метилпентин-1, гексин-2, пентин-2, 3-метилбутин-1? 132. Изобразите структурные формулы всех алкинов , изомерных пентину-1 и назовите их. 133. Среди перечисленных ниже веществ выберите пары изомеров: 3-метилпентин; пентен-2 ; 2-метилбутадиен-1,3; 1 –метилциклопентен. 134. Среди перечисленных ниже веществ выберите: а) изомеры и б) гомологи: 3- метилбутин -1; пентен -2; пентин-3; циклопентен; 2- метилгексин-3; гексадиен-1,3; 3-метилбутен-1. 135. Напишите структурные формулы всех ацетиленовых углеводородов, которые при каталитическом гидрировании образуют 2-метилпентан. Назовите их по систематической номенклатуре. 136. Ацетилен в промышленности получают: а) перегонкой сырой нефти; б) термическим крекингом метана; в) выделением из природного газа; г) дегидрированием этана. Выберите правильный ответ. 137. С бромной водой взаимодействуют оба соединения: 1) этан и этилен 2) бутадиен-1,3 и бутан 3) этин и пропан 4) бутадиен-1,3 и пропен Выберите правильный ответ и напишите уравнения реакций. 138. При взаимодействии бутина-1 с избытком бромоводорода образуется 1) 1,1,2,2 - тетрабромбутан 2) 1,2 -дибромбутан 3) 1,1 - дибромбутан 4) 2,2 - дибромбутан Выберите правильный ответ и напишите уравнения реакций. 139. При полном гидрировании смеси трёх изомеров, один из которых бутин-1, был получен только один алкан. Предложите структурные формулы соединений, которые могут быть получены при обработке избытком НС1 этой смеси изомеров. 140. При полном гидрировании смеси трёх изомеров, один из которых бутин-2, был получен только один алкан. Предложите структурные формулы соединений, которые могут быть получены при обработке избытком НВr этой смеси изомеров. 141. Как химическим путем выделить бутин-2 из его смеси с бутином-1? 142. Разделите газовую смесь, состоящую из бутина-1, бутина-2, бутана и углекислого газа. Выделите компоненты смеси в чистом виде. 143. Смесь этана и одного из бутинов пропустили через аммиачный раствор оксида серебра, а затем через раствор брома. Какой бутин должен быть в смеси, если она: а) не обесцвечивает бромную воду; б) обесцвечивает бромную воду? Ответ подтвердите уравнениями реакций. 144. Получите: а) ацетилен из этилена, б) бутин-2 из бутена-2. Напишите уравнения реакций. 145. Осуществите превращения: а)карбонат кальция б) ацетилен 2,3-дибромбутан. 146. Получите: а) 2,3-дибромбутан из ацетилена; б) бензол из метана; в) 1-хлорэтен из этана; г) бутен-1-ин-3 из углерода. 147. Раствор алкина в н-гексане, в котором массовая доля алкина составляла 41,00%, подвергли гидрированию в присутствии никелевого катализатора. После завершения гидрирования массовая доля образовавшегося алкина составила 42,16%. Определите формулу исходного алкина и напишите структурные формулы его изомеров. 148. Плотность смеси этана и этина равна плотности азотa .Определите объемные и массовые доли газов в смеси. 149. Рассчитайте элементный состав (в%% по массе) изомерных ацетиленовых углеводородов, плотность паров которых по кислороду равна 1,69. Напишите структурные формулы возможных изомеров и назовите их.. 150. Рассчитайте массу хлороводорода, который может прореагировать с 44,8л (н.у.) смеси пропина и бутена, имеющей плотность, равную плотности одного из алканов. 151. После пропускания 100 л (н.у.) смеси этана, пропена и пропина через аммиачный раствор оксида серебра её объем стал равным 80 л (н.у.). После пропускания точно такого же объема смеси через бромную воду её объём уменьшился на 40 л (н.у.). Определите состав исходной смеси (в %% по объёму).. 152. Смесь алкана, алкена и алкина, содержащих одинаковое число атомов углерода, объемом 2,8л (н.у.), может прореагировать с 17,4г оксида серебра (в аммиачном растворе) или обесцветить 875 г бромной воды с массовой долей брома 3,2%. Определите качественный и количественный состав ( в % по объему) исходной смеси углеводородов. 153. Смесь этана, этилена и ацетилена объемом 40,6 л (н.у.) пропустили через аммиачный раствор оксида серебра, взятый в избытке. В результате образовалась 96,0 г осадка. При пропускании такого же объема смеси газов через бромную воду объем смеси газов уменьшился на 18,2 л (н.у.). Определите состав газовой смеси ( в %% по объёму). 154. Рассчитайте, во сколько раз уменьшится объем смеси этана и этина после пропускания её через аммиачный раствор оксида серебра, если известно, что 11,2 л (н.у.) исходной смеси могут легко прореагировать в темноте с 38,2 мл брома (плотность 3,14 г/мл ). 155. Определите строение углеводорода ацетиленового ряда, если при присоединении 95,88 г брома, растворенного в хлороформе, образуются 112,08 г продукта реакции. Известно также, что углеводород не реагирует с аммиачным раствором оксида серебра. 156. Смесь ацетилена, этилена и водорода с плотностью по водороду 4,4 имеет массовую долю водорода как элемента 25%. Определите состав смеси (в процентах по объему) после ее пропускания над никелевым катализатором. Выход в реакциях гидрирования считать 100%. 157. Замкнутый сосуд наполнили находящимся в газообразном состоянии алкином. При полном термическом разложении углеводорода на элементы давление в сосуде увеличилось в 5 раз (при неизменной температуре). Укажите все углеводороды, которые могли бы дать подобный результат. 158. Какой объем воздуха необходим для сжигания 11,2 л (25оС; 97,33 кПа) смеси пропена и ацетилена с плотностью равной при этих условиях плотности одного из алканов? 159. Смесь ацетилена и углекислого газа образует при пропускании через избыток известковой воды 20,0г осадка. При обработке такой же смеси избытком хлора образуется 21,9 г хлороводорода. Вычислите объем (н.у.) исходной смеси газов. 160. Теплота сгорания этина равна 1300 кДж/моль. Какой объем этина (н.у.) сгорел, если теплота реакции составила 780 кДж. 161. При обработке водой пропина в присутствии солей ртути и серной кислоты было получено 23,2г ацетона с выходом 0,4. Какой объем пропина (н.у.) был взят? 162. Ацетиленовый углеводород, содержащий пять углеродных атомов в главной цепи, присоединяет 40г брома. При этом образуется 52 г продукта реакции. Определите строение углеводорода, если известно. Что он не вступает в реакцию с аммиачным раствором оксида серебра. 163. 7,84л (н.у.) смеси газообразных этиленового и ацетиленового углеводородов, содержащих одинаковое число атомов углерода, может присоединить 80 г брома. Образовавшаяся при этом смесь продуктов присоединения брома имеет массу94,4 г. Определите строение и состав (в % по массе) исходной смеси углеводородов. 164. Определите массу гидроксида калия, находившегося в спиртовом растворе, прореагировавшего с 1,2-дибром-3,3-диметилпентаном, если при этом образовалось 24г алкина. Назовите алкин. 165. При полном гидрохлорировании алкина массой 2,16г образуется вещество, масса которого равна 5,08г. Установите строение алкина и с аммиачным раствором оксида серебра. 166. 1,2-дибромпропан массой 4,04г обработали 20,0г 20%-ного раствора гидроксида калия в этаноле. Вычислите массу остатка, который был получен после окончания реакции и выпаривании раствора . 167. Смесь карбида алюминия и карбида кальция общей массой 2,72г обработали избытком соляной кислоты. Выделившуюся смесь углеводородов сожгли, а продукты сгорания пропустили через избыток раствора гидроксида бария, при этом образовалось 13,8г осадка. Определите состав газовой смеси углеводородов (в %% по объему), образовавшейся при гидролизе карбидов. 168. Масса твердого вещества, образующегося при пропускании смеси ацетилена и бутина-1 через избыток аммиачного раствора оксида серебра, в 7,4 раза больше массы смеси углеводородов. Вычислите объемные доли веществ в исходной смеси углеводородов. 169. Раствор изопрена и пентина-2 в гексане общей массой 4,56г может прореагировать с 2,8г брома (без нагревания и катализаторов). Вычислите массовую долю гексана в исходной смеси. 170. Определите объем водорода, который потребуется для полного каталитического гидрирования 10л (объемы измерены при н.у.) смеси бутина и бутадиена-1,3. Плотность смеси равна 2,411 г/л. Глава 6. ЦИКЛОАЛКАНЫ Насыщенные углеводороды, в которых атомы углерода замкнуты в цикл. Общая формула углеводорода с одним циклом CnH2n . Электронные орбитами атомов углерода в циклоалканах находятся в состоянии sp3 -гибридизации.  Все циклоалканы- бесцветные, малорастворимые в воде, горючие вещества. При обычных условиях C3H6, C4H8- газы, С5Н10,С6Н12- жидкости Структурная изомерия циклоалканов свящзана с различной величиной циклов, видом и строением заместителей и их расположением:  циклогексан метилциклопентан пропилциклопропан  1,2-диметилциклобутан 1,3-диметилциклобутан 6.1. Получение циклоалканов 1. Общий способ получения циклоалканов и их производных – действие металлов (Na, Zn, Mg) на дигалогенпроизводные алканов при нагревании  2. Циклогексан и его производные получают гидрированием бензола:  6.2. Химические свойства циклоалканов 1. Малые циклы (С3-С4), вследствие специфики строения вступают в реакции присоединения с разрывом С-С связи в цикле, циклы с большим числом атомов углерода сходны по химическим свойствам с алканами. Малые циклы присоединяют галогены, галогеноводороды, водород ( циклобутан не присоединяет галогеноводороды, только водород и галогены) а)  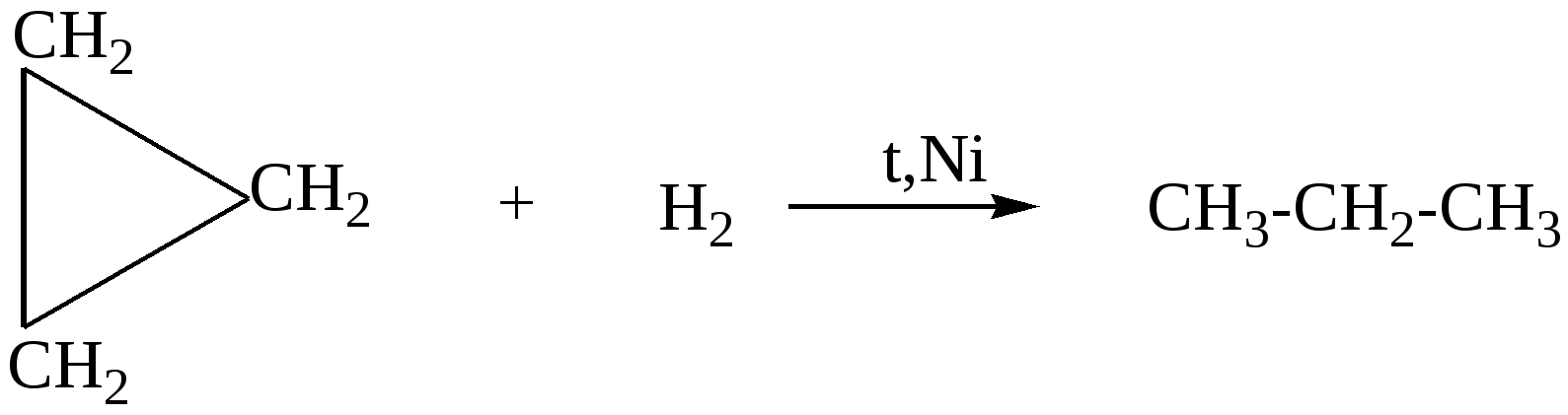 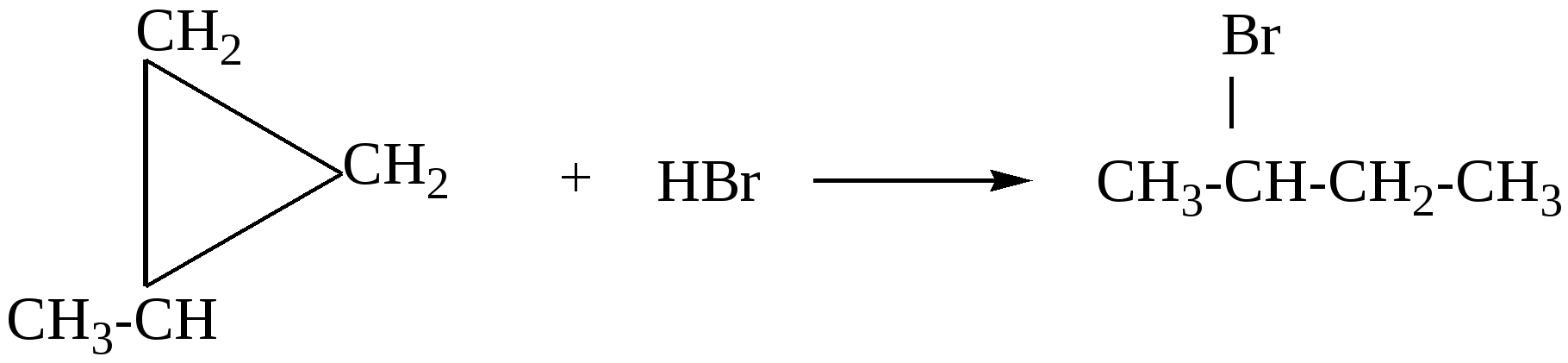 б) Окисление происходит с разрывом цикла. Например, при окислении циклобутана образуется бутандиовая кислота. 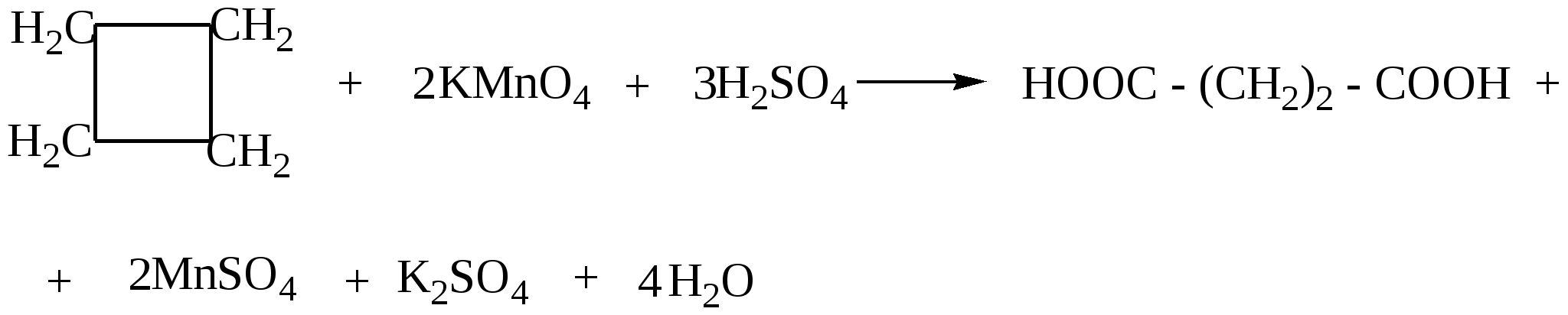 -2 +3 2 C - 10 ē = 2 C процесс окисления +7 +2 Mn + 5 ē = Mn процесс восстановления 2. Большие циклы ( n>5) с HaI2 реагируют без разрыва цикла, с галогеноводородами в реакции не вступают, нагревание в присутствии никеля приводит к реакциям дегидрирования, при этом образуются ненасыщенные циклические соединения 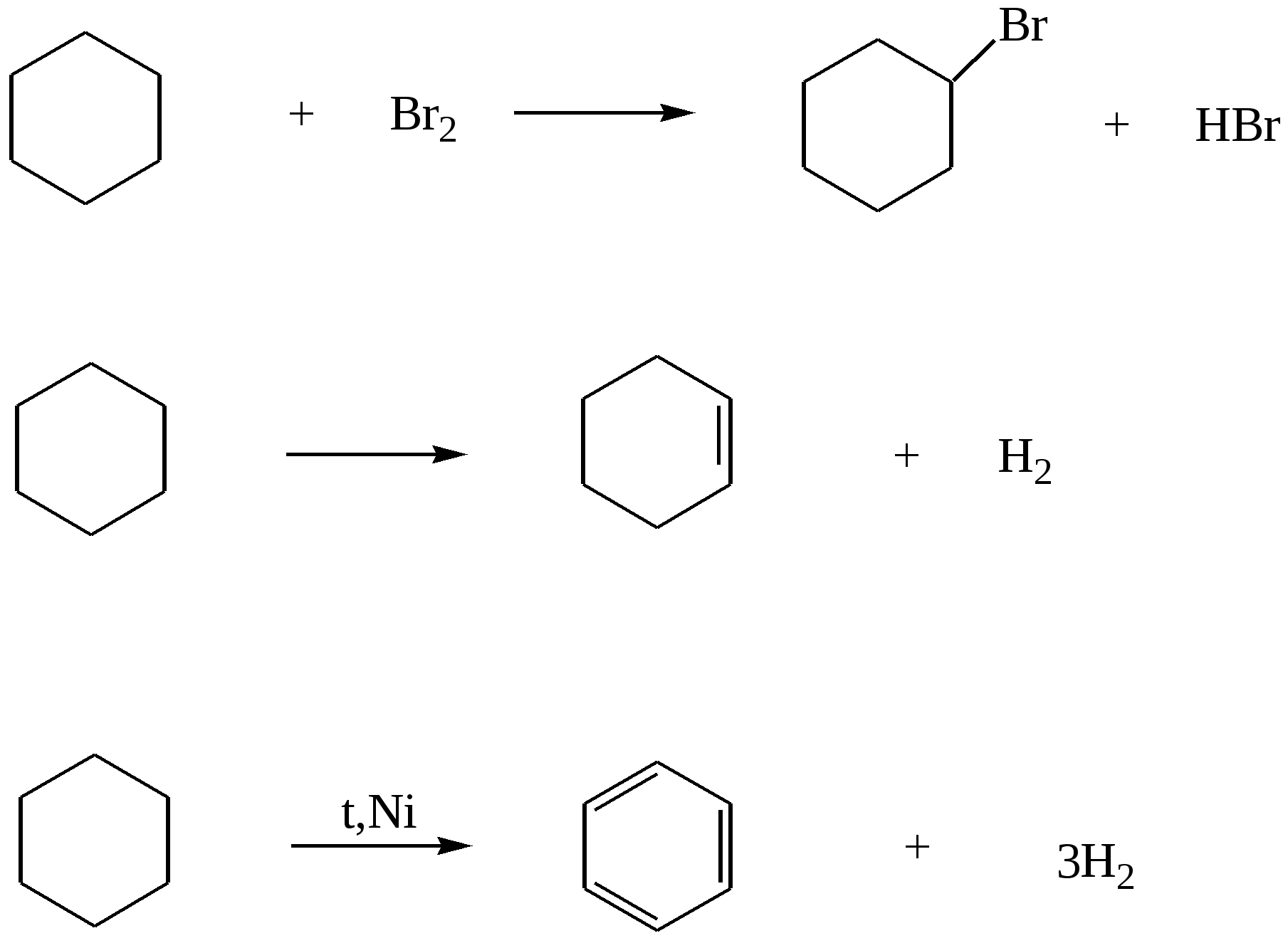 6.3. Примеры решения задач |
