Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
11.3. Примеры решения задачПример 32.При электролизе водного раствора соли некоторой карбоновой кислоты,на аноде выделилась газовая смесь с плотностью по воздуху Dв=1,356 Определить, раствор какой соли подвергали электролизу? Решение: 1) При электролизе водных растворов солей карбоновых кислот на аноде протекает окисление карбоксилат - аниона Анод: 2RCOO ¯ 2е 2х х 2х 2) Пусть электролизу подверглось 2х моль соли Тогда в соответствии с уравнением окисления карбоксилат-аниона в газовой смеси находится х моль алкана и 2х моль углекислого газа. Мольная (объёмная) доля алкана φ(алкана)= 1/3 = 0,333, а углекислого газа φ(СО2)= 2/3 = 0,666 3) Определяем среднюю молярную газовой смеси: Mср( газ. см.) =29∙1,356=39,324г/моль. 4) Тогда 39,324 = М(алкана)∙ 0,333 + 44∙0,666 5) Откуда: М(алкана) = 30 Следовательно, углеводородом является С2Н6 (этан). Ответ: подвергали электролизу соль уксусной кислоты). 11.4. Задачи и упражнения для самостоятельного решения350. Приведите структурные формулы кислот: а)диметилпропановой; б) 3-метилбутановой;в)4-метил-2-этилпентановой; г)2,2,3-триметилбутановой;д) 3,5-диметил-4-этилгексановой 351. Напишите структурные формулы всех изомерных кислот состава С5Н10О2 . Назовите их. 352. Приведите структурные формулы всех изомерных ненасыщенных кислот состава С4Н6О2 и дикарбоновых кислот С5Н8О4. Назовите их. 353. Напишите структурные формулы кислот: а)бензойной; б) 2,4,6-триметилбензойной; в) 1,2-бензолдикарбоновой(фталевой); г)1,4-бензолдикарбоновой(терефталевой);д)1,2,4-бензолтрикарбоновой. 354. Напишите структурные формулы всех изомерных монокарбоновых ароматических кислот состава С8Н8О2 и дикарбоновых кислот состава С8Н6О4. Назовите их. 355. Объясните изменение кислотности в приведённых ниже рядах: а) НСООН > СН3СООН > СН3СН2СООН; б)CH3COOH < ClCH2COOH < Cl3CCOOH; в) CH3CH2COOH < BrCH2CH2COOH < CH3CHBrCOOH. 356. Расположите в ряд по увеличению кислотности следующие соединения: а) CH3COOH, HCOOH; б) CCl3COOH, Cl2CHCOOH, ClCH2COOH; в) CH3COOH , Br CH2COOH, ClCH2COOH; 357. Произойдёт ли реакция, если добавить: а) к сульфату натрия уксусную кислоту; б) к карбонату натрия этановую кислоту; в) к ацетату магния азотную кислоту? Напишите соответствующие уравнения реакций. 358. Укажите, как с помощью трехстадийного синтеза можно получить 3-гидроксипропионовую кислоту по следующей схеме: пропионовая кислота 3-гидроксипропановая кислота. 359. Получите бензойную кислоту из метана без использования других органических веществ. Напишите уравнения соответствующих реакций. 360. Напишите уравнения реакций акриловой кислоты со следующими соединениями: а)Na2CO3; б)C2H5OH(H+); в) HBr; г) Br2. 361. Напишите уравнения реакций согласно схеме превращений пропанол-1 362. Установите соотвествия между частями уравнений химических реакций:
363. Какие два вещества вступили в реакцию, если при этом образовались следующие вещества (указаны все продукты реакции без коэффициентов): а) CH3COOH + H2O; б) C2H5COOH +HCl; в)C2H5COOH; г)C2H5COOH +NH4Cl ? 364. Приведите пример органического соединения, которое может реагировать и с магнием, и с гидроксидом натрия, и с этанолом. Напишите уравнения реакций. 365. Как можно доказать присутствие муравьиной кислоты в уксусной кислоте? 366. Из 1-хлорпропана, не используя других углеродсодержащих соединений, получите изопропиловый эфир пропионовой кислоты. 367. Какие соединения образуются при электролизе водного раствора ацетата натрия? 368. Разделите смесь, состоящую из бензола, фенола, этанола и этановой кислоты. Напишите уравнения соответствующих реакций. 369. Смесь бензойной кислоты и фенола обработали бромной водой до прекращения обесцвечивания. При этом израсходовано 759 г бромной воды с массовой долей брома 3,2%, затем смесь обработали 10% водным раствором гидроксида натрия, которого потребовалось 60 г. Определите состав исходной смеси в массовых долях. 370. При окислении 400 г водного раствора муравьиной кислоты аммиачным раствором оксида серебра образовалось 8,64 г осадка. Вычислите массовую долю кислоты в исходном растворе. 371. При сплавлении натриевой соли одноосновной органической кислоты с гидроксидом натрия выделилось 11,2 л (н.у.) газообразного органического соединения, которое при нормальных условиях имеет плотность 1,965 г/л. Определите массу соли, вступившей в реакцию, и какой газ выделился. 372. Сколько граммов гидроксида калия потребуется для нейтрализации 150 г. раствора, содержащего 9% уксусной кислоты по массе. 373. При окислении 22 г. первичного спирта было получено 25,5 г одноосновной карбоновой кислоты с тем же числом углеродных атомов в молекуле, что и у исходного спирта. Определите строение возможных продуктов реакции. 374. Электролизу подвергли водный раствор 11,2 г. пропионата калия. Определите объем и структуру углеводорода, выделивщегося на аноде (выход 70%). 375. При взаимодействии 11,09 г. предельной одноосновной органической кислоты с избытком гидрокарботата натрия выделилось 3,36 литра (н.у.) углекислого газа. Определите строение органической кислоты. 376. Какой объем 70%-ной кислоты (плотность 1,07 г/мл) можно получить при окислении этанола массой 92 г? 377. Образец предельной одноосновной органической кислоты массой 3,7 г нейтрализовали водным раствором гидрокарбоната натрия. При пропускании выделившегося газа через известковую воду было получено 5,0 г осадка. Какая кислота была взята, и каков объем выделившегося газа (н.у.)? 378. При обработке 12 г смеси предельной одноосновной кислоты А и одноатомного предельного спирта Б (весовое соотношение веществ в смеси 1:1) избытком водного раствора гидрокарбоната натрия выделилось 2,24 л СО2. Какое строение имеют кислота А и спирт Б, если они содержат одинаковое число атомов углерода в молекуле. 379. 58,2 г смеси пропилового спирта и предельной одноосновной органической кислоты (в молекулярном соотношении 2:1) обработали избытком цинковой пыли. Выделившийся при этом газ полностью прореагировал (в присутствии платинового катализатора) с 3,36 л бутадиена -1,3 (t кип = -4˚ C), превратив его целиком в смесь изомерных бутенов. Какая кислота содержалась в исходной смеси? 380. Какова структурная формула предельной одноосновной кислоты, если объем СО2, образующегося при сожжении некоторого ее количества, в 3 раза больше объема СО2, выделившегося при действии на такое же количество кислоты водного раствора гидрокарбоната натрия? 381. Имеется 3 пробирки с олеиновой кислотой, стеариновой кислотой и глицерином. Какими химическими реакциями можно определить, в какой из пробирок находится каждое из перечисленных веществ.Какое количество глицерина потребуется для получения 89 г тристеарата глицерина? Глава 12. СЛОЖНЫЕ ЭФИРЫ И ЖИРЫ Сложные эфиры – производные карбоновых кислот, у которых гидроксил (ОН) в карбоксиле замещён спиртовым остатком – алкокси группой –OR(спиртовой остаток спирта ROH)/ Общая формула сложных эфиров R1-COO-R2. Название сложного эфира состоит из названия радикала, образующего спирт, и названия карбоксилат-аниона. Например, СН3СООС2Н5 – этиловый эфир уксусной кислоты, или этилацетат; этилэтаноат. Изомерия сложных эфиров определяется изомерией кислот и спиртовых остатков. Сложные эфиры низкомолекулярных и среднемолекулярных кислот и спиртов – жидкости с приятным фруктовым запахом, высокомолекулярные – твёрдые вещества без запаха. Сложные эфиры – плохо или практически нерастворимы в воде Хорошо растворяются во многих органических растворителях. Жиры - это природные полные сложные эфиры глицерина и высших жирных монокарбоновых кислот с неразветвлённой углеродной цепью, содержащих чётное число углеродных атомов (4-24). В состав жиров входят насыщенные и ненасыщенные карбоновые кислоты. Животные жиры содержат преимущественно остатки насыщенных кислот-стеариновой (С17Н35СООН), пальмитиновой С15Н31СООН. Растительные жиры(масла) – в основном жидкие смеси триглицеридов (исключение-кокосовое масло, пальмовое масло и другие), содержащих преимущественно остатки ненасыщенных карбоновых кислот: олеиновой кислоты С17Н33СООН, линолевой С17Н31СООН, линоленовой С17Н29СООН.В состав природных жиров входят различные остатки кислот. Так, например, основной частью коровьего масла является сложный эфир, содержащий остатки олеиновой, пальмитиновой и бутановой(масляной) кислот. 12.1. Получение сложных эфиров 1. Взаимодействие карбоновой кислоты со спиртом t,H+ СН3СООН + С2Н5ОН = СН3−СОО−С2Н5 + Н2О 2. Взаимодействие ангидрида карбоновой кислоты со спиртом (СН3−СО)2O + СН3ОН = СН3−СОО−СН3 + СН3СООН 3. Взаимодействие хлорангидрида карбоновой кислоты со спиртом С2Н5−СО − Cl + C3H7OH = C2H5−COO−C3H7 + HCl 12.2. Химические свойства сложных эфиров и жиров. 1. Гидролиз- наиболее важная реакция для сложных эфиров: R1-COOR2 + H2O = R1-COOH + R2OH Сложные эфиры гидролизуются в кислой и щелочной среде, причем щелочной гидролиз – реакция необратимая. RCOOR’ + KOH а) Кислотный гидролиз жира 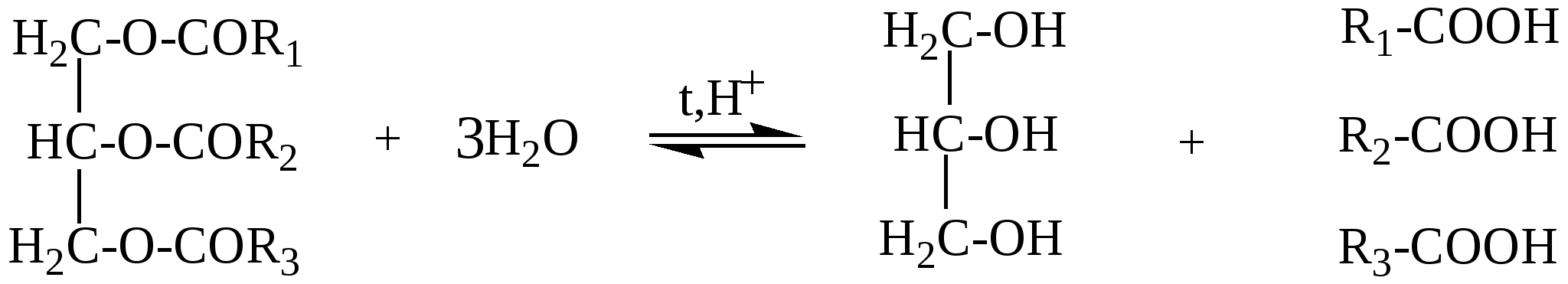 жир глицерин карбоновые к-ты При кислотном гидролизе жиров получают глицерин и высшие карбоновые кислоты. б) Щелочной гидролиз жира  При щелочном гидролизе жиров образуются глицерин и соли высших карбоновых кислот. Соли высших карбоновых кислот называются мылами. Щелочной гидролиз практически необратим. 2. Переэтерификация а) алкоголиз- замена спиртового остатка на другой спиртовой остаток R1-COOR2 + R3OH = R-COOR3 + R2OH б) ацидолиз- замена кислотного остатка на другой кислотный остаток R1-COOR2 + R3COOH = R3-COOR2 + R1-COOH 3. Восстановление – при восстановлении образуется два спирта. Восстановители – натрий в кипящем спирте или алюмогидрид лития. R1-COO-R2 + [H] 4. Образование амидов При взаимодействии с аммиаком, а также с первичными и вторичными аминами сложные эфиры превращаются в амиды кислот и спирты. CH3-COO-C2H5 + NH3 5. Реакции по двойной связи Жидкие жиры (растительные масла) содержат ненасыщенные карбоновые кислоты. Поэтому для них также характерны реакции присоединения по двойной связи. а) Гидрогенизация жиров При гидрировании жидкие жиры превращаются в твердые.  триолеат глицерина тристеарат глицерина б) Взаимодействие с бромной водой 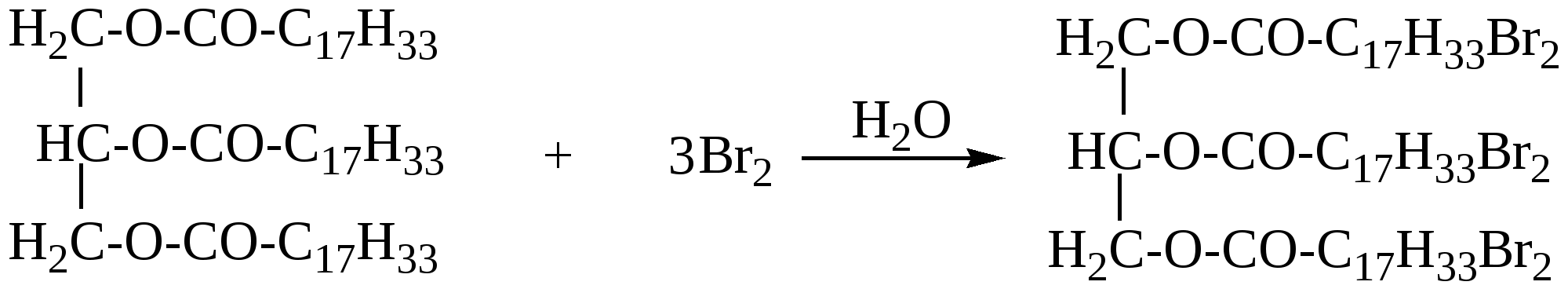 в) Присоединение галогеноводородов 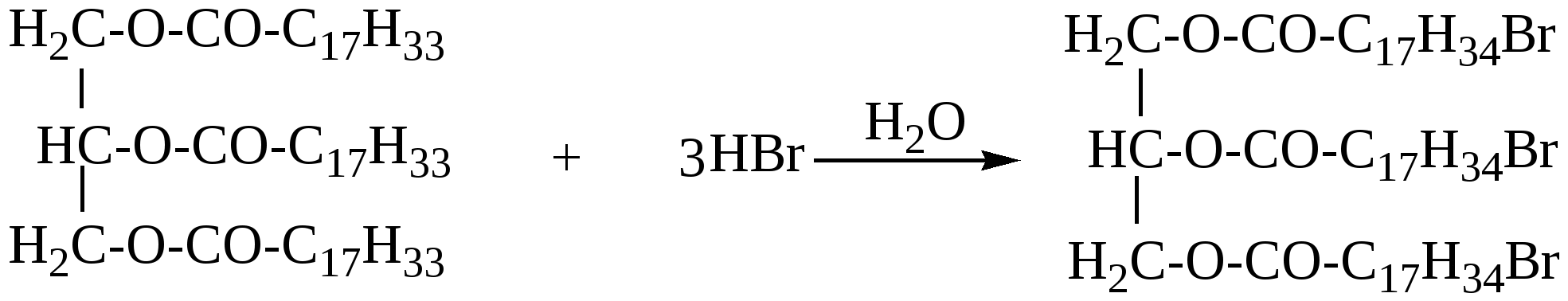 г) Присоединение воды 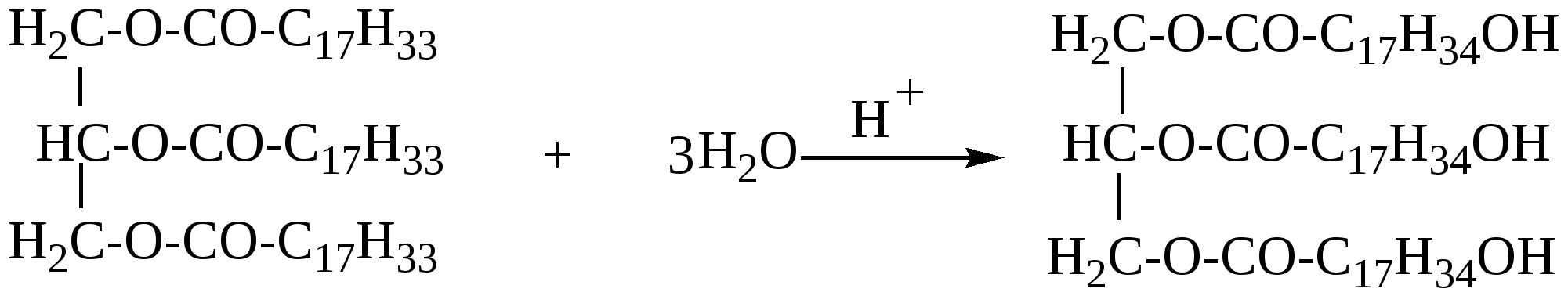 12.3. Примеры решения задач Пример 33. Некоторое количество смеси, содержащей 85%этилформиата и воду, обработали избытком натрия. При этом выделилось 4,48 л. газа (н.у). К такому же кол-ву исходной смеси добавили каплю серной кислоты и нагрели до установления равновесия, затем равновесную смесь охладили и также обработали натрием. При этом выделилось 6,72 л. газа (н.у.). Определить массовые доли веществ в равновесной смеси. Решение: 1) В данной смеси с натрием реагирует только вода. Напишем уравнение реакции: Н2О+Na n(H2)=4,48/22,4=0,2 моль 2) Тогда n(H2O) в исходной смеси 0,2∙2 = 0,4(моль), а масса воды в исходной смеси m(H2O)=0.4∙18=7,2 (г) 3) Масса исходной смеси m(смеси)=7,2/0,15 = 48 г, а масса эфира в исходной смеси m(эфира)=48 – 7,2 = 40,8(г) 4) n(эфира) в исходной смеси n(эфира) = 40,8/74 = 0,55 (моль) 5) Уравнение реакции гидролиза эфира: НСООС2Н5 + Н2О = НСООН + С2Н5ОН было 0,55 0,4 0 0 прореаг. х х - - в равн. 0,55-х 0,4-х х х смеси 6) Напишем уравнения реакций взаимодействия компонентов равновесной смеси с натрием Н2О + Na 0,4-x 0,2-0,5x HCOOH +Na x 0,5x C2H5OH + Na x 0,5x 7) Количество выделившегося водорода по условию задачи: n(H2) =6,72/22,4 = 0,3; Это равно 0,2 -0,5x + 0,5x +0,5x = 0,2 + 0,5x Следовательно 0,2+0,5x = 0,3, откуда х=0,2 8) Тогда количество веществ в равновесной смеси: n(эфира) = 0,55 – 0,2 = 0,35(моль) n(воды) = 0,4 – 0,2 = 0,2(моль) n(кислоты) = 0,2(моль) n(спирта) = 0,2(моль) 9) Массы веществ в равновесной смеси: m(эфира) = 0,35∙74 = 25,9(г), m(воды) = 18∙0,2 = 3,6(г). m(кислоты) = 46∙0,2 = 9,2(г), m(спирта) = 46∙0,2 = 9,2(г). 10) Массовые доли веществ в равновесой смеси: ω(эфира) =25,9: 48 =0,5396; ω( воды) = 3,6:48 =0,075; ω (кислоты) = ω (спирта) = 9,2:48 =0,1916. Ответ: ω(эфира) =0,5396; ω(воды) = 0,075; ω(кислоты) =ω(спирта) = 0,1916. 12.4. Задачи и упражнения для самостоятельного решения 382. Напишите структурную формулу 2-метилпропилпропионата. 383. Напишите структурную формулу сложного эфира СН3СН2СООСН2СН2СН3. 384. Составьте уравнения реакций получения эфиров: а)метилформиата; б)этилпропионата; в)пропилпропионата; г)пропилформиата. 385. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: а) СН2=СН2 б) С2Н2 СН3СООСН3 в) С3Н8 C2H5COOH C2H4ОНCOOC3H7; 386. Из 1-хлорпропана, не используя других углеродсодержащих соединений, получите изопропиловый эфир пропионовой кислоты. 387. Опишите процессы, происходящие при добавлении в раствор фенола в пропилацетате избытка щелочи, последующем нагревании смеси и обработке её бромоводородной кислотой до окончания всех реакций. 388. Напишите структурную формулу сложного эфира, образованного глицерином : а) с пальмитиновой, стеариновой и масляной кислотами; б )с олеиновой,линолевой и линоленовой кислотами. 389. Напишите уравнения реакций гидролиза этилформиата в кислой и щелочной средах. 390. Напишите уравнения реакций восстановления водородом: а) метилпропионата; б) этилацетата, 391. Напишите уравнения реакций гидролиза тристеарата в кислой и щелочной средах. 392. Напишите уравнение реакции гидрогенизации триолеата глицерина. 393. Опишите процессы, протекающие при добавлении избытка бромной воды в смесь акриловой кислоты и жира, содержащего два остатка олеиновой кислоты и один остаток линолевой, и последующей обработки полученной смеси избытком водного раствора щелочи при кипячении. 394. Органическое соединение содержит 48,65% углерода , 8,11% -водорода, 43,24 % - кислорода. Определить формулу этого вещества, если известно, что его молекулярная масса = 74 г/моль. Составьте структурные формулы изомеров этого соединения. 395. В результате полного гидрирования смеси жиров, содержащих только остатки пальмитиновой и линолевой кислот было получено 788.4 г твердого вещества, При этом было затрачено 100.82 л водорода (н.у.). Полученное вещество при нагревании обработали 1.82 л раствора гидроксида натрия с массовой долей щелочи 10% и с плотностью 1.1 г/мл. Определите массовые доли вещества в полученной смеси. 396. При гидролизе 31,2 г сложного эфира этиленгликоля получено 18 г предельной одноосновной кислоты, на нейтрализацию которой пошло 120 г 10%-ного водного раствора гидроксида натрия. Установите формулу исходного сложного эфира. 397. Сколько г сложного эфира СН3СООСnH2n+1 получится из 13,8 г спирта и избытка уксусной кислоты , если при действии избытка натрия на 22,6 г. Этого спирта выделилось 6, 72 л. (н.у.) водорода (выход =100%), а в выход реакции этерификации = 50%). 398. Некоторое количество смеси, содержащей этилацетат и 10% воды, обработали избытком натрия. При этом выделилось 3,92 л. газа (н.у). К такому же кол-ву исходной смеси добавили каплю серной кислоты и нагрели до установления равновесия, затем равновесную смесь охладили и также обработали натрием. При этом выделилось 7,28 л. газа (н.у.). Определите массовые доли веществ в равновесной смеси. 399. При нагревании 36,4 г. смеси этанола и этановой кислоты в присутствии серной кислоты образовалось 26,4 г. сложного эфира. Исходную смесь сожгли в избытке кислорода. Продукты сгорания пропустили через раствор гидроксида кальция, при этом образовалось 140 г осадка. Определите состав исходной смеси и выход реакции этерификации. 400. Водный раствор стеарата калия массой 150 г с массовой долей растворенного вещества 6% обработали 100 мл 0,2 М соляной кислоты. Вычислите массу образовавшегося осадка. 401. Какая масса глицерина образуется при щелочном гидролизе 331,5г триолеата? 402. При гидролизе 356 г жира, образованного одной карбоновой кислотой, образовалось 36,8 г глицерина. Установите структурную формулу жира. Напишите уравнения реакций и укажите условия их протекания. 403. Относительная плотность паров сложного эфира по водороду равна 30. Приведите структурную формулу этого эфира. 404. Плотность паров сложного эфира по гелию равна 22. При сгорании всей получившейся в результате гидролиза кислоты образуется углекислого газа больше, чем при сгорании получившегося в ходе той же реакции спирта. Установите структурную формулу этого эфира. 405. Для гидролиза смеси этилацетата и метилпропианата потребовалось 120 г 20%-ного раствора карбоната калия. Вычислите массу смеси. 406. Жир массой 44,5 г, представляющий собой триглицерид одной предельной органической кислоты, нагрели с 70 мл 20%-ного раствора гидроксида натрия (плотность 1,2 г/мл) . Для нейтрализации избытка щелочи потребовалось 22,5 мл 36,5%-ной соляной кислоты (плотность 1,2 г/мл). Установите структурную формулу жира. 407. Для полного омыления 42,6 г растительного масла потребовалось50 г 12,0% - ного раствора гидроксида натрия. При последующей обработке раствора избытком бромной воды получена смесь тетрабромпроизводного и дибромпроизводного в молярном соотношении 2:1, причем массовая доля натрия в одном из бромпроизводных составляет 3,698%.Установите возможную формулу жира. 408. Какая масса глицерида уксусной кислоты получится при взаимодействии уксусной кислоты с избытком глицерина, если при действии соды на такое же количество уксусной кислоты образуется 6,72л(н.у.)СО2? 409. Некоторое количество смеси, содержащей 80,4% метилового эфира пропионовой кислоты и воду, обработки избытком металлического натрия. При этом выделилось 2.24 л газа (н.у.). К такому же количеству исходной смеси добавили каплю серной кислоты и нагрели до установления равновесия, затем равновесную смесь охладили и так же обработали избытком натрия, при этом выделилось 3,36 л газа (н,у.). Определите массовые доли веществ в равновесной смеси (реакцией натрия с серной кислотой пренебречь). |
