Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
|
Глава 13. УГЛЕВОДЫ Углеводы- класс природных соединений, включающий простые углеводы (моносахариды) и сложные. Моносахариды являются гетерофункциональными соединениями, в молекулах которых одновременно содержатся карбонильная (альдегидная или кетонная) и несколько гидроксильных групп. Большинство этих веществ имеет состав, соответсвующей общей формуле CnH2nOn.Наиболее распространены в природе пентозы(5 углеродных атомов) и гексозы(6 углеродных атомов). Все моносахариды имеют один или несколько асимметрических атомов углерода и поэтому имеют стереоизомеры( D и L). Нумерация цепи в углеводах начинается от атома углерода карбонильной группы или от того атома углерода, к которому она ближе находится. Примеры стереоизомеров глюкозы и фруктозы: 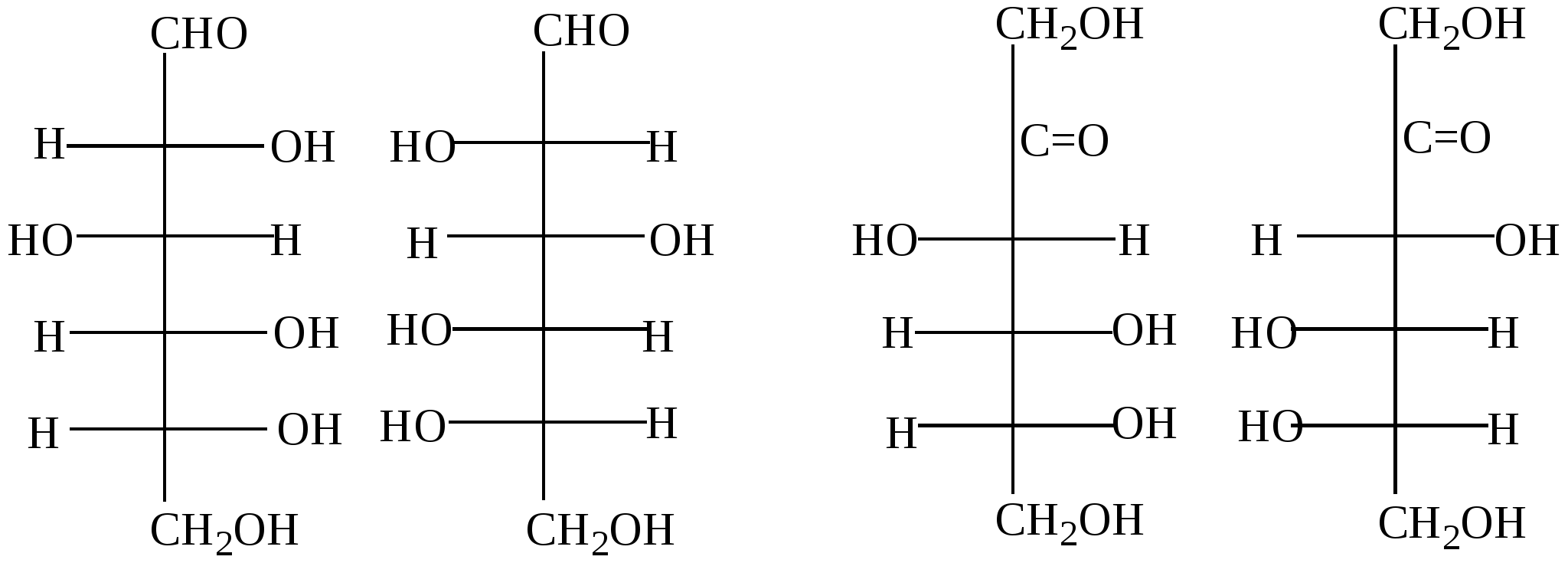 D-глюкоза L-глюкоза D-фруктоза L-фруктоза Моносахариды в растворе присутствуют в основном не в открытой (линейной) форме, а в циклической, которая является продуктом взаимодействия спиртового гидроксила и карбонильной группы. Таким образом, моносахариды представляют собой циклические полуацетали- пяти или шестичленные. Например, циклические формы β-рибозы и β-дезоксирибозы , входящие в состав нуклеиновых кислот: 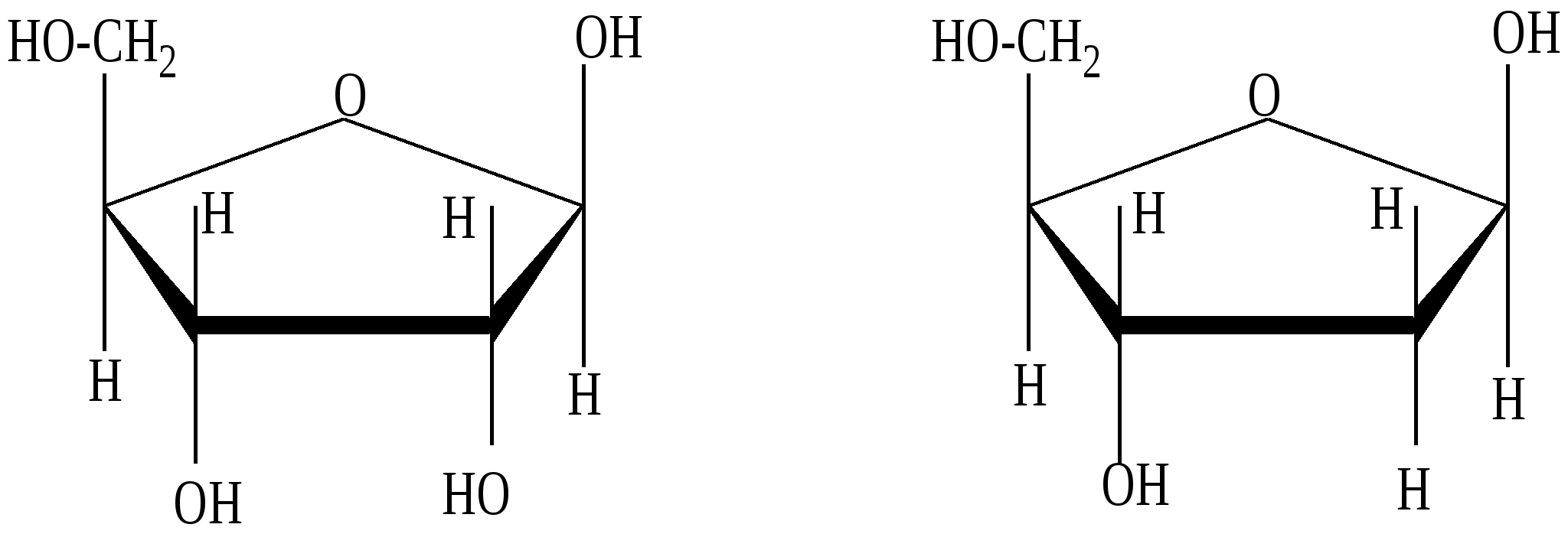 β - рибоза β - дезоксирибоза Сложные углеводы – углеводы, способные гидролизоваться с образованием простых углеводов. Сложные углеводы подразделяются на олигосахариды и полисахариды. Олигосахариды при гидролизе дают несколько молекул моносахаридов, полисахариды-множество таких молекул. Важнейшими олигосахаридами являются дисахариды. Наибольшее значение из дисахаридов имеет сахароза – свекловичный или тростниковый сахар С12Н22О11, который при гидролизе даёт глюкозу и фруктозу. Полисахариды – это сложные сахара, каждая молекула которых при гидролизе распадается на большое число молекул моносахаридов(от 30 тысяч до 400 миллионов).Состав полисахаридов можно выразить формулой (С6Н10О5)n. Все они состоят из остатков молекул глюкозы, соединённых друг с другом. Наибольшее значение из полисахаридов имеют крахмал( полимер α– глюкозы) и целлюлоза( полимер β – глюкозы) 13.1. Химические свойства углеводов Для глюкозы характерны многие реакции простых альдегидов. 1. Окисление а) При окислении мягкими окислителями (бромная вода) получается глюконовая кислота 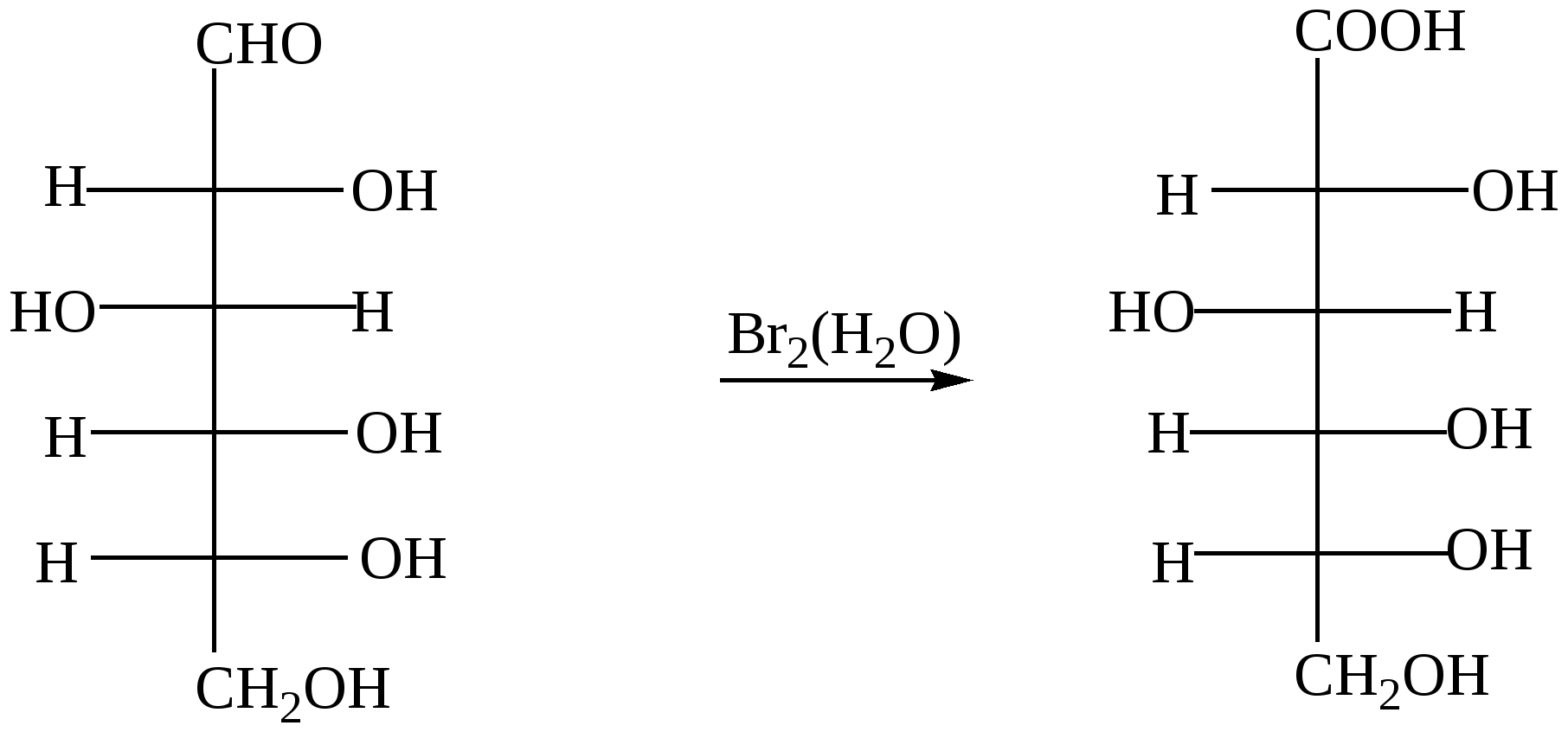 D- глюкоза D- глюконовая кислота Подобно обычным альдегидам моносахариды, в частности, глюкоза, легко окисляются аммиачным раствором оксида серебра [Ag(NH3)2]OH , проявляя, таким образом, сильную восстанавливающую способность( реакция «серебряного зеркала»). (C5H11O5)CH=O + 2[Ag(NH3)2]OH (C5H11O5)COONH4 + 2Ag↓ + 3NH3 + H2O б) С помощью сильного окислителя (разбавленной азотной кислотой) окисляется вместе с альдегидной группой спиртовая группа, которая находится в конце цепи. При этом образуется сахарная кислота 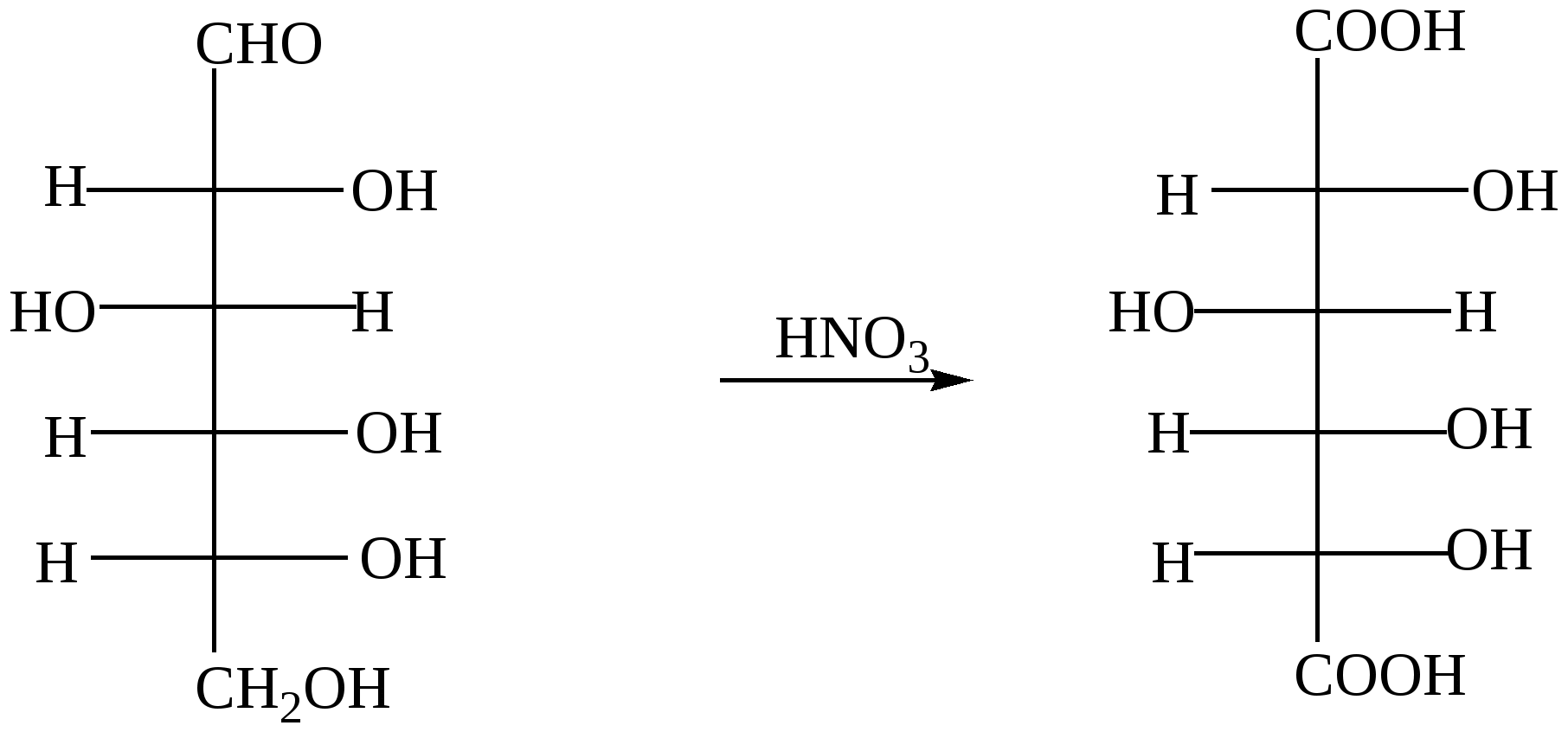 глюкоза сахарная кислота 2. Восстановление При восстановлении с помощью водорода в присутствии катализаторов гидрирования(никель) образуется шестиатомный спирт глюцит(сорбит): 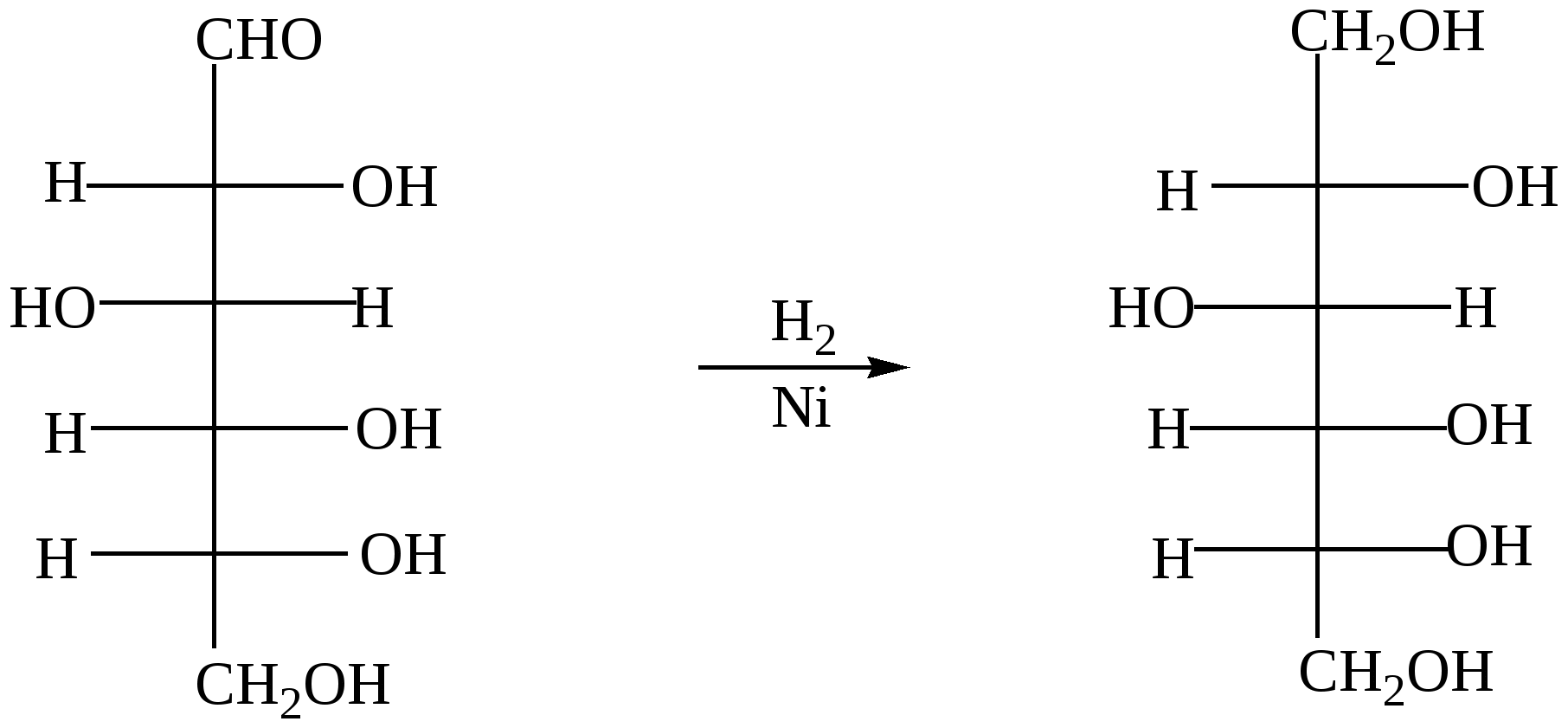 глюкоза сорбит 3. Алкилирование При взаимодействия спиртовых групп моносахаридов алкилгалогенидами образуются простые эфиры: 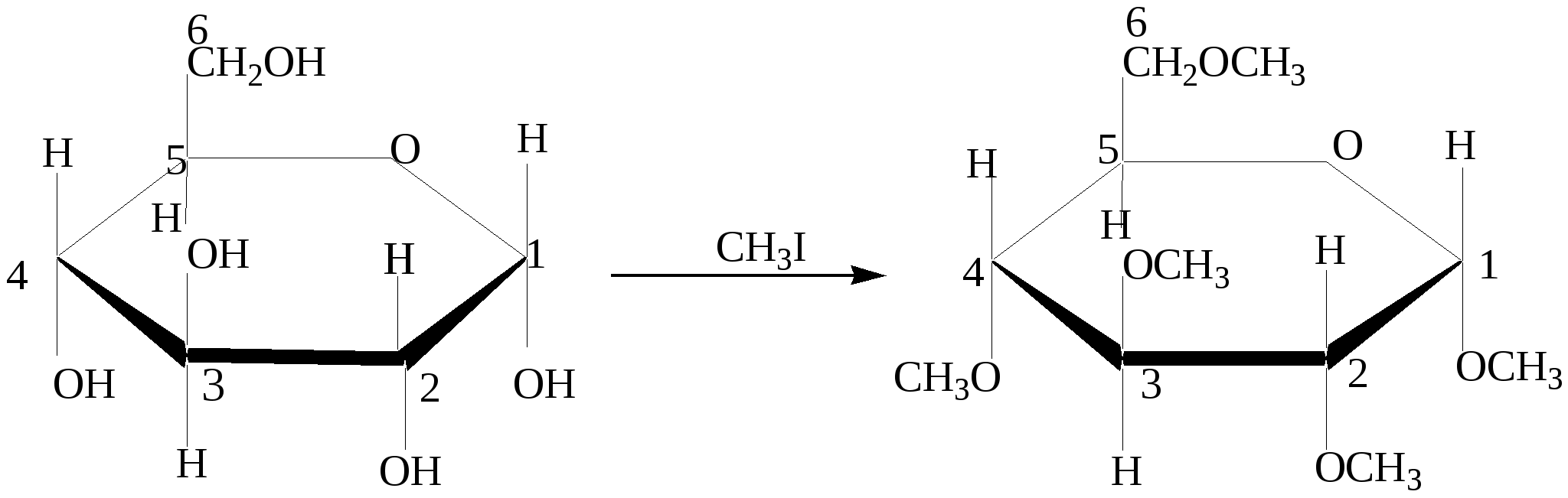 4. Ацилирование При взаимодействии моносахаридов с уксусным ангидридом образуются сложные эфиры с участием всех гидроксильных групп,например:  5. Брожение гексоз Брожение – сложный биохимический процесс под влиянием различных ферментов. а) спиртовое С6Н12О6 б) маслянокислое С6Н12О6 в) молочнокислое С6Н12О6 6. Химические свойства целлюлозы определяются прежде всего присутствием гидроксильных групп. За счёт этих групп целлюлоза даёт простые и сложные эфиры. Например: [C6H7O2(OH)3]n + 3nHNO3(H2SO4) тринитроцеллюлоза 7. Реакция, характерная для многоатомных спиртов-комплексообразование с гидроксидом меди(II) на холоду(интенсивное синее окрашивание). 13.2. Примеры решения задач Пример 34. При маслянокислом брожении глюкозы образовалось 13,44л(н.у.) смеси газообразных веществ. Выход в реакции брожения составил 60%. Какая масса глюкозы была взята для брожения? Решение: 1) Напишем уравнение реакции С6Н12О6 2) Определяем количество вещества газообразных продуктов n = 13,44/22,4 = 0,6 моль 3) Для образования 0,6 моль газов(0,3 моль СО2 и 0,3 моль Н2) в соответствии с уравнением реакции прореагировало 0,15 моль глюкозы. 4) С учётом выхода глюкозы необходимо 0,15/ 0,6 = 0,25 моль Масса глюкозы m(глюкозы) = 0,25∙180 = 45 г Ответ: 45 г Пример 35. Целлюлозу обработали нитрующей смесью(HNO3 и H2SO4), в результате был получен тринитрат целлюлозы. При этом масса нитрующей смеси уменьшилась на 108 г. Определите массу полученной тринитроцеллюлозы (выход 100%). Решение: 1) Напишем уравнение реакции [C6H7O2(OH)3]n + 3nHNO3 х 3х х 3х 2) Пусть прореагирует х моль целлюлозы Тогда в соответствии с уравнением реакции масса нитрующей смеси уменьшится на 3х∙63 и увеличится на 3х∙18. 3) Итого, общий баланс 3х∙63 – 3х∙18 = 3х(63-18) = 135х, что составляет в соответствии с условием 108 г. Тогда 108 = 135х. Откуда х= 0,8(моль) 4) Масса тринитроцеллюлозы равна 0,8∙М(C6H7O2(ONO2)3 = 0.8∙297 = 237,6(г). Ответ: 237,6 г тринитроцеллюлозы 13.3. Задачи и упражнения для самостоятельного решения 410. Какие функциональные группы входят в состав молекулы глюкозы? 411. Какие из следующих углеводов подвергаются гидролизу: а) глюкоза; б) фруктоза; в) крахмал; г)сахароза? 412. Для каких углеводов характерна реакция «серебряного зеркала»: а) целлюлоза; б) глюкоза; в) фруктоза? 413. Напишите уравнения реакций молочно-кислого, спиртового и масляно- кислого брожения глюкозы. 414. Полученное из глюкозы соединение состава С3Н6О3 при взаимодействии с натрием образует соединение С3Н4Na2О3; с СаСО3 – С6Н10СаО6, а с этиловым спиртом в присутствии серной кислоты - С5Н10О3. Напишите уравнения соответствующих реакций и назовите полученные соединения 415. Полученное из глюкозы соединение состава С6Н14О6 при взаимодействии с натрием образует соединение C6H8Na6O6, с Cu(OH)2 - соединение синего цвета, а с избытком уксусной кислоты в кислой среде - С18Н26О12. Напишите уравнения соответствующих реакций и назовите полученные соединения. 416. Идентифицируйте растворы: а) глюкозы и натриевой соли глюконовой кислоты; б) 2.3-дихлорпропаналя и рибозы; в) раствора муравьиной кислоты и раствора смеси уксусной кислоты и глюкозы; г) водного раствора рибозы и раствора смеси этиленгликоля и формальдегида; д) фруктозы, рибозы, пропанола и уксусного альдегида. 417. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: глюкоза этанол 418. Осуществите цепочку превращений, используя два различных ферментативных брожений глюкозы: глюкоза-брожение) С-(NaOHводн) 419. Осуществите превращения: а)глюкоза б) глюкоза в) глюкоза 420. Используя только неорганические вещества и ферменты, получите из глюкозы эфиры пяти кислот и бутанола-2. 421. Смесь больших количеств а) рибозы и фруктозы подвергли полному восстановлению, а полученные продукты обработали малым количеством нитрата натрия и серной кислоты. б) смесь рибозы и дезоксирибозы обработали малым количеством бромида натрия и серной кислоты в ) смесь глюкозы и рибозы обработали малым количеством смеси нитрата калия и серной кислоты. Какие продукты реакции, не содержащие серу, присутствовали в конечной смеси? 422. При спиртовом брожении глюкозы было получено 115 г этанола. Какой объём углекислого газа образовался при этом? 423. При молочнокислом брожении 450 г глюкозы было получено 400 г молочной кислоты. Вычислите выход продукта реакции в %% от теоретического. 424. Рассчитайте массу глюкозы, при спиртовом брожении которой было получено 414 мл 96% этанола (плотность 0,8 г/мл), и это составило 80% от теоретического выхода. 425. Рассчитайте массу глюкозы, которая потребуется для получения из неё этилового спирта брожением, если известно, что при нагревании полученного спирта с концентрированной серной кислотой образуется 100 мл диэтилового эфира (плотность 0925 г/мл), что составляет 50% от теоретически возможного выхода. 426. В результате спиртового брожения виноградного сахара содержащего 20% несахаристых примесей было получено 600 мл 96% спирта(плотность 0,8г/мл). Какая масса виноградного сахара была подвергнута брожению? Какой объём (н.у.) углекислого газа выделился при этом? 427. Рассчитайте массу 80% уксусной кислоты, которую можно получить из спирта образующегося при брожении 100 кг глюкозы. 428. Рассчитайте массу сахарозы, которая при гидролизе образует столько глюкозы, что при брожении последней получается 180 г молочной кислоты. 429. Рассчитайте массу сахарозы, которая подверглась гидролизу, если при взаимодействии продуктов гидролиза с аммиачным раствором оксида серебра было получено 43,2 г серебра. 430. Масса осадка, образовавшегося при нагревании раствора моносахарида с избытком аммиачного раствора оксида серебра, была в 1,2 раза больше массы углевода. Определите формулу углевода. 431. Образец моносахарида разделили на две равные части. Одну часть сожгли в избытке кислорода, а другую подвергли полному гидрированию. Масса образовавшегося углекислого газа была в 132 раза больше массы водорода, пошедшего на гидрирование. Определите формулу углевода. 432. При спиртовом брожении глюкозы получен газ который прореагировал с 80г раствора гидроксида натрия (ω =30%). Рассчитайте массу 60% раствора этанола которая была получкена при этом. 433. При действии избытка гидрокарбоната натрия на молочную кислоту, полученную в результате молочнокислого брожения, выделился газ объёмом 8,96л(н.у.). Определите массу глюкозы подвергнутую брожению. 434. Определите массу 10%-ного раствора глюкозы, подвергшегося маслянокислому брожению, если при этом выделилось столько же газа, сколько его образуется при сгорании 34,5 мл этанола (плотность=0,8 г/мл). 435. Газ, выделившийся при спиртовом брожении 100 г глюкозы, пропустили через 661 мл 8% раствора гидроксида кальция ( плотность раствора 1,05 г/мл). Осадок отделили и прокалили. Определите массовые доли веществ в полученном растворе и массу остатка после прокаливания. Выход брожения глюкозы 90%. 436. Смесь глюкозы с сахарозой обработали избытком аммиачного раствора оксида серебра, при этом выделилось 4,32 г осадка. В результате сгорания такого же количества смеси выделился газ, при пропускании которого через 61 мл 20% раствора КОН ( плотность раствора 1,1 г/мл). Получили раствор, в котором массовая доля кислой соли составила 30%. Определите массу смеси углеводов. 437. Смесь глюкозы и сахарозы обработали избытком аммиачного раствора оксида серебра, при этом выделилось 21,6 г осадка. Такое же количество смеси обработали при нагревании водой в присутствии серной кислоты, а затем избытком аммиачного раствора оксида серебра в результате получили 32,4 г осадка. Определите состав смеси углеводов в массовых долях. 438. Образец целлюлозы массой 3,2436г подвергли полному гидролизу. Полученный раствор обработали избытком аммиачного раствора оксида серебра и получили 0,0432г осадка. Определите число мономерных звеньев в целлюлозе. 439. Образец целлюлозы массой 97,2 г обработали раствором нитрующей смеси, масса нитрующего раствора 252 г. В реакцию нитрования вступила азотная кислота, составляющая 40% от массы исходной нитрующей смеси. Определите массы полученных ди- и тринитратов целлюлозы. Глава 14. АМИНЫ Амины – производные аммиака , органические основания. Классификация 1) Амины могут быть первичными – R-NH2, вторичными – R-NH-R и третичными – R3N. 2) В зависимости от строения углеводородного радикала различают амины: предельные, непредельные, алициклическме, ароматические, гетероциклические и смешанные. 3) По количеству аминогрупп в молекуле могут быть моноамины, диамины и т.д. Номенклатура Для аминов используют номенклатуру IUPAC, радикало-функциональную или тривиальную номенклатуры. Например: C2H5NH2 – этанамин (этиламин); C2H5-NH-CH3 – метилэтиламин; C6H5NH2– фениламин (анилин). 14.1. Получение аминов 1. Алкилирование аммиака и аминов: NH3 + CH3Cl (см. алкилирование аминов). 2. Восстановление нитросоединений (на никелевом катализаторе при нагревании или атомарным водородом в момент выделения): C2H5NO2 + 3 H2(t,Ni) 3 Восстановление амидов (с помощью LiAlH4) CH3- CO-NH2 4. Восстановление нитробензола C6H5NO2 +2Al + 2NaOH + 4H2O C6H5NO2 + 3H2(t,Ni) 14.2. Химические свойства аминов 1. Основность аминов а) В водных растворах амины, как и аммиак, присоединяют протон, образуя аммонийные соединения. Эти растворы имеют щелочную реакцию, так как содержат ионы ОН-. Поэтому амины, как и аммиак, проявляют основные свойства. NH3 + H-OH = [NH4]+ + OH- R-NH2 + H-OH = [R-NH3]+ + OH- Все амины – слабые основания. Их основность зависит от природы и числа углеводородных радикалов, связанных с атомом азота. В общем случае, основность аминов убывает в следующем ряду: алифатические амины > NH3 > ароматические амины. Среди алифатических аминов (в случае одинаковых радикалов): вторичные амины > первичные амины > третичные амины. б) Взаимодействие со щелочами. Щёлочи, являясь более сильными основаниями, вытесняют аммиак и амины из их солей. NH4Cl + NaOH [RNH3]Cl + NaOH в) Реакции с неорганическими кислотами с образованием аммонийных солей: CH3NH2 + HCl г) Взаимодействие с органическими кислотами: Без нагревания – образование аммонийных солей: CH3COOH + CH3NH2 При нагревании – образование амидов: СH3COOH + CH3NH2 д) Взаимодействие с солями более слабых нерастворимых оснований (реакция обмена): AlCl3 + 3 CH3NH2 + 3 H2O 2. Взаимодействие с азотистой кислотой (качественная реакция , позволяющая различить первичные, вторичные и третичные амины): а) первичные амины: СH3NH2 + HNO2 б) вторичные амины: (СH3)2NH +HNO2 в) третичные амины с HNO2 не реагируют. 3. Алкилирование аминов: CH3NH2 + CH3Cl (CH3)2 NH + CH3Cl C6H5NH2 + CH3Cl 4. Взаимодействие с ангидридами и хлорангидридами карбоновых кислот C2H5NH2 + CH3 COCl этилацетатамид C2H5NH2 + (CH3-CO)2O этилацетатамид 5. Комплексообразование (аналогично аммиаку) CuSO4 + 4NH3 CuSO4 + C2H5NH2 6. Горение – при их горении образуется углекислый газ, вода и азот. 4С3H7NH2 + 21O2 4C6H5NH2 + 31O2 7. Особенности ароматических аминов(анилина) Образуют соли только с сильными кислотами: C6H5NH2 + HCl или гидрохлорид анилина) Аминогруппа сильно активирует ароматическое кольцо в реакциях замещения – анилин реагирует с бромной водой при комнатной температуре и без катализатора с выпадением осадка 2,4,6-триброманилина (качественная реакция на ароматические амины):  8. Окисление анилина Другая качественная реакция - при действии хлорной извести образуются продукты с интенсивным фиолетовым окрашиванием. |
