Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
10.2. Химические свойства карбонильных соединений1. Окисление а) Реакция «серебряного зеркала». Альдегиды легко окисляются до кислот при реакции с гидроксидом диаммин серебра(аммиачным раствором оксида серебра). Кетоны окисляются очень трудно, только сильными окислителями с разрывом связи. R-CH=O + 2[Ag(NH3)2]OH Формальдегид избытком аммиачного раствора оксида серебра окисляется до угольной кислоты, которая в аммиачной среде образует карбонат аммония. H-CH=O + 4[Ag(NH3)2]OH В упрощённом виде: 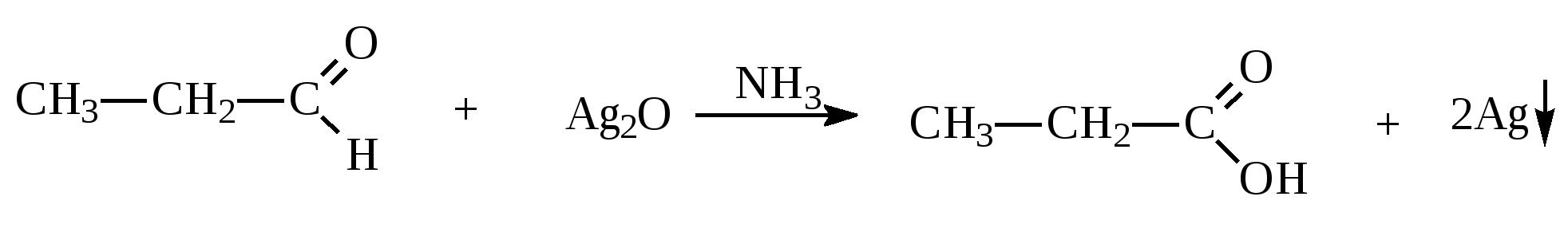 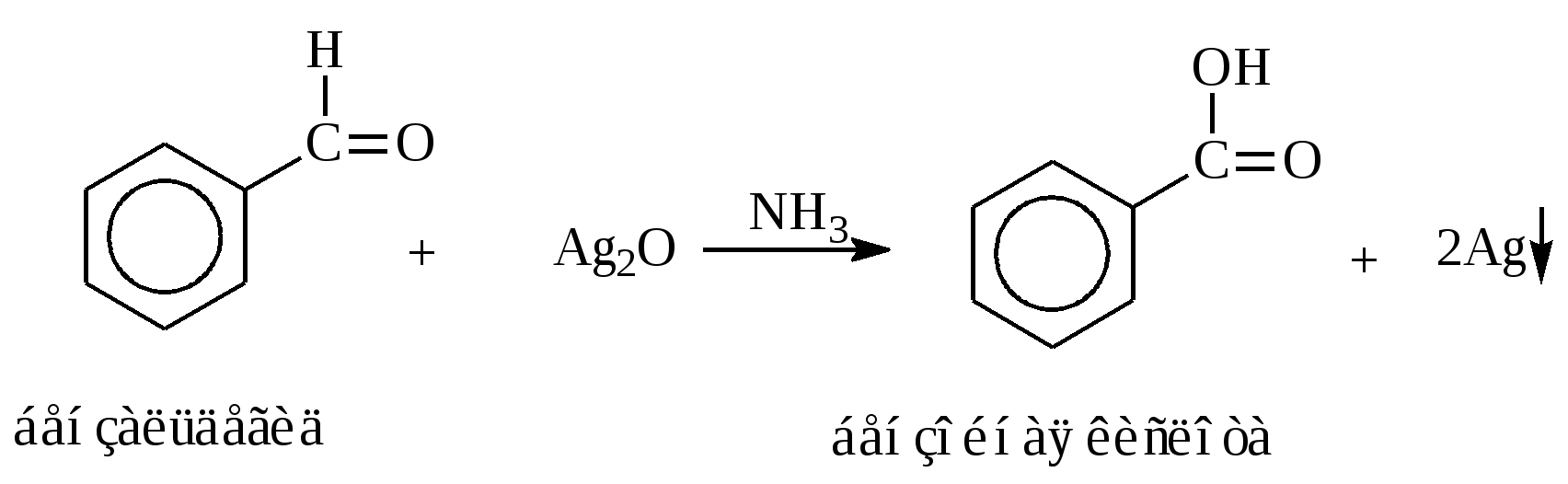 Реакция «серебряного зеркала» является качественной реакцией на карбонильную группу. б) Окисление гидроксидом меди(II)  В результате этой реакции образуется осадок Cu2O красно-кирпичного цвета. Эта реакция также является качественной на альдегиды. Кетоны окисляются очень трудно, только сильными окислителями с разрывом связи. 2. Восстановление. Альдегиды восстанавливаются до первичных спиртов, кетоны до вторичных спиртов. 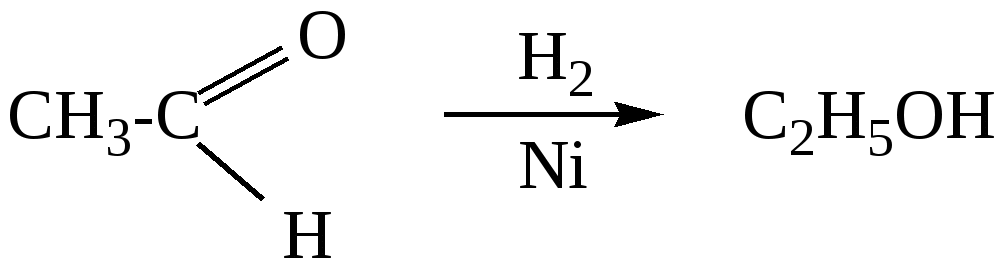 этаналь этанол 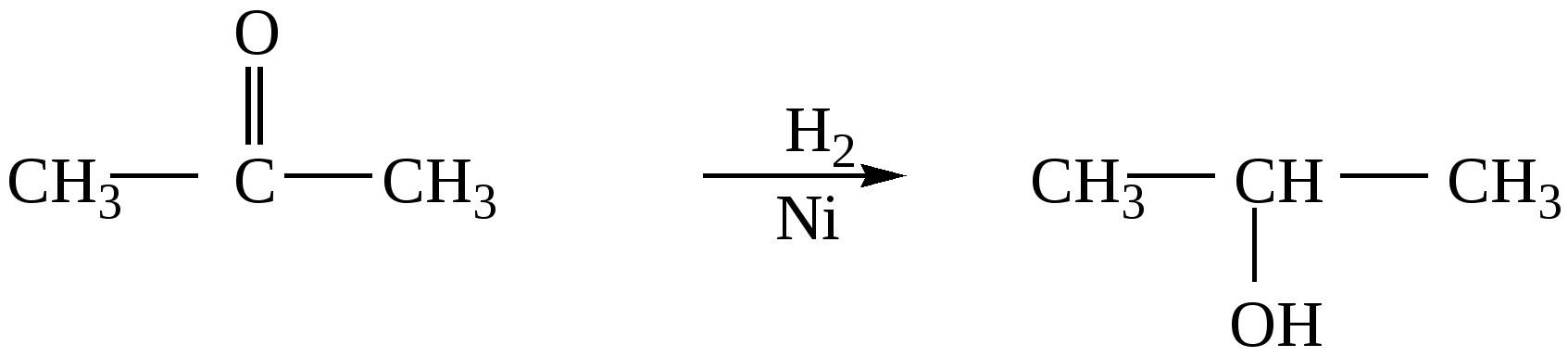 ацетон пропанол-2 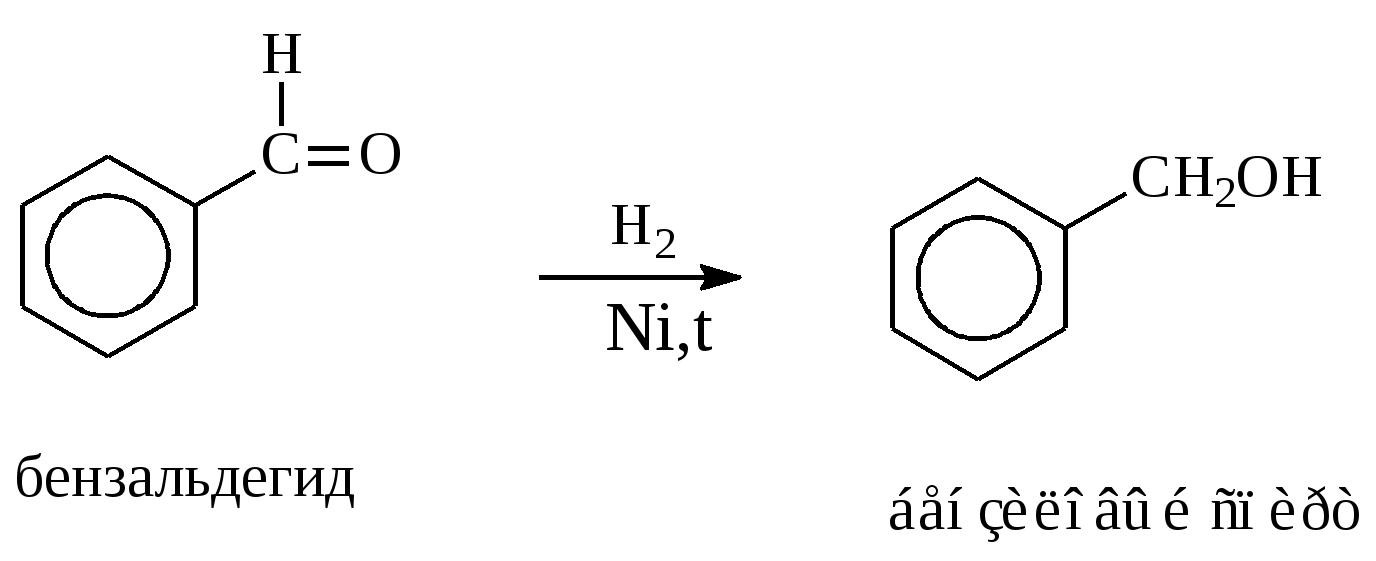 3. Взаимодействие со спиртами - образование полуацеталей и ацеталей. Эта реакция имеет значение в образовании углеводов в циклических формах. ( и - аномеры) 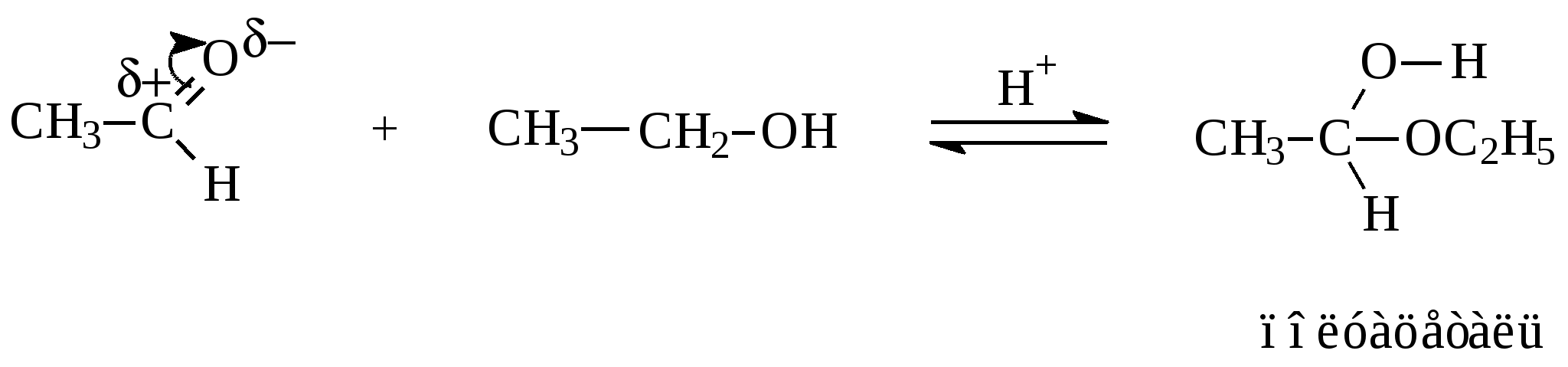 При избытке спирта образуется полный ацеталь. 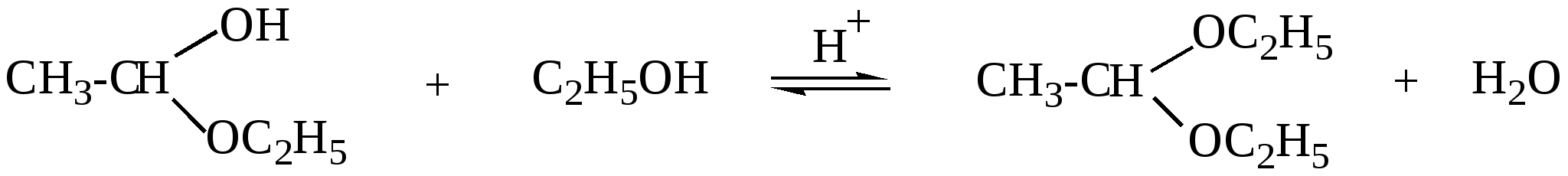 диацеталь уксусного альдегида 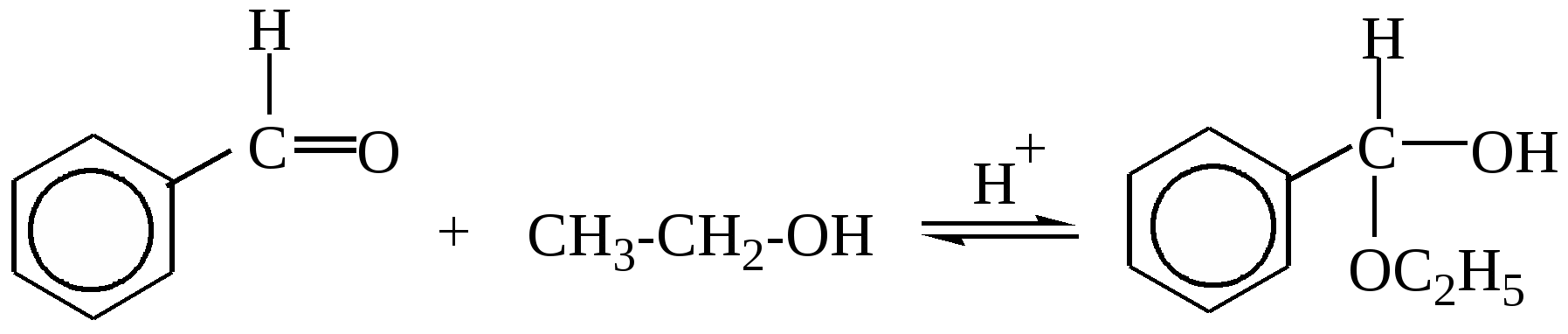 бензальдегид этилацеталь бензальдегида 4. Гидратация Формальдегид в водном растворе гидратирован практически полностью, ацетальдегид – примерно на 50% ,высшие альдегиды и кетоны почти не гидратируются. 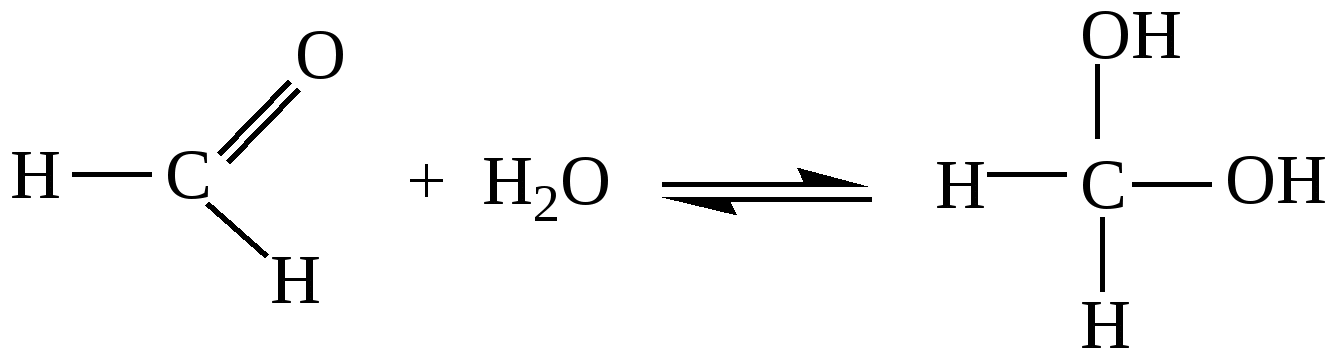 5. Взаимодействие с галогенами. Атом водорода при втором углеродном атоме углеводородной цепи обладает повышенной подвижностью, так как карбонильная группа смещает на себя электронную плотность Поэтому при взаимодействии альдегидов с хлором или бромом атом водорода замещается на галоген. 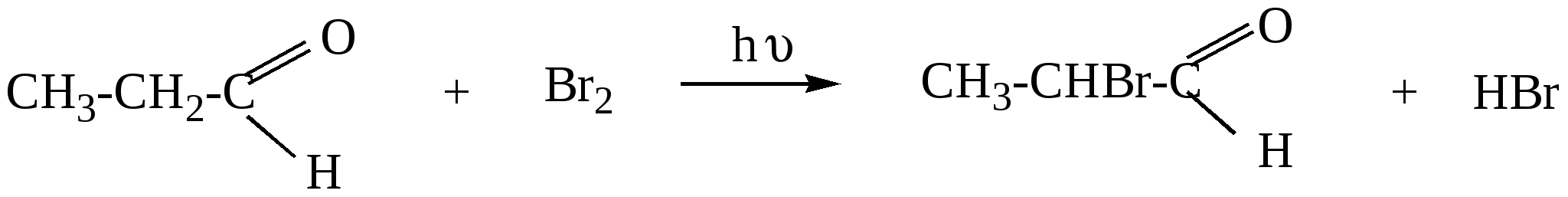 6. Реакции поликонденсации. При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит поликонденсация с образованием высокомолекулярного соединения формальдегидной смолы. 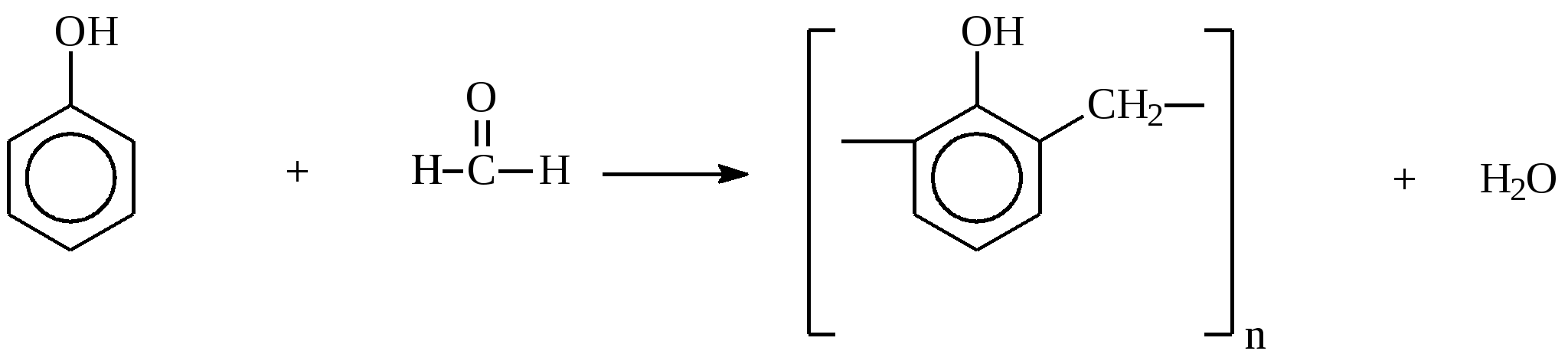 7. Особенности бензальдегида. Так как в бензальдегиде есть ароматическое ядро, то может идти реакция замещения водорода, в 3,5 – положении бензольного кольца, так как карбонильная группа стягивает на себя электронную плотность. 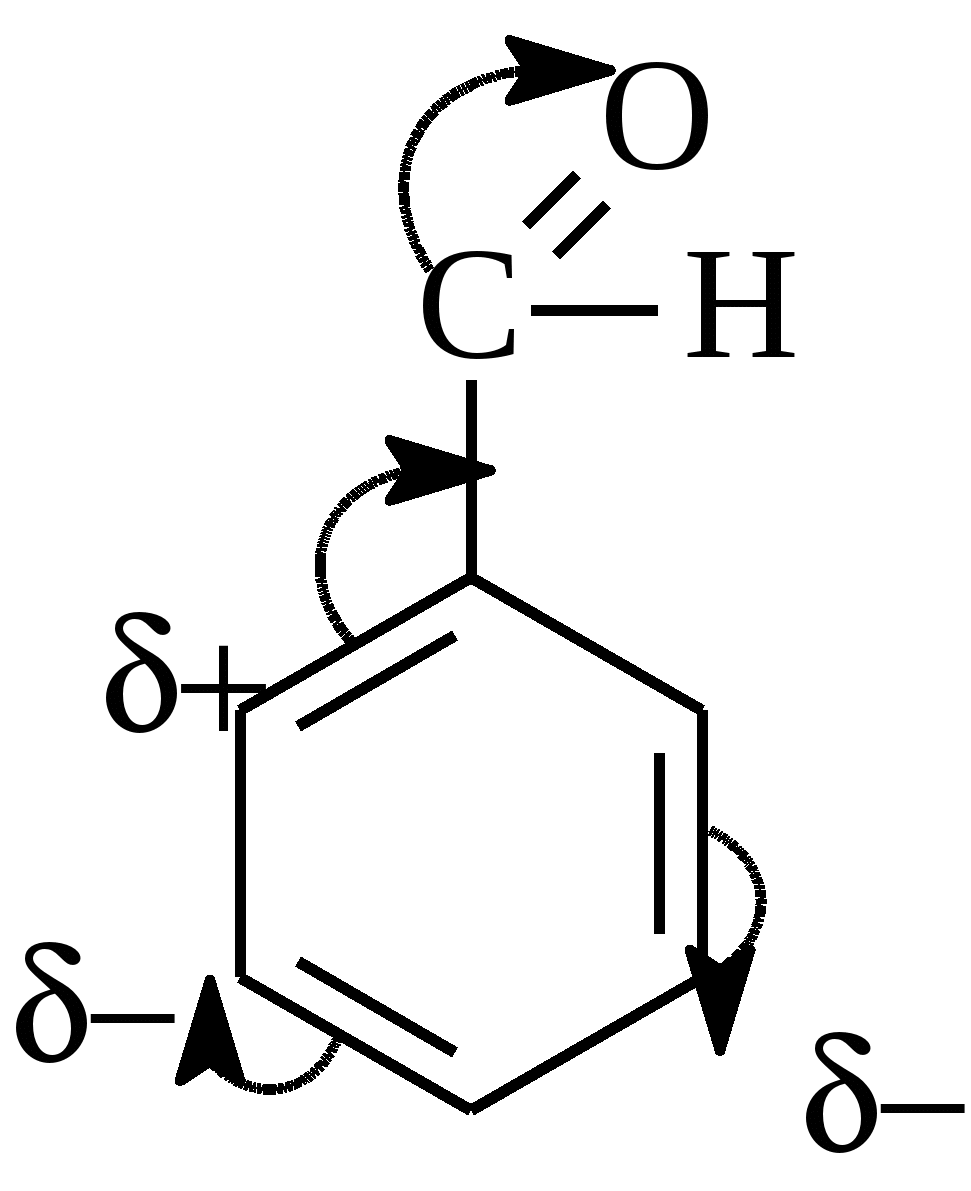 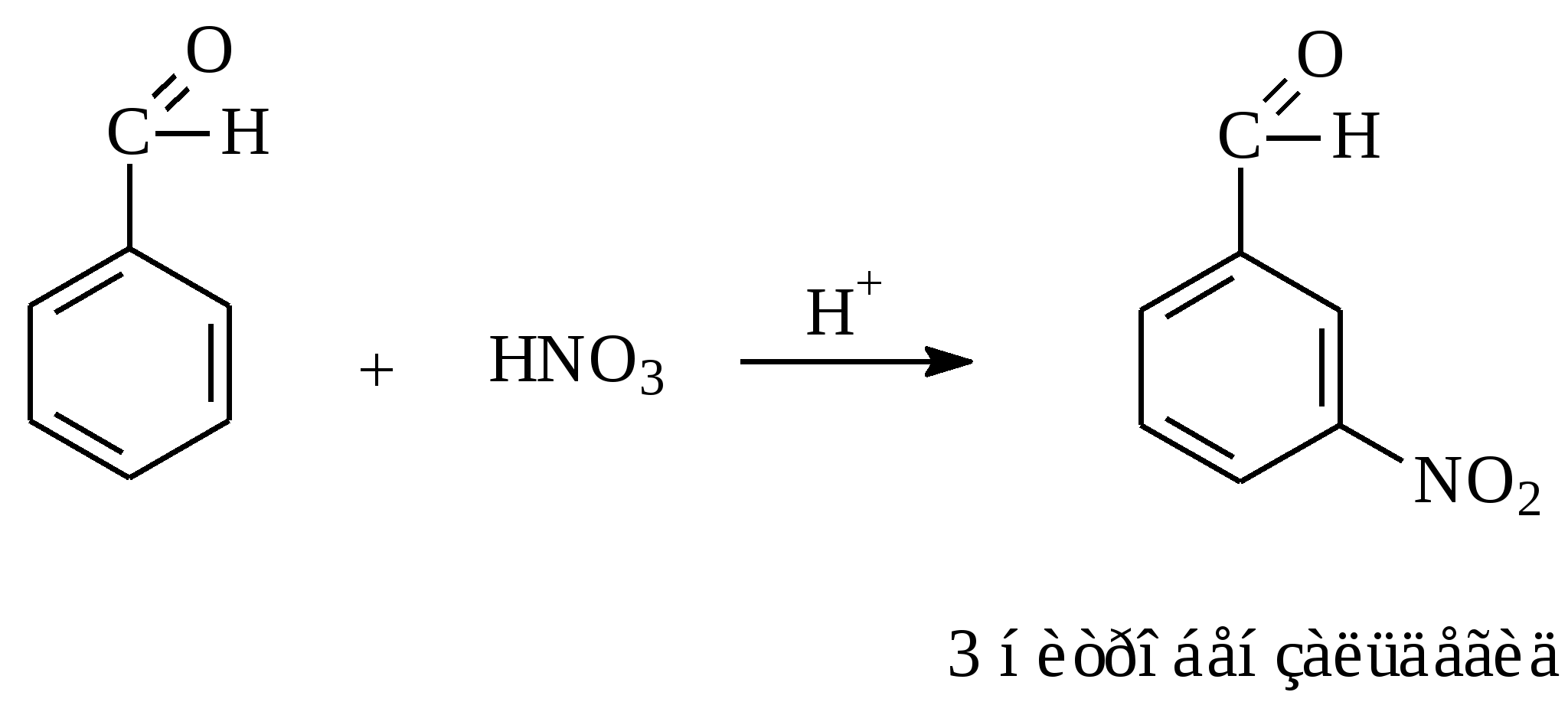 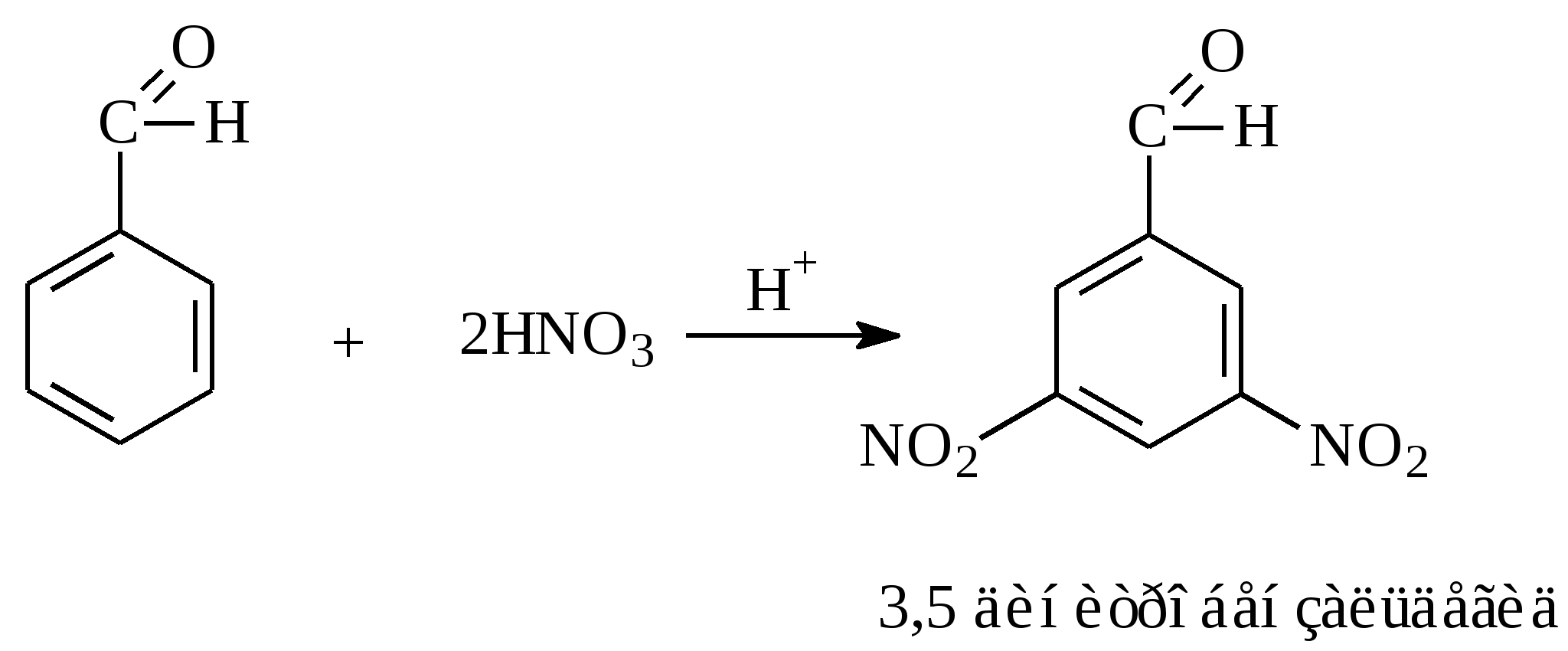 10.3. Примеры решения задач Пример 29. При взаимодействии 13,8г этанола с 34г оксида меди(II) был получен альдегид, масса которого составила 9,24г. Рассчитать выход альдегида Решение: 1) Напишем соответствующее уравнение реакции 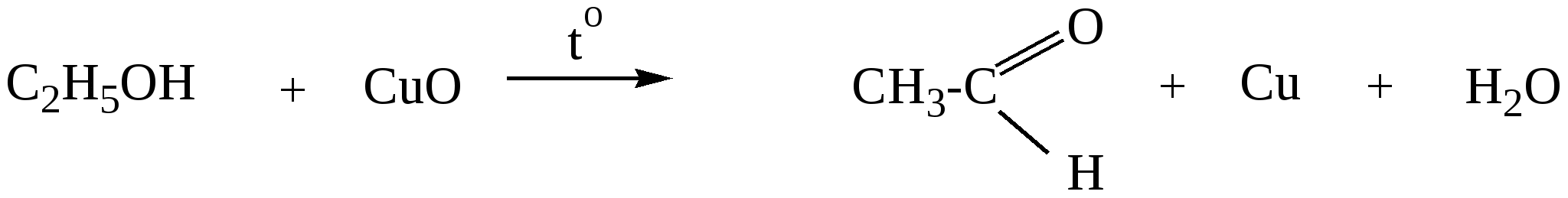 2) Находим количества веществ этанола и оксида меди: n(C2H5OH) = m(C2H5OH) / M(C2H5OH)=13,8 / 46 = 0,3( моль ) n(CuO) = m(CuO) / M(CuO) = 34 / 80 = 0,425(моль) 3) Согласно уравнению реакции спирт взаимодействует с оксидом меди в молярном соотношении 1:1. Но так как на 0,3 моль спирта приходится 0,425 моль оксида меди, то этанол находится в недостатке, и при 100% выходе из 0,3 моль этанола может образоваться 0,3 моль этаналя. 4) Масса этаналя который может образоваться теоретически: m(CH3CHO) = n(CH3CHO) ∙ M(CH3CHO) = 0,3 ∙ 44 = 13,2(г ) 5) Тогда выход альдегида равен: ŋ = m(практ.)/ m(теор.) = 9,24 /13,2= 70% Ответ: 70% Пример30. При действии на смесь карбида кальция и карбоната кальция избытком соляной кислоты образовалась смесь газов с плотностью по озону D(O3) = 0,8042. Какое количество метаналя можно получить из 108,375 г этой смеси? Решение: 1) Напишем соответствующие уравнения реакций CaC2 + 2HCl CaCO3 + 2HCl 2) Рассчитываем среднюю молярную массу газовой смеси M ср(газ.см.) = D(O3)∙M(O3) = 0,8042∙48 = 38,6(г/моль) 3) Находим количество вещества газовой смеси: n(газ см.) = m(газ см.) / Мср(газ см.) = 108,375 / 38,6 = 2,81 (моль) 4) Пусть в газовой смеси количество вещества ацетилена – х , тогда количество вещества углекислого газа будет равно (2,81 – x). 5) Тогда масса газовой смеси равна: 108,375 = 26x + 44∙( 2,81 – x ) Откуда х = 0,85 ( моль) 6) Исходя из уравнения реакции гидратации ацетилена С2Н2+ Н2О из 0,85моль ацетилена можно получить 0,85моль ацетальдегида. Масса альдегида равна 0,85 ∙ 44 = 37,4 (г) Ответ: m(ацетальдегида) = 37,4г Пример31. Рассчитать массу ацетата аммония, которая образуется при обработке 110 г 20% водного раствора ацетальдегида избытком аммиачного раствора оксида серебра. Решение: 1) Напишем уравнение реакции CH3CHO + Ag2O(NH3) 2) Масса ацетальдегида в растворе равна: m(CH3CHO) = ω ∙ m(р-ра) = 0,2 ∙110= 22(г) 3) Находим количество вещества ацетальдегида: n(CH3CHO) = m(CH3CHO) / M(CH3CHO) = 22 / 44 = 0,5 ( моль) 4) Согласно уравнению из 0,5 моль ацетальдегида образуется 0,5 моль ацетата аммония. Тогда масса ацетата аммония равна: m(ацетата аммония) = n ∙ M = 0,5 ∙ 77 = 38,5 (г) Ответ: m(ацетата аммония) = 38,5г |
