Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
1.2.Задачи и упражнения для самостоятельного решения1. Вычислите массу следующих количеств вещества:а) 1 моль атомов азота;б) 3 моль атомов кислорода;в) 0,2 кмоль атомов меди ;г) 0,3 кмоль воды ; д)0,1 моль аммиака;ж) 0,01 кмоль этана. 2. Сколько моль атомов содержится в :а) 4 г кислорода; б)10 г водорода; в)1,2 кг углерода ;г) 18 г воды;д) 4 г гидроксида натрия; ж)16 мг метана; з)4,4 г пропана;и) 8,8 кг углекислого газа? 3. В какой массе серной кислоты содержится столько же вещества, сколько содержится :а) в 4 мг гидроксида натрия;б) в 4.4 кг углекислого газа;в) в 2,12 г карбоната натрия;г) в 12 г этана? 4. Какой объем при н.у. займут:а) 0,5 моль водорода; б) 0,5 моль гелия; в)0,5моль воды;г) 0,5кмоль атомов хлора;д) 100 ммоль атомов кислорода? 5. Рассчитайте объем, который при н.у. займет газовая смесь, состоящая из 2,73 моль азота, 3,82 моль водорода, 0,45 моль оксида углерода (II) и 3,00 моль оксида углерода (IV). 6. Рассчитайте массу (при н.у.): а)1,12 л азота;б) 7,84 мл пропана; в) 0,336 м3 кислорода. 7. Рассчитайте массу газовой смеси, состоящей из 8,96л (н.у.) оксида углерода (II) и 4,48л (н.у.) оксида углерода (IV). 8. Рассчитайте массу 22,4 л (н.у.) смеси газов, содержащей ( в %% по объему): 40% азота, 10% оксида углерода (II) и 50% этена. 9. Определите объем, который при н.у. занимают:а) 1кг водорода; б) 11 г углекислого газа;в) 16 т метана. 10. Определите объем, который при н.у. занимает:а) 12,04 ∙ 1024 молекул водорода;б) 3,01∙1023 молекул метана. 11. Сравните число молекул:а) в 1г водорода и 1г кислорода; б)в 1л водорода и 1л кислорода;в) в 1моль водорода и 1моль кислорода. 12. Вычислите молярную массу газа , а)если масса 1л газа (н.у.) равна 1,25г;б)если масса 300 мл газа (н.у.) равна 0,857 г. Предложите возможные формулы газов. 13. Определите массу этана, в которой содержится 12,04∙1023 молекул. 14. В каком соотношении по объему следует смешать метан и этан, чтобы масса 1л газовой смеси была равна 1,0 г? 15. Сколько электронов содержится в 0,2 моль метана? 16. В каком объеме метана (н.у.) содержится столько электронов, сколько содержится в 5,6 г железа? 17. Определите относительную плотность по водороду и по воздуху: а)азота; б)хлора;в) метана. 18. Вычислите плотность при н.у.: а)этана;б) бутана. 19. Вычислите плотность и относительную плотность по воздуху газовой смеси, состоящей (в %% по объему) из водорода(20%), метана (50%), пропана (30%). 20. Вычислите среднюю молярную массу и относительную плотность по водороду газовой смеси, состоящей (в %% по объему) из углекислого газа (20%), метана (40%) и водорода (40%). 21. Определите состав газовой смеси (в %% по объему), содержащей метан и этан, если ее относительная плотность по водороду равна 9,4. 22. Определите состав газовой смеси, состоящей из метана и этана, если массовая доля водорода как элемента в ней равна 22%. 23. Определите относительную плотность по воздуху газовой смеси, состоящей из (в %% по массе): 20% водорода, 10% углекислого газа, 40% азота, 20% метана и 10% этана . Какой объем воздуха необходим для сжигания 1л такой смеси? 24. Газовая смесь, состоящая из воздуха и метана, имеет плотность по кислороду 0,82. Определите состав этой смеси в массовых долях, считая что в воздухе содержится 20% кислорода(по объёму). 25. В каком соотношении по объёму следует смешать углекислый газ и пропан, чтобы плотность газовой смеси была равна 1,964 г/л ? 26. В каком соотношении по массе следует смешать азот и этен, чтобы плотность по гелию газовой смеси была равна 7? 27. Рассчитайте массовую долю пропана в смеси с этаном, если её плотность по водороду равна 20. Какой объем воздуха необходим для сжигания 10 л такой смеси, считая, что в воздухе содержится 20% кислорода по объему? 28. Как изменится давление газовой смеси, находящейся с замкнутом сосуде и состоящей из равных объёмов кислорода и СО, если: а) весь оксид углерода (II) превратится в углекислый газ; б) половина оксида углерода (II) превратится в углекислый газ? 29. После сжигания 120 мл(н.у.) смеси водорода с кислородом объём газовой смеси, измеренной при нормальных условиях, уменьшился в два раза. Определите содержание водорода в исходной газовой смеси(в %%) по объёму, если водород сгорел полностью. 30. Рассчитайте массу воды, которая может образоваться при сжигании смесей, состоящих из: а) 10г Н2 и 10г О2; б) 10л(н.у.) Н2 и 10л(н.у.) О2; в) 10г Н2 и 10л(н.у.)О2; г) 10л(н.у) Н2 и 10г О2. 31. Какой объём воздуха (при нормальных условиях)) необходим для полного сжигания 100г газовой смеси, состоящей (в %% по объёму): 20% СО2 ,10% СО, 30% N2 и 40%H2? Содержание кислорода в воздухе принять равным 21% по объему. 32. Определите молекулярную формулу вещества содержащего углерод (ω = 84,21%) и водород (ω =15,79%). Плотность паров этого вещества по воздуху равна 3,93. 33. Определите формулу вещества, состоящего из углерода, водорода и кислорода, если при сжигании 2,9 г его получено 6,6 г углекислого газа и 2,7г воды. Плотность паров этого вещества при (н.у.) равна 2,59г/л. Глава 2. АЛКАНЫ Общая формула гомологического ряда алканов CnH2n+2 .Метан, этан, пропан и бутан в обычных условиях (25 0С и 101 кПа) - газы. Углеводороды с содержанием атомов углерода от 5 до15- жидкости, остальные алканы - твердые вещества. Газообразные алканы не имеют запаха и цвета. Алканы хорошо растворяются в неполярных органических растворителях и не растворяются в воде. 2.1.Получение алканов 1. Основной источник углеводородов - природные газы и нефть. В промышленности углеводороды получают перегонкой нефтепродуктов. 2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании: СН2=СН2 + Н2 3. По реакции Вюрца, действуя натрием на галогеналканы при нагревании CH3−CH2Cl + ClCH2−CH3 + 2 Na бутан 2 CH3− CH−CH3 + 2 Na | | Br CH3−CH−CH3 2,3-диметилбутан Cl CH3 | | CH3−Cl + CH3− CH−CH3 + 2 Na изобутан 4. Гидролиз карбидов Al4C3 + 12 H2 O Be2C + 4 H2 O 5. Декарбоксилирование солей низших карбоновых кислот (для газообразных углеводородов) t0 CH3COONa + NaOH тв тв t0 CH3 CH 2COOK + KOH тв тв 2.2 Химические свойства алканов 1. Галогенирование – реакция радикального замещения (SR)атомов водорода на галогены. а) Инициирование– образование свободных радикалов Молекулы хлора поглощают свет и диссоциируют на атомы: б) Рост цепи Атом хлора может отнимать атом водорода у молекулы алкана с образованием хлороводорода и алкильного радикала: Алкильный радикал атакует молекулу хлора,образуя молекулу алкилгалогенида и атом хлоа, который способен начать следующую стадию этой цепной реакции 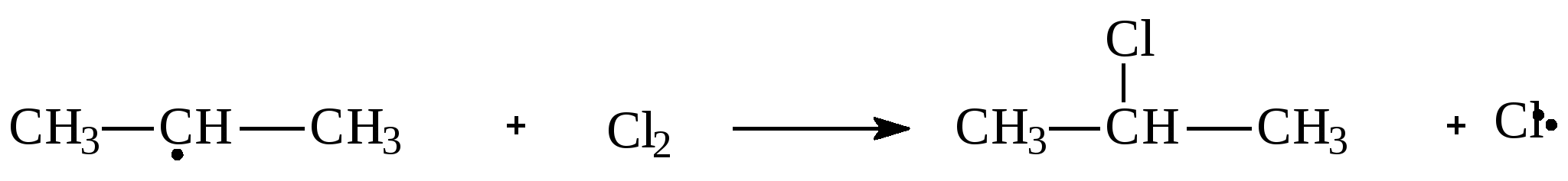 в) Обрыв цепи Обрыв цепи происходит при взаимодействии каких-либо двух имеющихся в смеси радикалов: 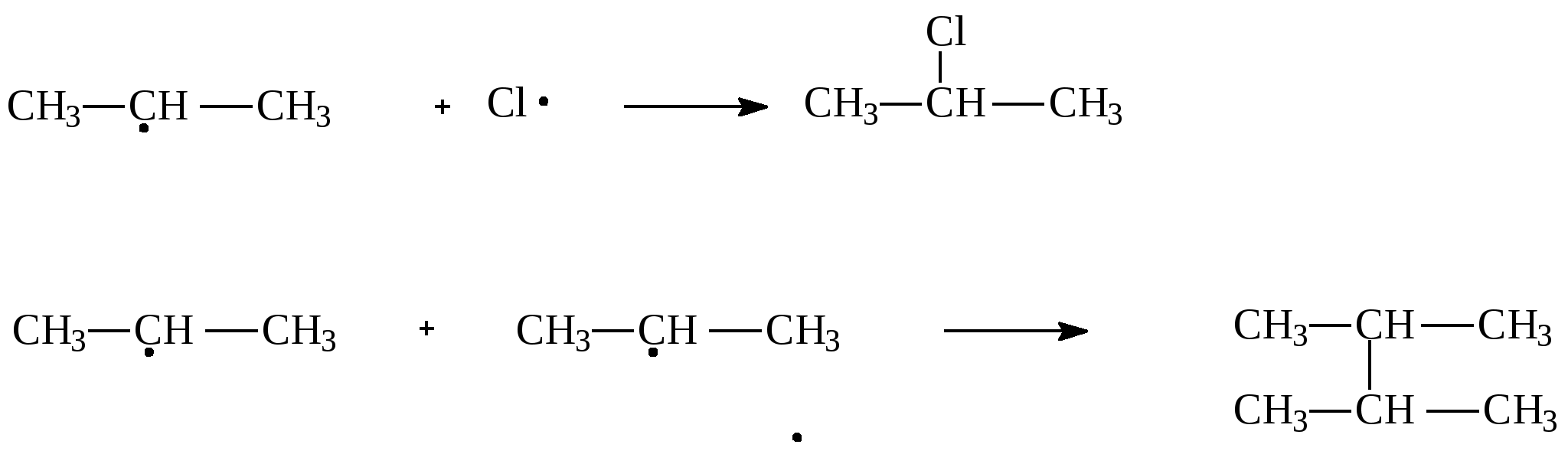 Вообще получить по этому методу монозамещённые продукты практически невозможно, так как образующиеся алкилгалогениды взаимодействуют дальше с атомами хлора. На ярком свету реакция протекает очень бурно(со взрывом). Устойчивость свободных радикалов уменьшается в следующем ряду: 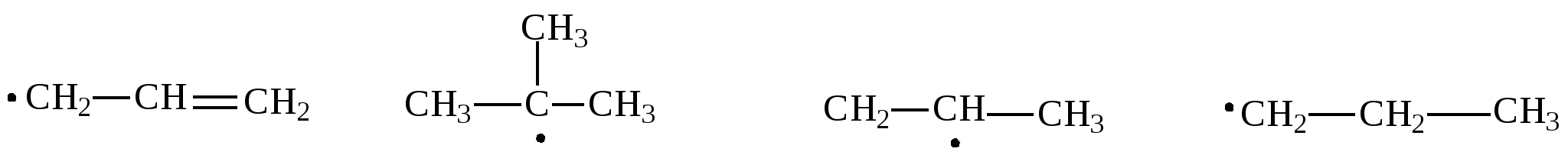 аллил третбутил изопропил пропил аллил третбутил изопропил пропил Поэтому основным продуктом радикального замещения в реакциях галогенирования алканов являются соединения, в которых атом галогена связан с аллильным или третичным атомом углерода. Гораздо меньше продуктов замещения по вторичному и первичному атомам углерода. Бромирование протекает менее энергично, взаимодействие с иодом осуществить практически не удаётся, наоборот, фтор взаимодействует с алканами со взрывом. При бромировании преобладают соединения, в которых атом брома связан с третичным атомом углерода. При хлорировании образуется сложная смесь, в которых атом хлора связан с третичным, вторичным и первичным атомами углерода. һ ν СН3− СН2− СН− СН3 + Br2 | | CH3 CH3 2-метилбутан 2-бром-2-метилбутан (основной продукт) CH3 – CH – CH – CH3 | | Br CH3 2- бром- 3- метилбутан (побочный продукт) В молекуле алкана могут замещаться один или несколько атомов водорода СН3 − СН2− СН3 + Cl2 | Cl Cl | СН3 − СН2 − СН3 + 2 Cl2 | Cl Cl | СН3 − СН2 − СН3 + 3 Cl2 | | Cl Cl При этом образуется смесь галогенпроизводных. 2. Нитрование (реакция Коновалова)- реакция радикального замещения SR. CH4 + HNO3 3. Реакции дегидрирования t, Ni C2H6 t,Cr2O3/Fe2O3 2C4H10 В последнем случае образуются изомеры, отличающиеся положением двойной связи. 4. Крекинг – разрушение углеводородного скелета и образование углеводородов с меньшим числом углеродных атомов.− t C8H18 t C8H18 Крекинг метана в зависимости от условий протекает по-разному: 1000о 15000 CH4 500о СН4 4. Реакции окисления – не свойственны алканам и весьма специфичны. Окисление бутана протекает в присутствии катализатора при нагревании: 2 C4H10 + 5 O2 Окисление метана в зависимости от условий может приводить к образованию различных продуктов: CH4 + 0,5O2 O // CH4 + O2 O // CH4 + 2,5O2 5. Реакции горения C5H12 + 8 O2 В общем виде: CnH2n+2 + (3n +1)/2 O2 7. Изомеризация. t,AlCl3 CH3− CH2−CH2 − CH3 бутан | CH3 2.3. Примеры решения задач Пример 11. Карбид алюминия массой 4,32 г обработали избытком соляной кислоты. Образовавшийся газ подвергли хлорированию. В результате получили смесь ди- и монохлоралканов. Масса хлора, пошедшего на реакцию, составила 11,36 г. Определить массовые доли продуктов хлорирования. Решение: Взаимодействие карбида алюминия с водным раствором кислот является лабораторным способом получения метана. 1) Определяем количество вещества карбида алюминия: М (Al4C3) = 144 г/моль, n( Al4C3) = 4,32/144 = 0,03 (моль); 2) Напишем уравнение реакции: Al4C3 + 12 HCl = 4 AlCl3 + 3 CH4 ↑ 3) Вычисляем количество вещества метана: в соответствии с уравнением реакции n( CH4) = 3 ∙ n( Al4C3) = 3 ∙ 0,03 = 0,09 моль 4) Вычисляем количество вещества хлора n( Cl2) = m( Cl2)/M( Cl2) = 11,36 / 71= 0,16 (моль) Пусть образуется x(моль) хлорметана и y(моль) дихлорметана 5) Запишем реакции хлорирования метана: а) CH4 + Cl2 x x x б) CH4 + 2Cl2 y 2y y Тогда в соответствии с уравнениями (а) и (б) на образование x(моль) CH3Cl требуется x(моль) Cl2,а на образование y(моль) CH2Cl2 – 2y моль Cl2. Составляем систему уравнений и решаем её: х + у = 0,09 х = 0,02 х + 2у = 0,16 у = 0,07 6) Вычисляем массу продуктов хлорирования: m ( CH3Cl ) = n (CH3Cl ) ∙ M (CH3Cl ) = 0,07 ∙ 50,5 =3,535 (г) m ( CH2Cl2 ) = n (CH2Cl2 ) ∙ M (CH2Cl2 ) = 0,02 ∙ 85 = 1,70 (г) 7) Массовую долю ди- и монохлорметана определяем по формуле: ω(в-ва) = m(в-ва)/ m(смеси) ; m (см) =3,535 + 1,70 = 5,235 (г). ω ( CH3Cl ) = 3,535 ׃ 5,235 = 0,6753 (67,53 % ) ω ( CH2Cl2) = 1,70 ׃ 5,235 = 0,3247 ( 32,47 %) Ответ: ω ( CH3Cl ) = 67,53 %, ω ( CH2Cl2) = 32,47 % 2.4. Задачи и упражнения для самостоятельного решения34. Из перечисленных соединений выберите пару изомеров и напишите их структурные формулы: 2,7-диметилнонан, 2-метил-4- этилнонан, 4-метил-4-этилдекан, 2-метил-4-пропилдекан,4-пропил-4-этилоктан. 35. Из бутана получите: а) 2,2,3,3 – тетраметилбутан; б) 2,2 – диметилбутан. 36. Из пентана получите: а) 3,3,4,4 – тетраметилгексан; б) 2- метил -2–этилбутан 37. В молекуле алкана имеются только первичные и третичные атомы углерода. Первичных атомов в два раза больше, чем третичных. Напишите формулу такого алкана. 38. Приведите формулу алкана, в молекуле которого имеются шесть первичных атомов углерода, но нет вторичных и третичных атомов углерода. 39. В молекуле одного из алканов находится 34 е. Составьте структурные формулы всех его изомеров. 40. Какие вещества нужно взять для получения по реакции Вюрца: а) тетраметилбутана, б) 3,4-диметилгексана, в) 3,4 – диэтилгексана, г) 2,5- диметилгексана? Напишите уравнения реакций 41. Составьте уравнения реакций в соответствии со схемой: а) СН4 AlCl3,t Br2, hν KOH, спирт б) бутан в) карбид алюминия 42. Назовите вещества А, Б, В в следующих цепочках превращений: NaOH, t 15000C H2, Ni, t а) СН3СООNa CI2, hν Na, t Br2, t б) С2Н 6 NaOH, t Cl2, hν Na, t в) СН3СООNa H2O, t Cl2, hν Na, t г) AI4C3 Na, t Al2O3,4500C Br2, t д) С2Н 5Cl CI2, hν Na, t HNO3(p), t е) СН4 NaOH, t Br2, hν Na, t ж) СН3CH2CH2СООNa 43. Оксид углерода (IV) смешали с одним из алканов. В этой газовой смеси объемная доля углекислого газа составила 50%, а массовая доля -73,3%. Какой алкан находился в смеси? 44. Смесь состоит из пропана и азота. Массовая доля азота составляет 40 %. Определите среднюю молярную массу смеси и количество моль атомов водорода в 20 литрах (н.у.) этой смеси. 45. Образец смеси, состоящей из метана и бутана, объемом 10 л (н.у.) содержит 63,8∙1023 электронов. Определить среднюю молярную массу и состав смеси (в % по объему). 46. Смесь состоит из метана и пропана. Массовая доля водорода составляет 20 %. Определить среднюю молярную массу смеси и количество моль атомов углерода в 20 литрах (н.у.) этой смеси. . 47. При добавлении какого газа к смеси равных объёмов этана и бутана плотность её по азоту не изменится? 48. Определите плотность по водороду газовой смеси, если известно, что пропана в ней в 2 раза больше, чем бутана; этана в 2 раза больше, чем пропана, а метана в 2 раза больше, чем этана. 49. Определите массовую долю метана в смеси с пропаном, если плотность по водороду данной смеси равна 12,8. 50. Карбид алюминия обработали разбавленным раствором соляной кислоты. Выделился газ объёмом 3,36 л (н.у.) . Реакция прошла с выходом 100%. Какая масса карбида алюминия была взята для проведения реакции? 51. 65,6 г ацетата натрия смешали с 40 г гидроксида натрия и прокалили. Рассчитайте объём выделившегося газа (н.у.), если реакция прошла с выходом 100%. 52. Рассчитайте массу хлороформа, которую можно получить из 124 кг етана при 90% выходе. 53. В результате бромирования пропана было получено 246 г бромпропана при 100% выходе. Сколько пропана прореагировало при этом? 54. При хлорировании 31,36 л ( н.у.) метана было получено 196,9 г смеси трихлорметана и тетрахлорметана. Определите массовые доли продуктов хлорирования метана. 55. При хлорировании 101г хлорметана образовалась смесь дихлорметана и трихлорметана в молярном соотношении 1:2. Вычислите объём хлороводорода (н.у.), выделившегося в ходе реакции. 56. Рассчитайте массу тетрахлорида углерода, который можно получить при хлорировании метана объёмом 13,44 л (н.у.) хлором, объём которого равен 78,4л (н.у). Выход продукта составляет 70% от теоретически возможного. 57. Определите объём кислорода, необходимый для сжигания 23 г газовой смеси, состоящей из метана и этана, если плотность газовой смеси по одному из её компонентов равна 0,767. 58. Смесь этана и бутана, средняя молярная масса которой равна 40 г/моль, сожгли. Определить объем полученного углекислого газа, если для сжигания этой смеси потребовалось 28 л кислорода. 59. Для сжигания 10 л ( н.у.) смеси пропана и этана потребовалось 47 л ( н.у.) кислорода. Определите состав смеси алканов ( в %% по объёму). 60. Определите объём кислорода ( при н.у.), который потребуется для сжигания 18 г газовой смеси, состоящей из метана и водорода, с плотностью по водороду 4. 61. Определите объём кислорода ( при н.у.), который потребуется для сжигания газовой смеси, состоящей из водорода и этана с плотностью по гелию равной 1,2: а) 100 л газовой смеси; б)100 г газовой смеси. 62. Определите массовую долю углерода в смеси, состоящей из метана и пропана, если плотность по гелию данной смеси равна 9,2. 63. Определите молекулярную формулу вещества, содержащего (в %% по массе) 12,78% углерода, 2,13% водорода и 85,09% брома. Плотность паров этого вещества по воздуху рана 6,48. 64. 2-метилбутан пропустили над нагретым платиновым катализатором. При этом плотность газовой смеси уменьшилась на 12%. Определите состав полученной газовой смеси (в % по объему) и выход в реакции дегидрирования. 65. Для сгорания некоторого алкана требуется объём кислорода в 11 раз больший, чем объём паров данного углеводорода при тех же условиях. Определите формулу алкана. 66. При сгорании алкана массой 5,8 г образуется углекислый газ объёмом 8,96 л (н.у.). Какой объём кислорода (н.у.) потребуется для реакции? 67. Продуктами горения углеводорода массой 17,6г являются оксид углерода (IV) и вода массой 28,8 г. Какой объём кислорода был затрачен в процессе горения? 68. Смешали 2,24 л (н.у.) метана и 25 л (н.у.) воздуха. Смесь подожгли. Вычислите объёмные доли веществ после конденсации паров воды. 69. Смешали 3 г этана и 100 л (н.у.) воздуха. Смесь подожгли. Вычислите бъёмные доли веществ после конденсации паров воды. 70. Сколько металлического натрия необходимо для получения по методу Вюрца 0,25 моль этана? 71. При нагревании бромметана массой 3,85г с металлическим натрием массой 1,15г получили этан, объём которого равен 358,4 мл (н.у.). Определите выход продукта реакции. 72. Из реакционной смеси, полученной при взаимодействии алкана с бромом, с помощью дистилляции была выделена жидкость, атомное соотношение элементов в которой составляет С : Н : Br = 6 : 13 : 2. Назовите алкан, полностью охарактеризуйте жидкость и сделайте предположение о других возможных продуктах реакции. Ответ поясните. Глава 3. АЛКЕНЫ Алкены – углеводороды, в молекуле которых имеется одна связь C=C. Первые три члена ряда С2 – С4 - газообразные вещества, от С5- С17 – жидкости, С18 – и выше – твердые вещества. Электронные орбитали атомов углерода, образующих двойную связь, находятся в состоянии sp2-гибридизации. Атомы углерода соединены одной σ- и одной π – связями: sp3 sp3 sp 2 sp2 CH3− CH2 − CH = CH2 (бутен-1) Для алкенов возможна структурная и пространственная изомерия(геометрическая). Структурные изомеры: СH3−CH2− CH2−CH=CH2 СH3−CH2 − CH=CH−CH3 пентен-1 пентен-2 СH3− CH − CH=CH2 СH3− CH −C=CH2 | | CH3 CH3 3-метилбутен-1 2-метилбутен-1 СH3 − C=CH − CH3 | CH3 2-метилбутен-2 Пространственные изомеры: H H H C2H5 \ / \ / С = С С = С / \ / \ CH3 C 2H5 СН3 Н цис-пентен-2 транс-пентен-2 Алкены с концевой двойной связью и алкены, имеющие одинаковые заместители у sp2 – гибридизированного атома углерода, пространственных изомеров не имеют. 3.1. Получение алкенов 1. Крекинг и пиролиз нефтепродуктов 2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании С4Н10 3. Из галогенпроизводных, действуя спиртовым раствором щелочи: спирт CH3 − CН − CH − CH3 + КОН | | | СН3 Br СН3 4. Из спиртов в присутствии кислоты при нагревании: Н+ CH3 − CH 2 − CH2 − ОН Н+ СH3 − CН(ОН) − CH2−CH3 Отщепление воды и галогеноводородов происходит по правилу Зайцева: атом водорода отщепляется от наименее гидрогенизированного атома углерода, т.е. атома, который связан с меньшим числом атомов водорода. 5. Из дигалогенпроизводных под действием активных двухвалентных металлов(Zn, Mg) при нагревании. CH3−CН−CH −СН2−СН3 + Zn | | Br Br 3.2. Химические свойства алкенов 1. Для алкенов характерны реакции электрофильного присоединения(ионного) АЕ , которые протекают с разрывом π- связи. а) Гидрирование каталитическое (Ni, Pt, Pd) при нагревании : CH3−CН = CH2 + Н2 б) Галогенирование ( Hal2- Cl2, Br2, I2): Br Br CCl4 или Н2О | | CH3−C=CH2 + Br2 | | CH3 CH3 в) Гидрогалогенирование - присоединение HHal( HCl, HBr, HI) CH3−C=CH−CH3 + HBr | | CH3 CH3 г) Гидратация -присоединение воды в кислой среде при нагревании: OH | CH3−C=CH−CH3 + H2O | | CH3 CH3 Присоединение галогеноводородов и воды в основном протекает по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному атому углерода, т.е. к атому, который связан с большим числом атомов водорода. Но есть исключения из этого правила. CH2−CH=CH2 + HCl | | NO2 NO2 CH2=CH−COOH + HBr | Br 2. Реакции полимеризации: t n CH3−CH=CH2 AlCl3 | СН3 3. Реакции окисления а) реакции мягкого окисления водным раствором перманганата калия -1 -2 +7 0 -1 3 CH3−CH=CH2 + 2 KMnO4 + 4 H2O +2MnO2 | | OH OH -1 0 C - 1 е → C -2 -1 процесс окисления C - 1 е → C +7 +4 Mn + 3 е → Mn процесс восстановления Эта реакция обесцвечивания раствора перманганата калия является качественной реакцией на алкены, как и реакция обесцвечивания бромной воды. б) действие жестких окислителей ( азотной кислоты, перманганата калия и дихромата калия в кислой среде) приводит к разрыву молекулы алкена по месту расположения двойной связи с образованием кислот и кетонов: CH3CH=CH + 2KMnO4 + 3H2SO4 CH3−C(CH3) = CH –CH3 + K2Cr2O7 + 4H2SO4 CH3−C(O)СН3 + CH3COOH + Cr2(SO4)3 + 4H2O + K2SO4 ацетон в каталитическое окисление кислородом: 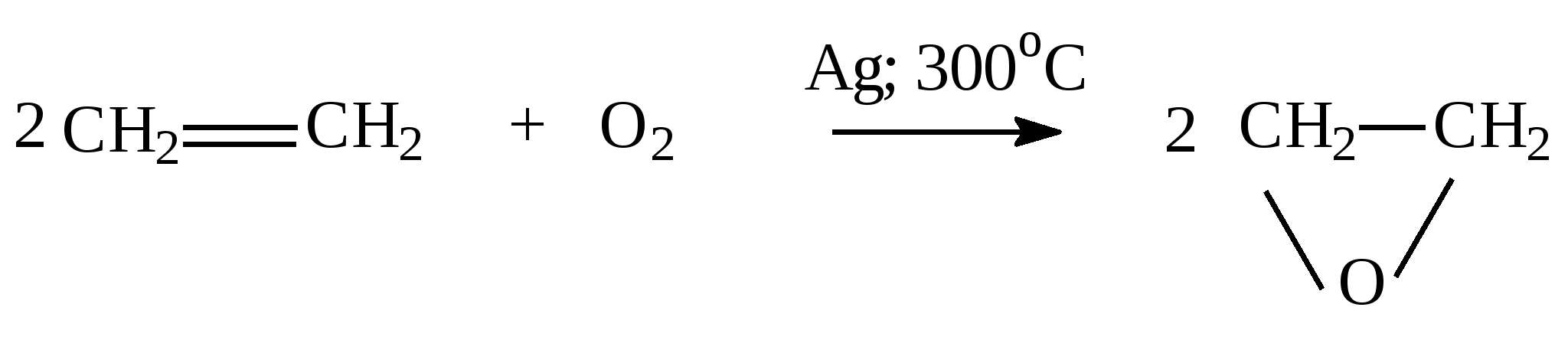 г) реакции горения CnH2n + 3n/2 O2 3.3. Примеры решения задач Пример 12. Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 3,6, пропустили над нагретым никелевым катализатором. При этом образовалась газовая смесь с плотностью по водороду 4,23. Определить выход в реакции гидрирования и состав полученной газовой смеси (в % по объему). Решение: Поскольку в условии задачи заданы только относительные значения ( т.е. величины, не зависящие от количества вещества – относительная плотность) и необходимо определить также относительные величины ( состав, выход в реакции), для упрощения расчетов зададимся каким-либо абсолютным значением. 1) Пусть количество моль исходной смеси n(см1) =1 моль, Исходная газовая смесь(смесь 1): С2H4 и H2 2) Вычислим среднюю молярную массу этой смеси Мср. (см1)= D(см1)∙М(Н2) = 3,6 ∙ 2 = 7,2 г/моль, 3) Тогда масса смеси (1): m(см1) = М (см1) ∙ n(см1) = 7,2 ∙ 1 = 7,2 г. 4) Пусть n(С2H4)= х моль; n(H2)= у моль. Составим систему уравнений и решаем её: х + у = 1 x = 0,2 28 х + 2у = 7,2 y = 0,8 Таким образом, исходная смесь состоит из 0,8 моль С2H4 и 0,2 моль H2. 5) После реакции гидрирования: С2H4 + H2 = С2H6 получим смесь (2): С2H4, H2 и С2H6. Вычислим среднюю молярную массу этой смеси Мср. (см2)= D(см2)∙М(Н2) = 4,23 ∙ 2 = 8,46 г/моль. 6) Поскольку, согласно закону сохранения массы, общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции; масса газовой смеси в результате гидрирования не меняется, m(см1) = m (см2) = 7,2 г. 7) Вычислим количество вещества конечной газовой смеси (смеси 2): n(см2)= m (см2)/ M(см2) = 7,2 ׃ 8,46 = 0,851моль. 8) Пусть, в реакцию вступает z(моль) H2, тогда в реакцию ступает также z моль С2H4 и в результате реакции образуется z моль С2H6. Было 0,8 0,2 С2H4 + H2 = С2H6 Прореагировало z z стало z Запишем эти данные для удобства в виде таблицы
9) Определим количества всех веществ в конечной газовой смеси(2): n(см2)= n(С2Н4)+ n(Н2)+n(С2Н6)= (0,8-z)+(0.2-z)+z=1-z= 0,851 Отсюда z= 1-0,851=0,149 В смеси (2): n(С2Н4)= 0,8-0,149=0,651 моль n(Н2)= 0,2-0,149=0,051 моль n(С2Н6)=0,149моль 10) Выход в реакции гидрирования вычисляем как отношение количества вещества С2Н6, полученное практически, к количеству вещества, рассчитанному по уравнению химической реакции (т.е. теоретически). Количество вещества С2Н6, полученное по реакции теоретически, рассчитываем по недостатку. В смеси (1) водород находится в недостатке. Следовательно n(С2Н6)теор= 0,2 моль η (С2Н6)=0,149/0,2= 0,745 (74,5%) 11) Определяем состав полученной газовой смеси (в % по объему) φ( в-ва)=V(в-ва)/V(см2)∙100%= n(в-ва)/n(см2)∙100% φ(С2Н6)=0,149:0,851∙100%= 17,51% φ(С2Н4)=0,651:0,851∙100%= 76,50% φ(Н2)=0,051:0,851∙100%= 5,99% Ответ: φ(С2Н6)=17,51%; φ(С2Н4)= 76,50%; φ(Н2)= 5,99% η (С2Н6)=74,5% Пример13. В молекуле нециклического углеводорода sp3 – гибридизованных атомов углерода равно трем, , а sp2- гибридизованных – двум. Установите строение этого углеводорода, если в его составе содержится только один третичный атом углерода. Какая масса бромоводорода может вступить в реакцию с 14 г этого углеводорода. Определить массовую долю брома как элемента в полученном бромпроизводном . Решение:1) Условию задачи отвечает следующее строение:sp3 sp3 sp2 sp2 CH3-CH –CH= CH2 - 3-метилбутен-2 C5H10 | CH3 sp3 2) Запишем реакцию взаимодействия алкена с бромоводородом CH3−CH−CH= CH2 + HBr | | | CH3 CH3 Br 2-бром-3-метил-бутан Реакция протекает по правилу Марковникова. М(C5H10) = 70 г/моль, n(C5H10) = 14 / 70 = 0,5 моль. В соответствии с уравнением реакции n(HBr) = n (C5H10) =0,5 моль, m ( HBr) = n ( HBr) ∙ М ( HBr) = 0,5 ∙ 81 = 40,5 (г) 3) Определяем массовую долю брома в полученном бромпроизводном C5H11Br ω (Br) = Ar( Br)∙n(Br)/ Mr(C5H11Br), где Ar (Br) –относительная атомная масса Br, n (Br)- число атомов брома в молекуле, Mr (C5H11Br)- относительная молекулярная масса бромпроизводного ω (Br) =80∙1/149= 0,5369 (53,69%) Ответ: 3-метилбутен-2; ω (Br) =53,69% Пример14. Определить массу 1,2 дихлорпропана, необходимую для получения 3,36 г пропена, учитывая, что реакция взаимодействия 1,2- дихлорпропана с избытком цинка проходит с выходом 72,7%. Решение: 1) Реакция получения пропена : t CH3−CH −CH2 +Zn | | Cl Cl 2) Вычисляем количество полученного пропена практически n (С3Н6) = m (С3Н6)/М (С3Н6)= 3,36: 42 = 0,08 моль. 3) Следовательно, n (С3Н6Cl2), вступающего в реакцию, также равно 0,08 моль. 4) С учетом того, что выход в реакции равен отношению количества вещества практически вступающего в реакцию n(пр.), к количеству вещества, вступающего в реакцию теоретически n(теор.), определяем количество вещества С3Н6Cl2, взятого для реакции η = n(пр) /n(теор) ∙ 100% ═> n(теор)= n (пр) : η =0,08 :0.727= 1,1 моль. 5) Масса 1,2-дихлорпропана, взятая для реакции: m(С3Н6Cl2)= 0,11∙ 111=12,2 (г) Ответ: m(С3Н6Cl2)= 12,2 г 3.4. Задачи и упражнения для самостоятельного решения73. Приведите структурные формулы всех возможных изомеров углеводорода состава C6H12, назовите каждый изомер. 74. Какое вещество является структурным изомером цис-пентена-2. 75. Назовите следующие соединения: а) СН3-С( С2Н5)=С( С2Н5)-СН2-СН3 б) СН3-С( С2Н5)=СН- СН(СН3)2 Какое из этих соединений имеет цис-,транс-изомеры? 76. С какими из перечисленных реагентов будет вступать в реакцию 3-метилпентен-1: бром, хлорид натрия, натрий, вода, водород, перманганат калия, бромоводород. Напишите уравнения, укажите условия протекания реакций. 77. При пропускании каких из перечисленных веществ происходит обесцвечивание фиолетового раствора перманганата калия: бутана, пропана, углекислого газа, этана, пропена. 78. Осуществите превращение: 1-бром-3-метилбутан 79. Назовите вещества А, Б, В в следующих цепочках превращений: Н2О, Н+ - Н2О,H+ Cl2, t а) СН3СН=СН2 Br2 Zn, t H2, Ni, t б) СН3СН=СН2 Br2, t KOH(спирт) Br2 в) СН3СН2СН3 HBr KOH(спирт) KMnO4, H2O г) СН3СН=СН2 80. Осуществите следующие превращения, укажите вещество Х: а) СН3СНBrСН2Br б) СН3СН2СНBrСН2Br в) СН3СН2СН2Br г) СН3СН2СН2ОН 81. Получите из 1-бромпропана 2-бромпропан. 82. При гидрировании некоторого алкена массой 11,2 г требуется 4,48 л водорода (н.у.). Определите формулу алкена. Напишите структурные формулы изомеров. 83. При добавлении какого газообразного углеводорода к газовой смеси, состоящей из азота и оксида углерода(II), плотность газовой смеси будет равна 1,25 г/л? 84. Через 450 г раствора брома в тетрахлорметане c массовой долей брома 0,032 пропустили 3,36 л ( н.у.) смеси бутана, бутена-1 и бутена-2.Раствор брома при этом полностью обесцветился. Определите объём кислорода ( н.у.), необходимый для сжигания этой смеси. 85. 77,4 г смеси предельного и этиленового углеводорода, содержащих одинаковое количество атомов углерода, реагирует с 20,16 л (н.у.) бромоводорода. Определите состав смеси (в %% по объёму) и напишите структурные формулы углеводородов, если известно, что продукт взаимодействия этиленового углеводорода с бромом в 50,5 раз тяжелее гелия. 86. Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9, пропустили над нагретым платиновым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите состав полученной газовой смеси (в % по объему). 87. 2-метилбутан пропустили над нагретым платиновым катализатором, при этом плотность газовой смеси уменьшилась на 12%.Определите состав полученной газовой смеси( в % по объему) и выход в реакции дегидрирования. 88. Газовую смесь, состоящую из пентена и водорода и имеющую плотность по гелию 12, пропустили над нагретым никелевым катализатором .При этом образовалась газовая смесь с плотностью по гелию 14,1.Определите выход в реакции гидрирования и состав полученной газовой смеси (в % по объему). 89. Газовую смесь, состоящую из бутена-1 и водорода и имеющую плотность по аммиаку 2,5, пропустили над нагретым платиновым катализатором, при этом образовалась газовая смесь с плотностью по воздуху 1,83. Определите выход в реакции гидрирования и состав полученной газовой смеси (в %% по объему). 90.Через 500 г раствора брома в тетрахлорметане c массовой долей брома 0,064 пропустили 11,2 л ( н.у.) смеси бутана, бутена-1 и бутена-2. Раствор брома при этом полностью обесцветился. Определите массовую долю бутана в смеси углеводородов. 91. При пропускании 2,24 л ( н.у.) смеси этена, бутена и бутана через бромную воду прореагировало 40 г раствора с массовой долей брома 20%. Плотность газовой смеси по водороду равна 24,3. Определите состав смеси углеводородов ( в %% по объёму). 92. После пропускания смеси этана и этена через склянку с бромной водой масса склянки увеличилась на 2,8 г. При полном сгорании исходной смеси углеводородов образовалось 8,96 л (н.у.) оксида углерода (IV). Определите состав исходной смеси углеводородов (в %% по объему). 93. 38,7 г смеси алкана и алкена, содержащих одинаковое количество атомов углерода, может прореагировать с 10,08 л (н.у.) бромоводорода. Определите состав смеси (в%% по объему) и напишите структурные формулы углеводородов, если известно, что продукт взаимодействия этиленового углеводорода с бромом в 7,214 раз тяжелее этилена. 94. При пропускании 14,0 л (н.у.) смеси этена, пропена и бутана через раствор брома в тетрахлорметане прореагировало 320 г раствора с массовой долей брома 20%. Плотность газовой смеси по азоту равна 1,546. Определите состав смеси углеводородов ( в %% по объему). 95. При сжигании углеводорода, плотность паров которого 3,75 г/л (н.у.) получено 13,44 л углекислого газа и 10,8 г воды. Определите формулу углеводорода. 96. Определите строение этиленового углеводорода, если на полное каталитическое гидрирование 21 г его потребовалось 6,72 л ( н.у.) водорода. Напишите структурную формулу продукта гидрирования, если известно, что он содержит один третичный атом углерода. |
