Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
10.4. Задачи и упражнения для самостоятельного решения316. Напишите структурные формулы следующих соединений: а)2,2-диметилбутаналь;б)2,2,3-триметилпентаналь; в)2,4-диметилпентаналь; г) 3-метилбутаналь; д)2-пентанон; е) 4-метил-2-пентанон; ж)3-бутеналь;з)4-пентин-2-он 317. Напишите сокращённые линейные структурные формулы альдегидов, образующихся при окислении спиртов: а) пропилового; б) бутилового; в) амилового. 318. Напишите уравнения реакций восстановления водородом в присутствии никелевого катализатора: а) этаналя; б) формальдегида; в) масляного альдегида. 319. Напишите уравнения реакций каталитического окисления кислородом воздуха при высокой температуре следующих спиртов : а) пропанола-1; б) метанола; в) этанола. 320. Напишите уравнения реакций получения следующих альдегидов окислением соответствующих спиртов: а) 2-метилпропаналь; б) бутаналь; в) пропеналь.. 321. С какими альдегидами взаимодействует бромная вода: а) этаналь; б) пропаналь; в) акриловый альдегид? Напишите уравнения соответствующих реакций. 322. Для того, чтобы идентифицировать масляный альдегид, к нему надо добавить: а) бромоводородную кислоту. б) подкисленный раствор воды в) аммиачный раствор нитрата серебра. Выберите правильный ответ 323. Какой конечный продукт образуется в результате превращений: 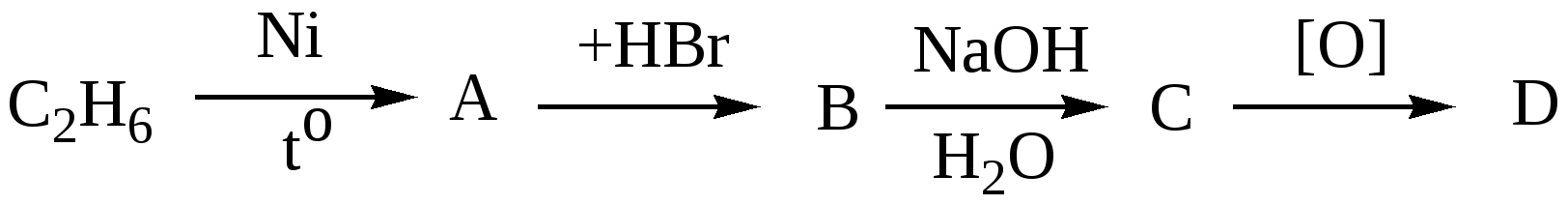 а) альдегид б) первичный спирт в) кетон 324. При взаимодействии этаналя с этанолом образуется: а) этилацетат(сложный эфир) б) этилацеталь этаналя (полуацеталь) в) диэтиловый эфир (простой эфир) Выберите правильный ответ 325. Напишите изомеры, отвечающие формуле С4H8O, относящиеся к классу карбонильных соединений. Какие из них реагируют с аммиачным раствором оксида серебра? 326. Напишите уравнение реакции взаимодействия пропаналя с метанолом в кислой среде 327. Напишите уравнение реакции хлорирования бутаналя 328. Напишите уравнение реакции формальдегида с фенолом 329. Напишите уравнение реакции гидратации метаналя 330. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) 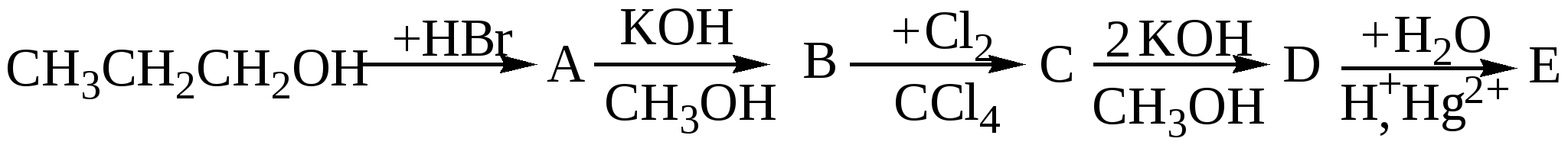 б) карбонат кальция ацетальдегид в) 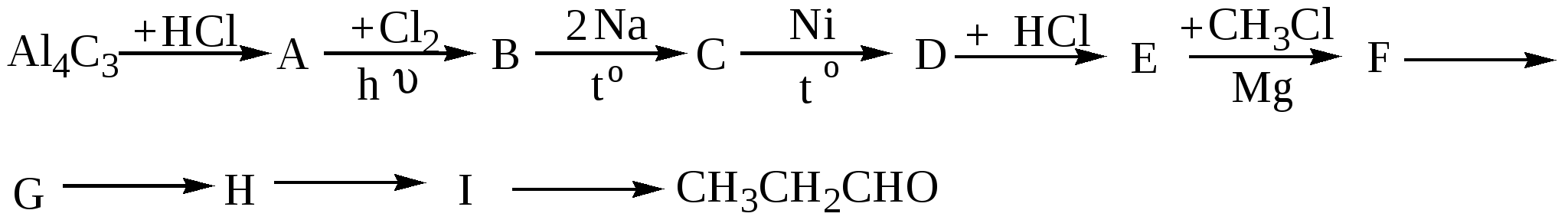 г) 331. Вещество, в состав молекулы которого входят три атома углерода, восемь атомов водорода и один атом кислорода, при окислении оксидом меди (2) превращается в соединение, которое при взаимодействии с избытком аммиачного раствора оксида серебра выделяет 21.6 г. осадка. Какой из трех изомеров исходного соединения был взят? Какова его масса? Все процессы протекают с количественным выходом. 332. Вычислите массу карбида кальция, содержащего 20% примесей, необходимую для двухстадийного синтеза этаналя, если выход продукта на каждом этапе составляет 80%, необходимого для получения 200 г 20% раствора альдегида. 333. При взаимодействии 4,6г этанола с оксидом меди(II) получили альдегид, масса которого равна 3,6г. Определите выход альдегида. 334. При восстановлении водородом уксусного альдегида массой 52,8г получили 41,4г этанола. Определить выход спирта в %. 335. Какая масса ацетилена необходима для получения ацетальдегида массой 11г по реакции Кучерова, если выход альдегида составляет 90%. 336. Рассчитайте объём раствора формальдегида с массовой долей НСНО 40% и плотностью 1,1 г/мл , который можно получить при окислении метилового спирта (плотность 0,8 г/мл) объёмом 200 мл с массовой долей СН3ОН 60%. 337. Вычислите массу ацетата аммония, которая образуется при обработке 150г 20% водного раствора ацетальдегида избытком аммиачного раствора нитрата серебра при нагревании. 338. Вещество имеет состав в массовых долях : С –62%; О-27,6% ; Н – 10,4%. Оно легко окисляется гидроксидом меди (II) с образованием кислоты. Выведите структурную формулу этого вещества. 339. Соединение состоит из 24.24% углерода, 4,04% водорода и 71,72 % хлора. При щелочном гидролизе соединение образует кислородсодержащее соединение, которое дает реакцию «серебряного зеркала». Определите строение исходного соединения. 340. При окислении альдегида массой 8,6 г аммиачным раствором оксида серебра выделилось 21,6 г серебра. Рассчитайте молярную массу альдегида. Напишите структурные формулы возможных изомеров и назовите их. 341. Смесь пропана и метаналя с плотностью по водороду 20,25 полностью прореагировала с 34,8г оксида серебра в аммиачном растворе. Определите массовые доли веществ в исходной смеси. 342. Водный раствор, содержащий 7,4г метаналя и этаналя, обработали избытком натрия, при этом выделилось 56л (н.у) водорода. При обработке исходного раствора той же массы избытком аммиачного раствора оксида серебра в аммиачном растворе выделилось 64,8г серебра. Рассчитайте массовые доли альдегидов в водном растворе. 343. При обработке смеси метаналя и этаналя избытком аммиачного раствора оксида серебра выделилось 43,2г осадка, а при сжигании смеси альдегидов такой же массы образовалось 2,88г. воды. Определите состав исходной смеси в % по массе. 344. Рассчитайте массу 3% раствора формальдегида, которую можно получить окислением 20 мл метанола (плотность 0,8г/мл) при 100% выходе. 345. Какой объём кислорода необходим для получения 1 кг 40% формалина окислением метанола? 346. Рассчитайте, какой объём 20% раствора уксусного альдегида (плотность 1г/мл) окисляется при реакции с гидроксидом меди(II), если при этом выделилось 43,2 г оксида меди(I). 347. Рассчитайте массу ацетальдегида, которую можно получить из 44,8м3 ацетилена при 90% выходе. 348. При действии на 30 г смеси этана, формальдегида и фенола избытком аммиачного раствора оксида серебра было получено 43,2 г металлического серебра. При действии на такое же количество смеси бромной водой было получено 66,2 г белого осадка. Определите количественный состав исходной смеси. 349. 21 г смеси, состоящей из 17,1% спирта и 82,9% альдегида, могут прореагировать с 69,6 г оксида серебра(аммиачный раствор). Напишите структурные формулы спирта и альдегида, учитывая, что они содержат одинаковое количество атомов углерода в молекуле и могут быть получены один из другого. Глава 11. КАРБОНОВЫЕ КИСЛОТЫ Карбоновые кислоты – соединения, содержащие в молекуле одну или несколько карбоксильных групп 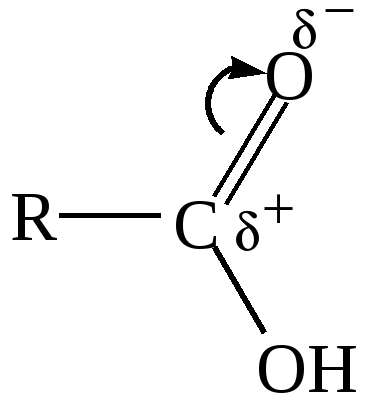 Атом углерода карбоксильной группы находится в состоянии sp2 –гибридизации, три σ -связи образуют угол 120о. В силу большей электроотрицательности кислорода электронная плотность π-связи смещена в сторону кислорода, и на атоме углерода образуется частичный положительный заряд. Классификация карбоновых кислот: - по природе радикала (предельные CnH2n+1COOH, непредельные, ароматические); - по основности (одноосновные, двухосновные, многоосновные). Физические свойства:Первые три члена гомологического ряда, включая пропионовую кислоту, - жидкости, имеющие резкий запах, хорошо растворимые в воде. Следующие гомологи, начиная с масляной кислоты, - так же жидкости, обладающие резким неприятным запахом, но плохо растворимые в воде. Высшие кислоты, с числом атомов углерода 10 и более, представляют собой твердые вещества без запаха, не растворимые в воде. 11.1. Получение карбоновых кислот 1. Окисление предельных углеводородов, спиртов и альдегидов [О] C2H5OH 2. Окисление алкенов Окисление алкенов сильными окислителями, например, кипящим раствором перманганата калия в кислой среде приводит к разрыву двойной связи и образованию кислот различного строения. 3. Окисление алкинов Алкины легко окисляются, при этом происходит расщепление тройной связи CH3-CH2-C≡CH При неполном окислении ацетилена образуется щавелевая кислота HC ≡ CH 4. Окисление гомологов бензола 5C6H5C2H5 + 12KMnO4 + 18H2SO4 5C6H5COOH + 5CO2 + 12MnSO4 + 28H2O + 6K2SO4 5. Синтез Гриньяра RMgBr + CO2 6. Гидролиз производных карбоновых кислот а) гидролиз ангидридов кислот (RCO)2O + H2O б)гидролиз галогенангидридов кислот R-CO-Cl + H2O в) гидролиз амидов кислот R-CO-NH2 + H2O R-COONH4 + HCl г) гидролиз гемтригалогенидов CH3CHCl3 + 4 KOH 11.2. Химические свойства карбоновых кислот 1. Растворимые кислоты диссоциируют в воде: RCOOH = RCOO- + H+ Благодаря наличию в воде иона Н+ они имеют кислый вкус, способны изменять окраску индикаторов и проводить электрический ток. В водном растворе эти кислоты – слабые электролиты. 2. Карбоновые кислоты (особенно растворимые в воде) обладают всеми свойствами неорганических кислот. Они взаимодействуют с активными металлами, основными оксидами, основаниями и солями слабых кислот: а) с металлами с образованием солей: 2CH3COOH + Zn б) с оксидами металлов 2CH3COOH + CuO в) с основаниями CH3COOH + KOH = CH3COOK + H2O г) с солями слабых кислот CH3COOH + NaHCO3 3. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификация) H2SO4CH3COOH + C2H5OH = CH3COOC2H5 + H2O4. Образование галогенангидридов CH3COOH + PCl5 CH3COOH + SOCl2 5. Образование амидов CH3COOH + NH3 t CH3COONH4 6. Межмолекулярная дегидратация с образованием ангидридов t , P2O5 2СH3COOH 7. Галогенирование в α –положение Р кр. CH3CH2COOH + Cl2 8. Декарбоксилирование а) Сплавление солей щелочных металлов со щелочами t СH3CH2COONa(тв.) + NaOH(тв.) б) Легко отщепляют СО2 при нагревании также галогензамещённые и двухосновные кислоты t CCl3COOH t HCOOH-CH2-COOH 9. Окисление Предельные кислоты с нормальной углеродной цепью окисляются трудно. Исключением является муравьиная кислота. HCOOH – это альдегидо кислота, которая даёт реакцию серебряного зеркала: HCOOH +2[Ag(NH3)2]OH |
