Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В
 Скачать 3.52 Mb. Скачать 3.52 Mb.
|
Глава 8. СПИРТЫСпирты- это гидроксипроизводные углеводородов, в которых группа –ОН непосредственно не связана с атомами углерода ароматического кольца. По числу гидроксильных групп различаются спирты одноатомные и многоатомные ( двухатомные, трёхатомные и с большим числом гидроксильных групп). По характеру углеводородного радикала различают спирты насыщенные, ненасыщенные, циклические, ароматические. Спирты, у которых гидроксильная группа находится у первичного атома углерода, называются первичными, у вторичного атома углерода – вторичными, у третичного атома углерода – третичными. Например:  бутанол-1 бутанол-2 2- метил-пропанол-2 (первичный) (вторичный) (третичный) 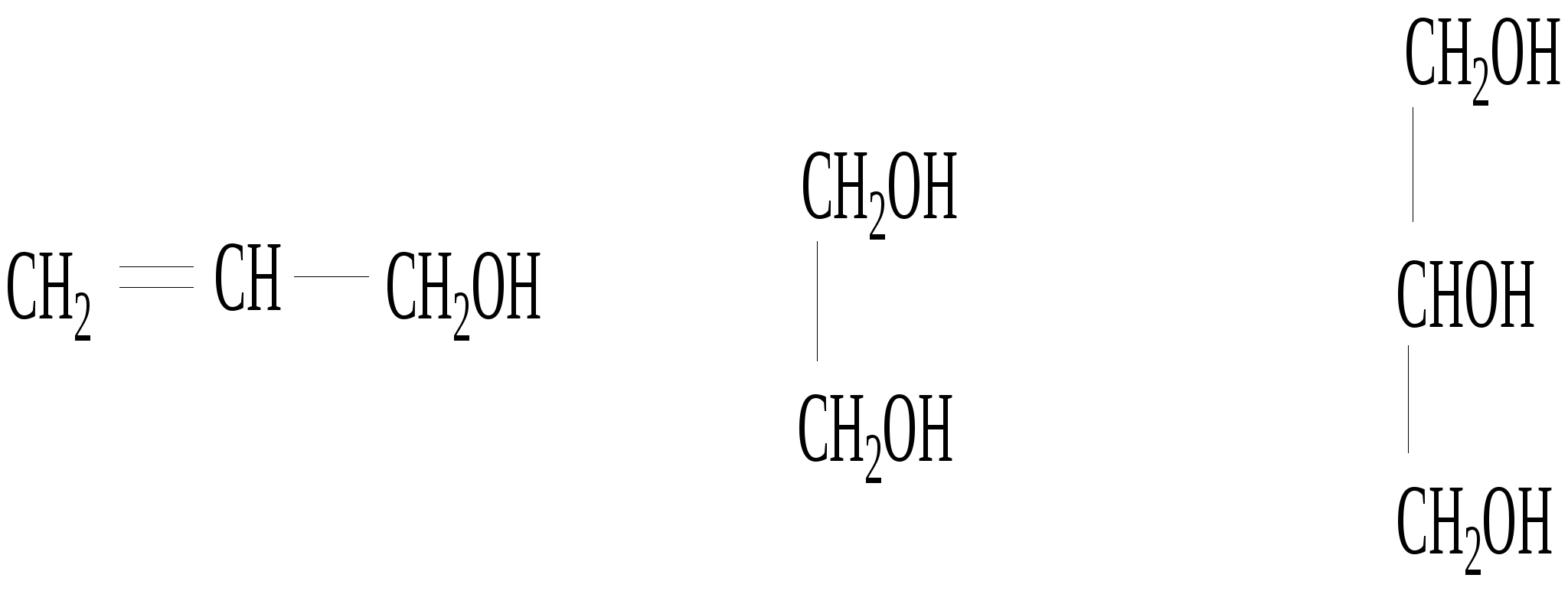 аллиловый спирт этиленгликоль глицерин (ненасыщенный спирт) (двухатомный спирт) (трёхатомный спирт) 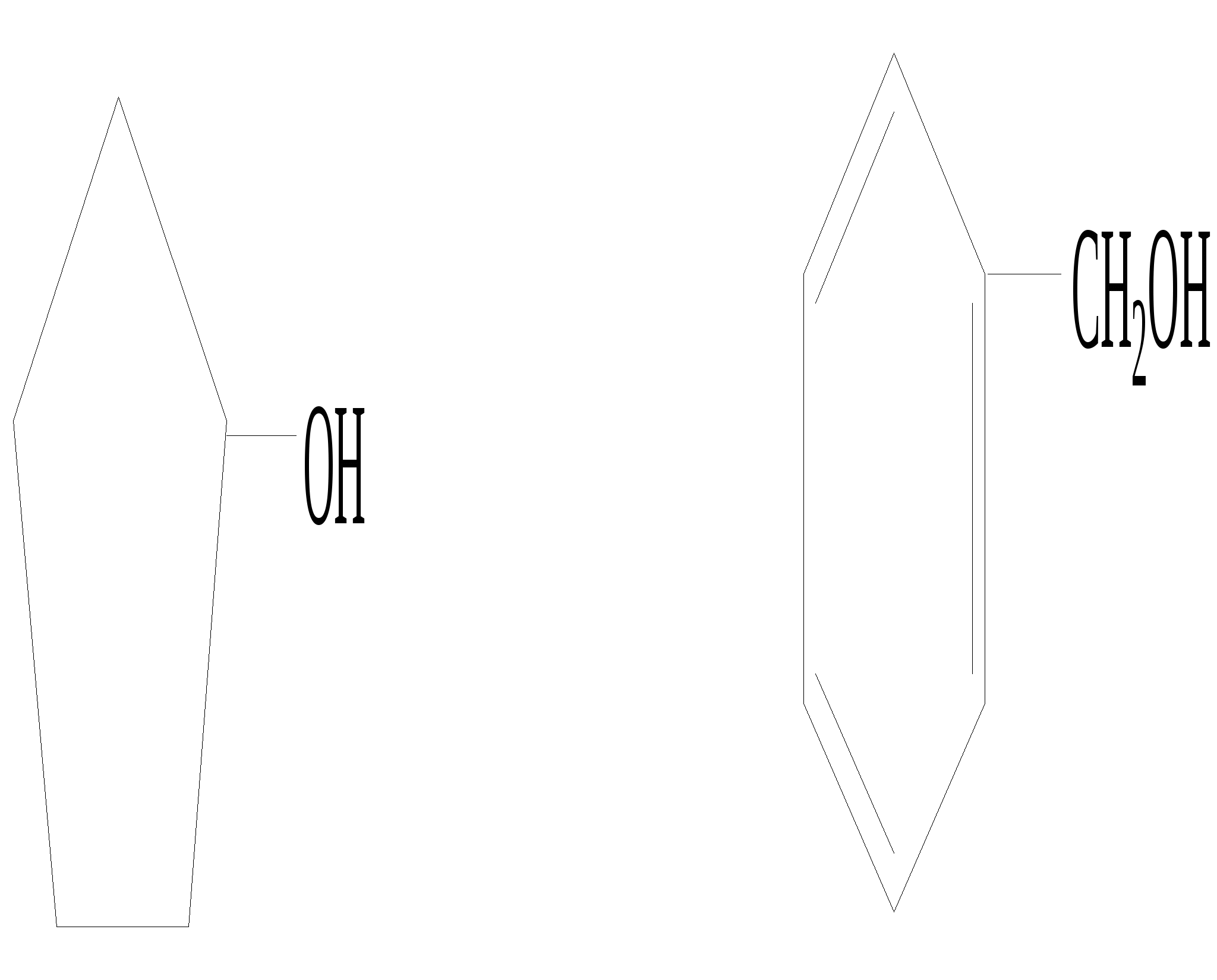 циклопентанол бензиловый спирт (циклический спирт) (ароматический спирт) 8.1. Получение спиртов 1. Гидратация алкенов в кислой среде: R1−CH=CH−R2 + H2O(H+) Например: CH2=CH2 + H2O(H+) 2. Гидролиз алкилгалогенидов в кислой или щелочной среде: CH3−CH2−CH2−Br +NaOH(H2O) 3. Гидролиз сложных эфиров: а) в кислой среде CH3COOC2H5 + H2O(H+) = CH3COOH + C2H5OH б) щелочной гидролиз(омыление) CH3COOC2H5 + NaOH(H2O) 4. Восстановление более высокоокисленных соединений а) альдегиды: 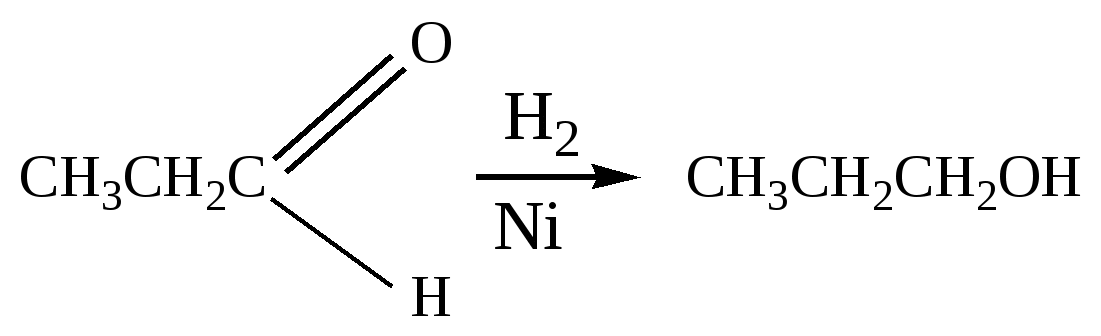 пропаналь пропанол-1 б) кетоны: 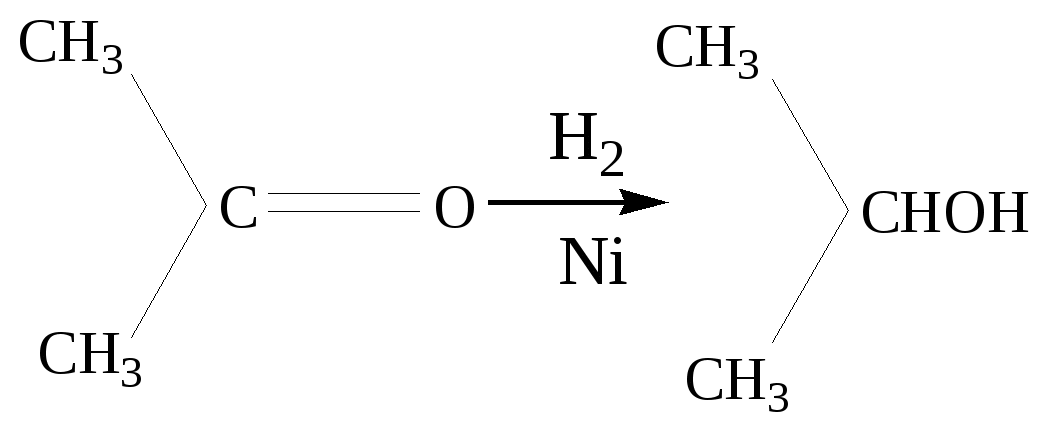 пропанон пропанол-2 в) кислоты: 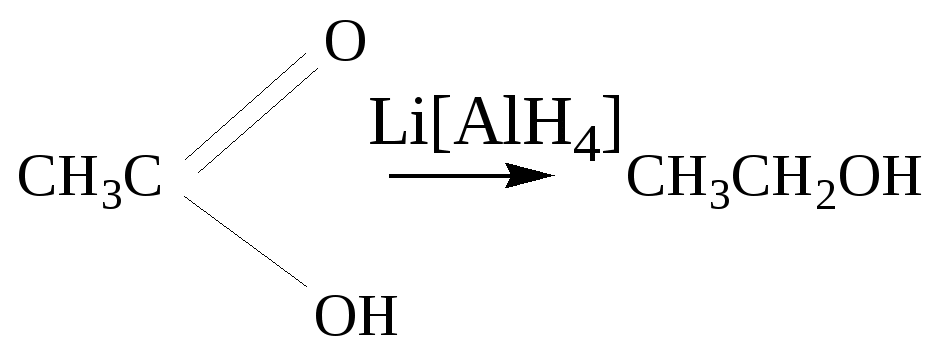 уксусная кислота этанол г) сложные эфиры: метилацетат этанол метанол Восстановление по пути а) и б) можно провести с помощью многих восстановителей- амальгама натрия и вода, натрий в спирте, каталитическое восстановление водородом на тонкоизмельчённом никелевом или платиновым катализатором. Восстановить карбоновые кислоты и их сложные эфиры можно только с помощью сильных восстановителей, таких как алюмогидрид лития LiAlH4. 5. Биохимические методы. Например, этанол получается при ферментативном разложении глюкозы: С6Н12О6 8.2. Химические свойства спиртов 1. Кислотные свойства. Спирты – чрезвычайно слабые кислоты, они практически не реагируют водными растворами щелочей.Но водород в гидроксильной группе можно заместить путём прямого взаимодействия спирта со щелочными и щелочноземельными металлами, при этом образуются алкоголяты, например: C2H5OH + Na этилат натрия Поскольку спирты – чрезвычайно слабые кислоты, их соли(алкоголяты) – очень сильные основания. Основность алкоголята зависит от типа исходного спирта. В растворе алкоголяты третичных спиртов – более сильные основания, чем алкоголяты вторичных спиртов, которые в свою очередь сильнее, чем алкоголяты первичных спиртов. Алкоголяты представляют собой твёрдые вещества, растворимые в спирте. Они легко гидролизуются водой с образованием соответствующего спирта и щелочи: C2H5ONa + H2O 2. Реакции замещения гидроксильной группы (реакции нуклеофильного замещения). Спирты реагируют с газообразными галогеноводородами( в отсутствие воды), например: C2H5OH + HBr 3. Дегидратация (отщепление воды). Нагревание спирта с концентрированной серной кислотой приводит к отщеплению воды и образованию алкена. Конкурирующим процессом является межмолекулярная дегидратация, в результате которой образуется простой эфир. Прямая дегидратация спиртов под действием серной кислоты протекает с высоким выходом простого эфира только в случае первичных спиртов, например: 2С2Н5ОН Вторичные и третичные спирты в этих условиях легко превращаются в алкены Во многих случаях процесс дегидратации может привести к нескольким изомерам. Основной продукт образуется в соответствии с правилом Зайцева: в наибольшем количестве образуется алкен с наименьшим числом атомов водорода у двойной связи. (CH3)2C(OH)CH2CH3 2-метилбутанол-2 бутен-2 Внутримолекулярная дегидратация преобладает при большом избытке серной кислоты и более сильном нагревании(t> 140оС), а межмолекулярная – при нагревании избытка спирта с серной кислотой( t< 140оС) 4. Этерификация (образование сложных эфиров). Сложные эфиры образуются при действии на спирты минеральных или органических кислот. С органическими кислотами реакция протекает в присутствии минеральных кислот(катализатор), например: СН3СООН + С2Н5ОН = СН3СООС2Н5 + Н2О 5. Окисление спиртов При окислении первичных спиртов на первой стадии образуются альдегиды, а на второй – карбоновые кислоты. Третичные спирты окисляются только с расщеплением углеродного скелета. В качестве окислителя используются растворы перманганата калия и дихромата калия , концентрированная азотная кислота. Для окисления первичных спиртов до альдегидов часто применяют метод пропускания паров спирта над раскалённым CuO. Например: СН3СН2ОН + CuO(toC) этанол этаналь Окисление первичных спиртов в соответствующие карбоновые кислоты легко осуществляют, действуя концентрированной азотной кислотой или раствором перманганата калия.Например: СН3СН2СН2ОН + (KMnO4 + H2SO4) пропанол-1 пропановая кислота Окисление вторичных спиртов в условиях, исключающих разрушение их углеродного скелета, приводит к получению кетонов: СН3−СН(ОН) − СН3 пропанол-2 пропанон(ацетон) Третичные спирты устойчивы к окислению в мягких условиях, например при использовании в качестве окислителя раствор CrO3 в трет-бутиловом спирте. Однако в жёстких условиях происходит окислительная деструкция третичных спиртов, протекающая с разрывом связей С-С и приводящая к образованию смеси окисленных фрагментов молекулы в виде кетонов или карбоновых кислот: 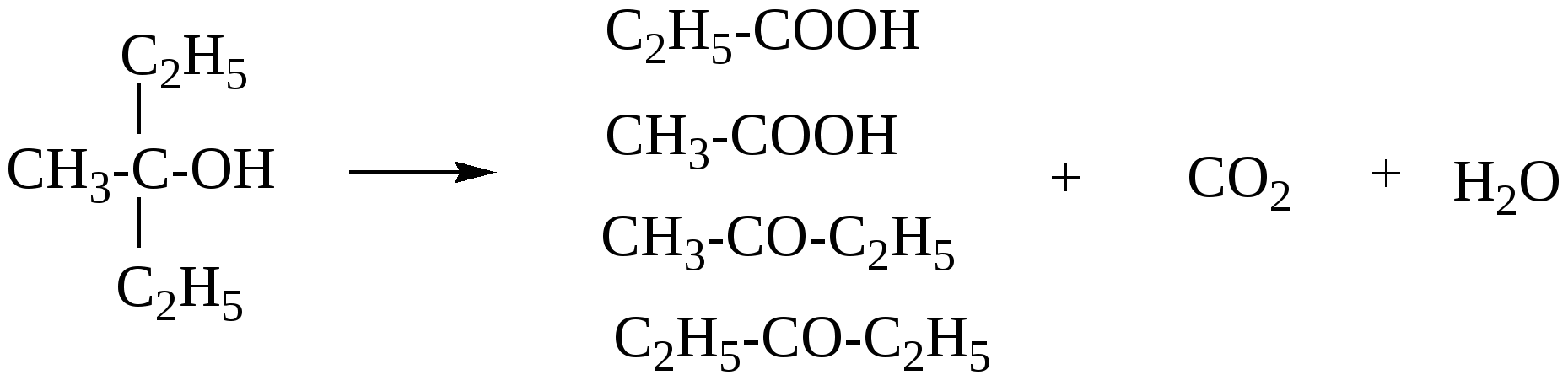 8.3. Многоатомные спирты Многоатомные спирты способны к ассоциации в значительно большей степени, чем обычные, поскольку в их молекулах содержится большее число гидроксильных групп, участвующих в образовании водородных связей. Этим объясняется их хорошая растворимость в воде и существенно более высокие температуры кипения, чем в случае одноатомных спиртов с такой же молекулярной массой. 1. Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов. Отличия: 2. При обработке хлоро- и бромоводородом замещение одной или двух гидроксильныхй групп на галоген происходит сравнительно легко.Последняя гидроксильная группа замещается значительно труднее – требуется применение соответствующих галогенидов фосфора: HOCH2CH2OH + HCl(toC) HOCH2CH2Cl + (PCl3) Глицерин при обработке бромоводородом даёт в конечном итоге смесь двух изомерных дибромидов: CH2(OH)CH(OH)CH2(OH) + HBr CH2BrCH2(OH)CH2Br + H2O 3. По кислотности простейшие многоатомные спирты – этиленгликоль и глицерин – превосходят обычные. Многоатомные спирты реагируют с натрием. Этиленгликоль и глицерин, реагируя с натрием, дают мононатриевую соль. Дальнейшая реакция натрия с другими гидроксильными группами протекает в более жёстких условиях: (НО)СН2СН2(ОNa) и [ СН2(ОNa)СН(ОН)СН2(ОН) + СН2(ОН)СН(ОNa)СН2(ОН) ]. 4.Этиленгликоль и глицерин дают несколько рядов сложных эфиров в зависимости от того сколько гидроксильных групп участвовало в реакции этерификации. Например, глицерин даёт пять рядов сложных эфиров карбоновых кислот:  При действии на глицерин нитрующей смеси(концентрированные азотная и серная кислоты) образуется полный сложный эфир глицерина и азотной кислоты – нитроглицерин – CH2(ONO2) – CH(ONO2) – CH2(ONO2). 5. Направление дегидратации этиленгликоля от условий её проведения. Так, в присутствии небольших количеств серной кислоты при нагревании происходит межмолекулярная реакция и образуется диоксан: 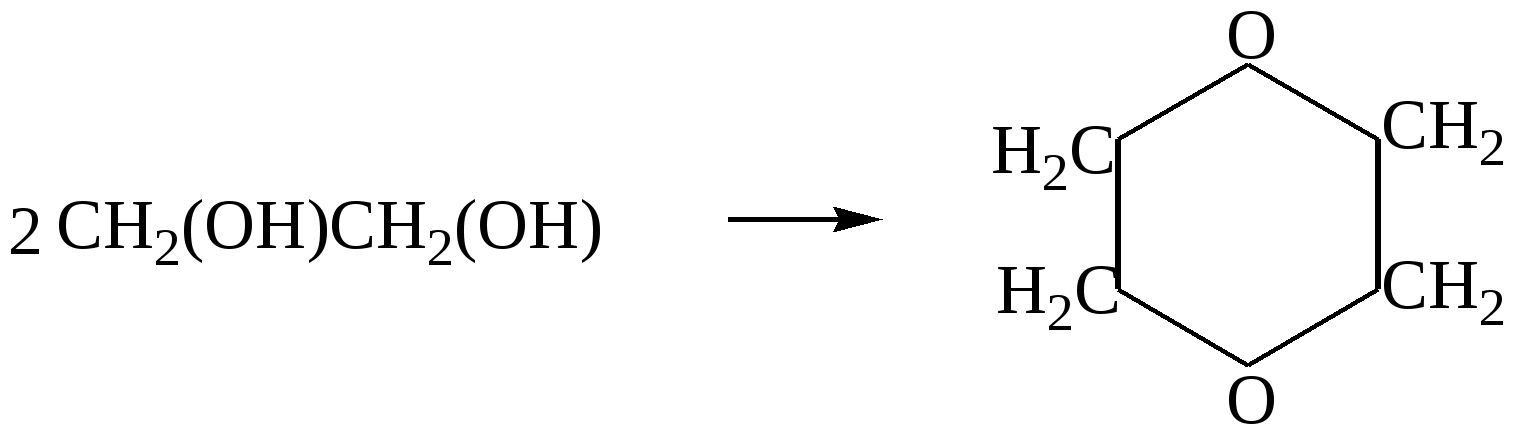 При нагревании с хлоридом цинка дегидратация происходит внутримолекулярно и приводит к уксусному альдегиду: СН2(ОН)СН2(ОН) При дегидратации глицерина (нагревание с бисульфатом калия ) отщепляется две молекулы воды и образуется непредельный альдегид –акролеин СН2=СНСНО. 6. Окисление обычно приводит к образованию щавелевой(этандиовой)кислоты: СН2(ОН) - СН2(ОН) Окисление глицерина жёсткими окислителями(например, хромовая кислота) приводит к полному расщеплению молекулы. Мягкие окислители(например, разбавленная азотная кислота) в конечном счёте глицерин окисляют до глицериновой кислоты – СН2(ОН)- СН(ОН)- СООН. 7. Качественной реакцией на многоатомные спирты является взаимодействие с гидроксидом меди(II) в щелочной среде, приводящее к образованию внутрикомплексного соединения, имеющего интенсивную синюю окраску, например: 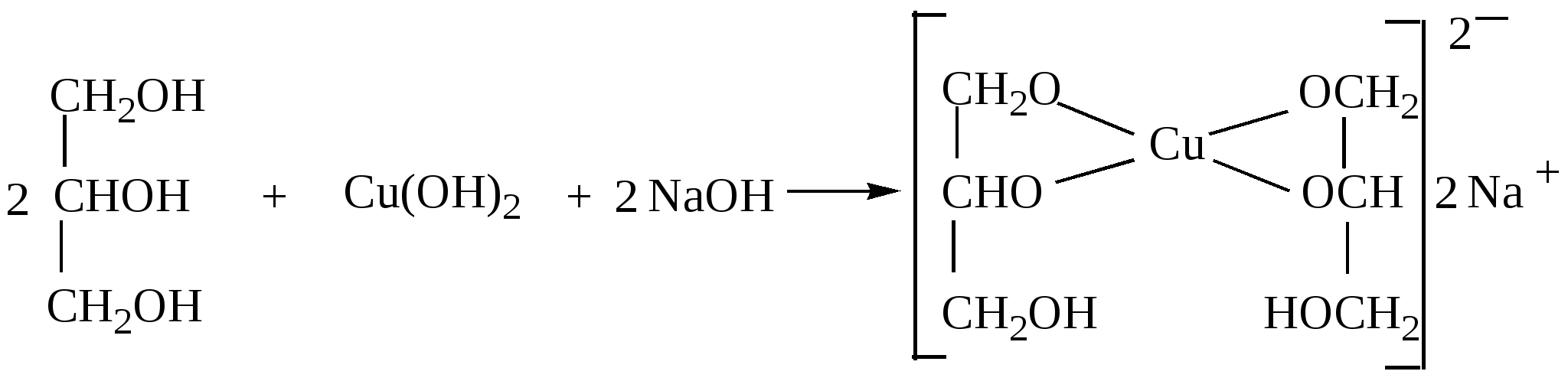 глицерин глицерат меди(II) (синее окрашивание) 8.4. Примеры решения задач Пример 24. При обработке 166г смеси пропанола и этанола металлическим натрием выделилось 33,6л(н.у.) водорода. Рассчитайте массовую долю спиртов в исходной смеси. Решение: 1) Обозначим количество вещества пропанола через х , а количество вещества этанола через y. Тогда масса соответствующих спиртов будет: m(C3H7OH) = 60x и m(C2H5OH) = 46y Масса смеси спиртов равна: 60x + 46y = 166 2) Напишем соответствующие уравнения реакций: 2C3H7OH + 2Na x 0,5x 2C2H5OH + 2Na y 0,5y 3) Находим количество вещества водорода n(H2) = V(H2)/ VM = 33,6/22,4 = 1,5моль 4)Выражаем общее количество вещества водорода, выделившегося в результате реакции: 0,5x + 0,5y = 1,5 После преобразования получим: x + y = 3 5)Решаем систему двух уравнений с двумя неизвестными: x + y = 3 60x + 46y = 166 Отсюда: x=2 и y=1 6) Тогда масса этанола равна 46∙1 =46г, а пропанола 60∙2 = 120г Массовые доли спиртов в исходной смеси: ω(С2H5OH) = 46/166 = 27,71% ω(C3H7OH) = 120/ 166 = 72,29% Ответ: ω(С2H5OH) = 27,71% ω(C3H7OH) = 72,29% Пример 25. При дегидратации предельного одноатомного спирта и последующем взаимодействии с бромом было получено 150,4г дибромида. При действии на такое же количество спирта избытком натрия выделяется 8,96л(н.у.) водорода. Каково строение исходного спирта? Решение: 1)Напишем уравнения соответствующих реакций: а)CkH2k+1OH б)CkH2k + Br2 в)CkH2k+1OH + Na 2)Находим количество водорода: n(H2) = V(H2)/VM = 8,96/22,4 = 0,4моль 3)Выражаем молярную массу дибромида как M = 14k + 160 и находим количества вещества дибромида: n = m(дибромида)/ М(дибромида) = 150,4/ (14k + 160) В соответствии с уравнениями а) и б) количество вещества дибромида равно количеству вещества спирта. 4)Так как n(CkH2k+1OH) = 2 n (H2) 150.4/(14k+ 160) = 2∙0,4 = 0,8; (14k + 160)∙0,8 = 150,4 11,2k + 128 = 150,4; k = 2 Исходный спирт: С2Н5ОН Ответ: этанол Пример 26. При обработке смеси стирола и этанола избытком натрия выделилось 4,48л(н.у.) газа. Такая же масса смеси полностью прореагировала с 200г 4% раствора брома в CCl4 . Определить массу исходной смеси. Решение: 1) Запишем уравнения реакций: а)C6H5CH=CH2 + Br2 б)2C:H5OH + 2Na 2) Находим количество вещества водорода: n(H2) = 4,48/22,4 = 0,2 моль 3) Находим массу брома: m(раствора)∙ ω(Br2) = 200∙0,04 = 8(г) 4) Количество вещества брома равно: 8/160 = 0,05(моль) 5) Согласно уравнению реакции (а)взаимодействия стирола с бромом количество вещества стирола равно количеству вещества брома n(стир) = n(Br2) = 0,05моль. Тогда масса стирола равна: m = M(стирола)∙n(стирола) = 104∙0,05 = 5,2(г), 6) Согласно уравнению реакции (б) n(C2H5OH) =2n(H2) и масса этанола m(C2H5OH) = M(C2H5OH)∙n(C2H5OH) =46∙0,4 = 18,4(г) 7) Масса исходной смеси: m(стирол) + m(этанол) = 5,2 + 18,4 = 23,6(г). Ответ:23,6 г Пример27. При обработке 56,4г смеси этанола и пропандиола-1,2 избытком натрия выделился водород, в количестве достаточном для полного гидрирования 0,5 моль смеси этена и этина с плотностью по водороду 13,6. Определите состав исходной смеси в %% по массе. Решение: 1) Запишем соответствующие уравнения реакций: а)CH3−CH(OH) – CH2(OH) +2Na б)2C2H5OH + 2Na в)C2H4 + H2 г)C2H2 + 2H2 2) Рассчитываем среднюю молярную массу смеси газов: Мср. (газ.смеси) =D(газ.смеси)водород ∙ М (Н2) = 13,6 ∙ 2 = 27,2 (г/моль). 3) Масса газовой смеси m = M(газ.смеси)∙ n(газ.смеси) = 27,2∙ 0,5 = 13,6(г) 4) Находим количества веществ этена и этина в газовой смеси: m(смеси) = M(C2H4) n(C2H4) + M(C2H2) n(C2H2) , где n(C2H4) + n(C2H2) = 0,5 13,6 = 28 n(C2H4) + 26[0,5 - n(C2H4)] Откуда n(C2H4) = 0,3 (моль) и n(C2H2) = 0,2(моль) 5) Согласно уравнениям (в) и (г) общее количество водорода равно n(H2) = 0,3 + 0,4 = 0,7(моль) Такое же количество водорода выделилось при взаимодействии спиртов с натрием. 6) Пусть n(пропандиол-1,2) =x (моль), а n(этанол) = y(моль). Тогда согласно уравнениям (а) и (б): x + 0,5y = 0,7 7) Масса смеси спиртов равна: 76x + 46y = 56,4 Решая систему двух уравнений с двумя неизвестными, находим x и y: 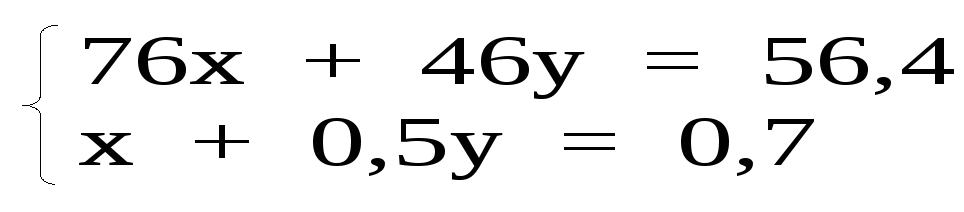 Отсюда: х=0,5 и y=0,4 Масса пропандиола –1,2 равна m1 = 0,5 ∙ 76 = 38(г) Масса этанола равна m2 = 0,4∙ 46 = 18,4(г) Массовая доля пропандиола –1,2 ω1 = 38/56,4 = 67,4% Массовая доля этанола ω2 = 32,6% Ответ: ω(этанола) = 32,6% ω(этандиола) = 67,4%8.5. Задачи и упражнения для самостоятельного решения226. Приведите общие формулы предельных и непредельных спиртов. 227. Приведите формулы изомеров бутанола-1. 228. Приведите формулы изомеров этанола, пропанола и диэтилового эфира. 229. На примере пропанола-1 и бутанола-1 покажите, как превратить первичный спирт во вторичный. 230. Некоторое количество пропанола-1 нагрели в закрытом сосуде в присутствии нескольких капель концентрированной серной кислоты. Приведите формулы трёх простых эфиров, образовавшихся в результате реакций. 231. Смесь бутанола-1 и этанола нагрели в замкнутом сосуде в присутствии нескольких капель концентрированной серной кислоты. Какие алкены и какие простые эфиры могут при этом образоваться? 232. Какие из нижеперечисленных веществ реагируют с этанолом: кислород, гидрокарбонат натрия, натрий, углекислый газ,оксид меди(II),гидроксид натрия,бромоводородная кислота,гидроксид меди(II)? 233. Приведите реакции окисления метанола,пропанола-1 и пропанола-2. 234. В трёх пробирках находятся: этанол,пропен-2-ол-1 и пентин-1.Идентифицируйте эти вещества. 235. Сравните количества оксида углерода(IV) и воды при сгорании любого непредельного одноатомного спирта. 236. Чем обусловлены относительно высокие температуры кипения спиртов? 237. Сравните кислотные свойства первичных, вторичных и третичных спиртов. Дайте объяснения. 238. Смесь двух галогеналкилов последовательно обработали водным раствором гидроксида натрия,избытком оксида меди(II) при нагревании и получили один продукт. Предложите возможные формулы галогеналкилов. 239. Смесь двух изомерных спиртов подвергли последовательно дегидратации,окислению перманганатом калия в нейтральной среде,обработке бромоводородом,обработке спиртовым раствором гидроксида натрия,исчерпывающему гидрированию и изомеризации в присутствии хлорида алюминия. Конечным продуктом был только:а)изопентан; б) изобутан. Назовите исходные спирты. 240. В результате нагревания смеси двух первичных спиртов с небольшим количеством концентрированной серной кислоты в замкнутом сосуде среди продуктов были найдены алкены,этилизопропиловый эфир и другие простые эфиры. Приведите формулы всех полученных веществ и формулы исходных спиртов. 241. Дегидратация бутанола-2 может привести к образованию трёх изомерных бутенов. Напишите соответствующие реакции,укажите условия их протекания и изобразите структурные формулы изомеров. 242. Назовите металлы,с которыми спирты реагируют энергичнее, чем с натрием. Дайте объяснения. 243. Получите изопропиловый спирт двумя разными способами. 244. Приведите по одному гомологу метилэтилового эфира и метанола, которые бы являлись изомерами. 245. Из метана получите 2- метилпропанол-2, используя только продукты реакции,кислород и катализаторы. 246. Из пропанола-1 ,серной кислоты и бромида калия, не используя никаких других соединений, получите два изомерных алкана. 247. Из карбида алюминия получите этанол. 248. Из карбида кальция получите 2-метилпропанол-2. 249.Из карбида алюминия получите диэтиловый эфир. 250.Из метана получите этандиол. 251. Как различить этанол и этандиол? 252. Как реагирует пропандиол1,2 с натрием,бромоводородом и гтдроксидом натрия? 253. Как различить 1-хлорпентан и 1,2,3-трихлорпропан? 254. Как различить 1-хлорпропан и 1,2-дихлорпропан? 255. Как различить глицерин и 3-хлор-пропандиол-1,2? 256. Приведите общие формулы двух и трёхатомных спиртов. 257. Как проявляется взаимное влияние гидроксильных групп в многоатомных спиртах? 258. Рассчитайте массовую долю углерода в бутандиоле-1,2. 259. Назовите одноатомный спирт, в котором массовая доля углерода равна 60%. 260. Определите формулу одноатомного предельного спирта, при внутримолекулярной дегидратации 30г которого выделилось 9г воды. 261. При обработке 12г одноатомного спирта металлическим на/трием выделилось 2,24л(н.у.) водорода. Назовите спирт. 262. При обработке одноатомного спирта металлическим натрием образовался алкоголят, в котором массовая доля натрия равна 23,96%. Назовите спирт. 263. При обработке 83г смеси пропанола и этанола металлическим натрием выделилось 16,8л(н.у.) водорода. Рассчитайте массовую долю спиртов в исходной смеси. 264. При сжигании 31,4г смеси этанола и бутанола образовалось 35,84л(н.у.) углекислого газа. Рассчитайте массовую долю спиртов в исходной смеси. 265. 18г одноатомного спирта обработали избытком натрия, при этом выделился водород в количестве, достаточном для полного гидрирования 1,68л(н.у.) бутадиена-1,3. Назовите исходный спирт. 266. В 200мл этанола (плотность равна 0,8г/мл) растворили такое количество натрия, что массовая доля алкоголята стала равна 17,7%. Рассчитайте массу растворённого натрия. 267. 250 мл этанола(плотность 0,8г/мл), в котором массовая доля воды равна 4,5%, прореагировало с избытком натрия. Рассчитайте объём выделившегося водорода. 268. 4,6г натрия растворили в 200мл этанола (плотность равна 0,8г/мл).Рассчитайте массовую долю алкоголята натрия в спиртовом растворе. 269. При дегидратации предельного одноатомного спирта и последующим взаимодействии с бромом образовавшегося алкена было получено 20,2г дибромида. При действии избытка натрия на такое же количество спирта выделяется 1,12л(н.у.) водорода. Назовите исходный спирт. 270. При дегидратации 9,25г предельного одноатомного спирта образовался алкен, объём которого в 4 раза меньше объёма углекислого газа, образующегося при сжигании такого же количества спирта. Назовите исходный спирт. 271. При дегидратации предельного одноатомного первичного спирта с разветвлённым углеродным скелетом образовался алкен, который смешали с равным объёмом азота. Плотность полученной газовой смеси стала равна плотности пропена при тех же условиях. Установите строение спирта. 272. При взаимодействии предельного одноатомного спирта с бромоводородом образовалось соединение, в котором массовая доля брома равна 73,4%. Назовите спирт. 273. Дегидратацией некоторого количества одноатомного предельного спирта получен алкен. Половина образовавшегося газа может обесцветить 120г 20% раствора брома в CCl4 , а при сожжении второй половины газа образуется 10,08л(н.у.) углекислого газа. Какой спирт и в каком количестве был подвергнут дегидратации? 274. При нагревании 23г этанола с небольшим количеством концентрированной серной кислоты образовался газ и легкокипящая жидкость. Газ может обесцветить 40г 40% раствора брома в CCl4. Какие соединения и в каком количестве образовались? 275. При дегидратации предельного одноатомного спирта и последующем взаимодействии с хлором было получено 59,4г дихлорида. При действии на такое же количество спирта избытком натрия выделяется 6,72л(н.у.) водорода. Каково строение исходного спирта? 276. В 50 мл метанола(плотность равна 0,79г/мл) растворили столько лития, что массовая доля алкоголята стала равна 36,28%. К этому раствору добавили 20мл воды и пропустили 6,72л(н.у.) углекислого газа. Рассчитайте массовые доли веществ в конечной смеси. 277. Какой одноатомный спирт взят для реакции, если при взаимодействии 72г этого спирта с избытком натрия выделился водород в количестве, достаточном для полного гидрирования 6,72л(н.у.) пропина. 278. Какое- то количество алкена присоединило 8,96л(н.у.) бромоводорода. При гидролизе полученного продукта водным раствором гидроксида натрия образовалось 29,6г одноатомного спирта с положением гидроксильной группы у третичного атома. Каково строение алкена и спирта? 279. При межмолекулярной дегидратации некоторого количества одноатомного спирта образовалось 55,5г простого эфира, а при внутримолекулярной дегидратации такого количества спирта образовалось 33,6л(н.у.) алкена. Определите формулу исходного спирта. 280. Предельный одноатомный спирт дегидратировали, в результате образовался алкен, объём которого в три раза меньше объёма углекислого газа, образующегося при сгорании такого же количества спирта. Полученный алкен обесцвечивает 120г 20% раствора брома в CCl4 . Определите спирт. 281. При дегидратации предельного одноатомного спирта и последующей обработке алкена бромоводородом получили 12,3г бромпроизводного, при обработке которого водным раствором гидроксида натрия получили 6г изомера исходного спирта. Определите структурную формулу исходного спирта. 282. Некоторое количество алкена присоединило 58,24л(н.у.) бромоводорода. При обработке полученного продукта водным раствором гидроксида натрия образовалось 156г предельного одноатомного спирта. Определите строение исходного углеводорода и полученного спирта. 283. При обработке смеси стирола и этанола избытком натрия выделилось 2,24л(н.у.) газа. Такая же масса смеси полностью прореагировала со 100г 4% раствора брома в CCl4. Определите массу исходной смеси. 284. При дегидратации одноатомного спирта и последующим взаимодействии с бромом образовавшегося алкена получили 101г дибромида. При действии на такое же количество спирта избытком натрия выделилось 5,6л(н.у.) газа. Рассчитайте массу исходного спирта. 285. При обработке 14,4г двухатомного спирта избытком калия выделилось 3,584л(н.у).газа. Назовите спирт. 286. При обработке некоторого количества двухатомного спирта избытком натрия выделилось 2,24л(н.у.) газа, а при сжигании такого же количества спирта выделилось 6,72л(н.у.) углекислого газа. Назовите спирт. 287. При сжигании 16,6г смеси пропандиола-1,2 и бутандиола-1,2 выделилось 15,68л(н.у.) углекислого газа. Рассчитайте массовые доли спиртов в исходной смеси. 288. 15,4г смеси этанола и этандиола-1,2.обработали избытком натрия, при этом выделилось 4,48л(н.у.) водорода. Рассчитайте состав исходной смеси в %% по массе. 289. При действии на смесь метанола и пропандиола-1,2 избытком натрия выделилось 12,32л(н.у.) газа, а при сжигании такого же количества смеси образовалось 33,6л(н.у.) углекислого газа. Рассчитайте состав смеси в %% по массе. 290. При реакции избытка натрия с 23,8г смеси бутанола-2 и насыщенного двухатомного спирта выделилось 4,48л(н.у.) газа. При сжигании такой же массы смеси в избытке кислорода образовалось 27г воды. Назовите спирт. 291. Двухатомный спирт массой 7,44г обработали равномолекулярным количеством хлороводорода, при этом образовалось соединение массой 9,66г, в молекуле которого содержится по одному атому кислорода и хлора. Назовите спирт. 292. Два двухатомных спирта являются ближайшими гомологами. При сжигании 16,6г равномолекулярной смеси этих спиртов выделилось 15,68л(н.у.) углекислого газа. Определите формулы спиртов и рассчитайте их количества. 293. При обработке 56,4г смеси этанола и пропандиола-1,2 избытком натрия выделился водород, в количестве достаточном для полного гидрирования 0,5 моль смеси этена и этина с плотностью по водороду 13,6. Определите состав исходной смеси в %% по массе. Глава 9. ФЕНОЛЫ Фенол – соединение, содержащее гидроксильную группу, которая непосредственно связана с атомом углерода ароматического кольца. Фенол, а также о-, м- и п- метилфенолы(крезолы) содержатся в каменноуголной смоле. 3-метил-6-изопропилфенол(тимол) и изомерный ему 2-метил-5-изопропилфенол (корвалол) входят в состав душистых масел чабреца и тмина. Фенолы и многоатомные фенолы в виде различных производных применяются в медицине парфюмерии ( таннин, ванилин, антиоксиданты, дезинфицирующие средства). Фенолы представляют собой твёрдые кристаллические вещества с резким характерным запахом. Они плохо растворимы в воде, хорошо- в спирте и эфире. 9.1. Получение фенола 1. Кумольный способ 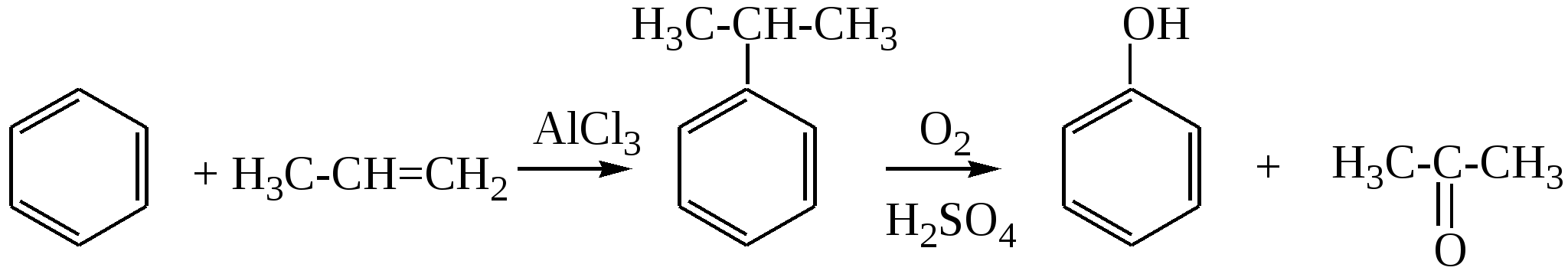 2. Из ароматических галоидных соединений а) Действие едких щелочей при нагревании в присутствии тонкого порошка меди C6H5Cl + NaOH б) Парофазный каталитический гидролиз хлорбензола. 3. Из каменноугольной смолы Каменноугольную смолу обрабатываю раствором щелочи и выделяют фенолы из полученных продуктов кислотой: C6H5OH + NaOH 2C6H5ONa + H2SO4 4. Из ароматических сульфокислот C6H6 + HO-SO3H бензолсульфокислота Далее бензолсульфокислоту сплавляют с гидроксидом натрия C6H5-SO3H + 3NaOH Далее: C6H5ONa + HCl 9.2. Химические свойства фенолов Химическое поведение фенолов связано с наличием в их молекуле гидроксильной группы и ароматического ядра. Они вступают практически во все реакции, характерные для них. .В то же время имеется ряд особенностей связанных с взаимным влиянием гидроксильной группы и бензольного ядра. 1. Кислотные свойства В связи с тем, что неподелённая электронная пара атома кислорода гидроксильной группы вступает во взаимодействие с π – электронами бензольного ядра, электронная плотность смещается в сторону бензольного ядра(+М-эффект), на последнем возникает дефицит электронной плотности и атом водорода приобретает большую подвижность. По этой причине фенол является слабой кислотой а) В водных растворах диссоциируют по кислотному типу: C6H5OH = C6H5O- + H+ б) Реакция с активными металлами. 2C6H5OH + 2Na в) В отличие от спиртов растворяется (как и другие фенолы ) в водных растворах щелочи, образуя феноляты  C6H5OH + NaOH = C6H5ONa + H2O Феноляты, будучи солями слабых кислот, частично гидролизованы в водном растворе, который поэтому обладает щелочной реакцией. Фенолы можно выделить из фенолятов подкислением даже такими слабыми кислотами как угольная: C6H5ONa + H2O + CO2 = C6H5OH + NaHCO3 2. Реакции электрофильного замещения в бензольном кольце а) При взаимодействии с бромной водой образуется 2, 4, 6, - трибромфенол, так как кислород гидроксигруппы сопрягается с двойной связью бензольного кольца и в орто- и пара- положениях увеличивается электроотрицательность. Наблюдается обесцвечивание бромной воды и выпадение белого творожистого осадка( качественная реакция). 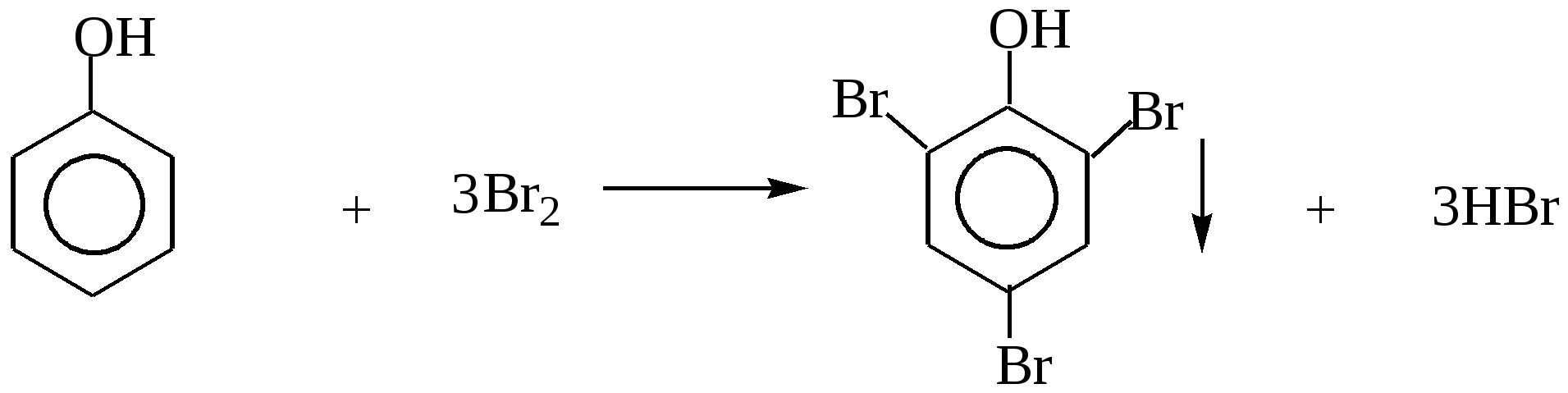 б) При нитровании фенола концентрированной азотной кислотой образуется 2,4,6-тринитрофенол(пикриновая кислота). Благодаря наличию трёх групп –NO2 связь О-Н ещё больше поляризуется и кислотные свойства усиливаются.  2,4,6-тринитрофенол При нитровании фенола разбавленной азотной кислотой образуется смесь ортонитрофенола и паранитрофенола. 3. Окислительно-восстановительные реакции а) Окисление Фенолы( особеннои многоатомные фенолы) легко окисляются, давая многообразные продукты окисления. Лёгкая окисляемость позволяет использовать их в качестве антиоксидантов. Антиокислительные свойства фенолов связаны с их способностью реагировать с пероксидными радикалами RO2• , ведущими цепь окисления, с образованием в результате этого малоактивных радикалов, не способных продолжать окисление: 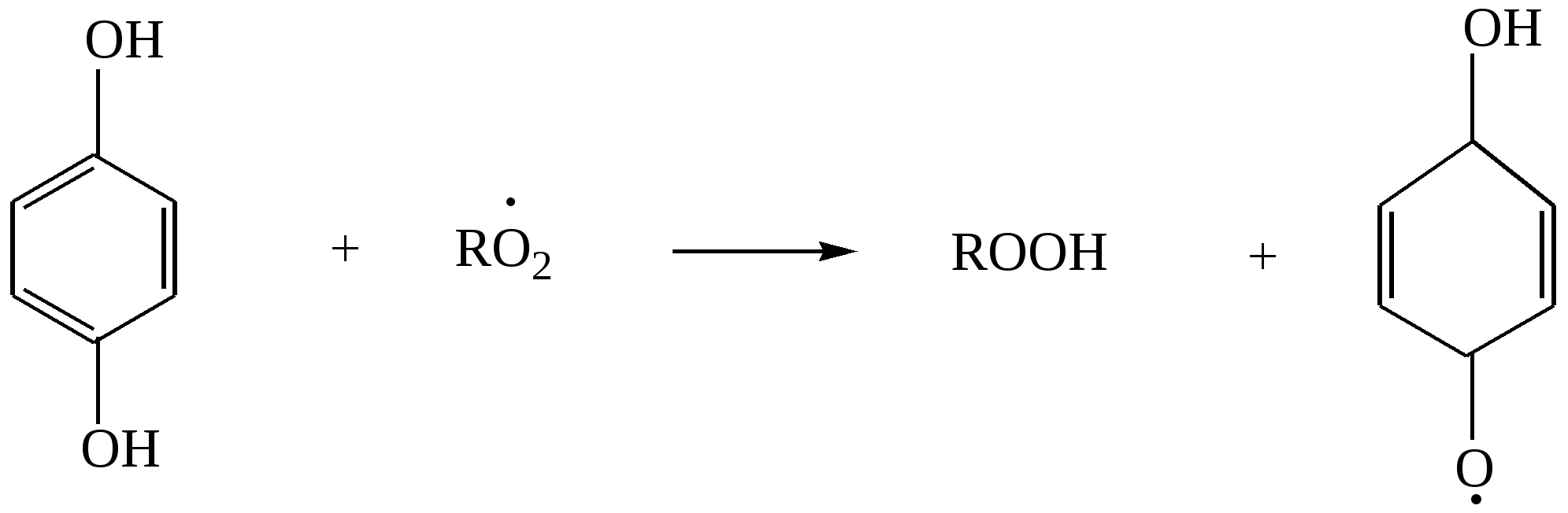 гидрохинон пероксидный радикал гидрохинон пероксидный радикал 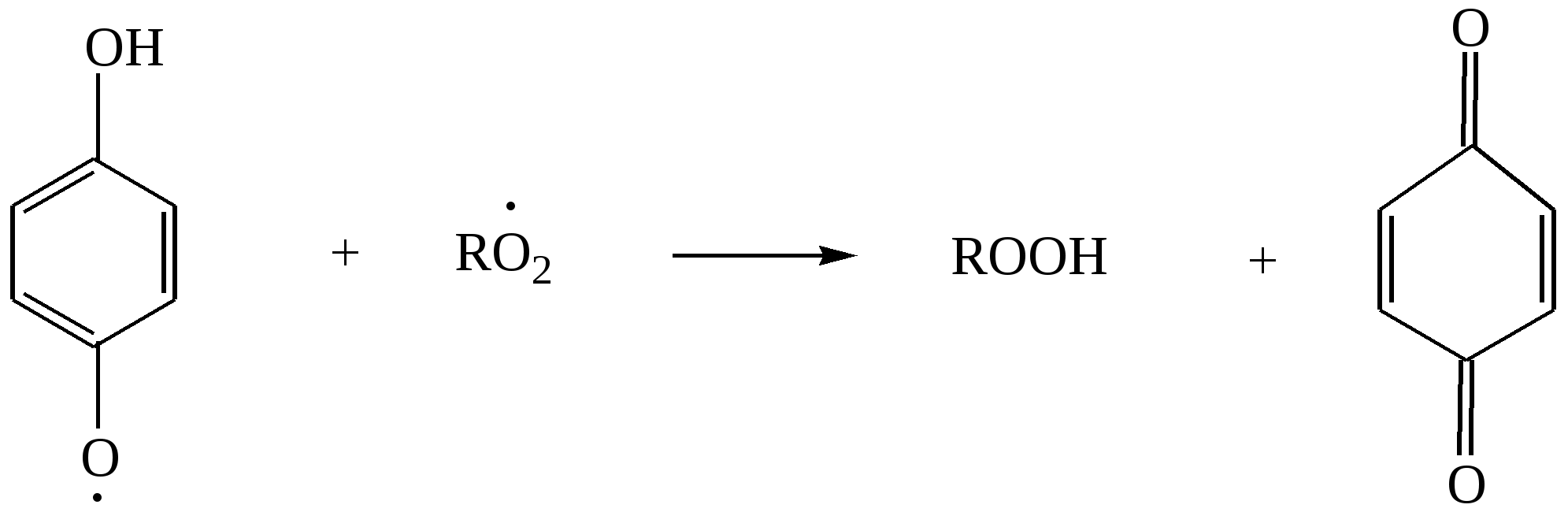 хинон б) Восстановление Ni, 150oC C6H5OH + 3H2 При действии Li[AlH4] при 350оС фенол восстанавливается в бензол Li[AlH4], 350oC C6H5OH 4. Реакции комплексообразования В водных растворах фенол взаимодействует с FeCl3 с образованием комплексных соединений. C6H5OH + H2O + Fe3+ Эта реакция также является качественной реакцией на фенол. 9.3. Примеры решения задач Пример 28 При обработке смеси фенола с этанолом избытком металлического натрия выделилось 0,672 л(н.у.) водорода. При обработке такой массы смеси избытком бромной воды образовался осадок массой 6,62г. Определить массовые доли фенола и этанола в смеси. Решение: 1) Запишем уравнения реакций: а)2C6H5OH + 2Na б)C2H5OH + 2Na С бромом реагирует только фенол: в) C6H5OH + 3Br2 2) Определяем количество вещества полученного 2,4,6-трибромфенола: n(C6H5Br3OH) = m(C6H5Br3OH) / M(C6H5Br3OH) = 6.62 / 331 = 0,02 моль 3) Определяем количество вещества фенола. Из уравнения реакции а) следует, что n(C6H5OH) = n(C6H5Br3OH) = 0,02 моль 4) Масса фенола в смеси: m(C6H5OH) = n(C6H5OH)∙ M(C6H5OH) = 0,02· 94 = 1,88 г 5) При взаимодействии смеси с натрием выделяется 0,672 / 22,4 = 0,03 моль водорода На долю фенола приходится 0,02/ 2 = 0,01 моль водорода Тогда на долю спирта : 0,03 – 0,01 = 0,02 моль. 6) Следовательно, в соответствии с уравнением б) n(C2H5OH) = 0.02· 2 = 0.04 моль Масса спирта: m(этанола) =0,04 ·46 = 1,84 г Масса смеси: m(смеси)= 1,88 + 1,84 = 3,72г 7) Массовые доли компонентов смеси: ω((С2Н5ОН) = 1,84 / 3,72 = 0,495 = 49,5% ω((С6Н5ОН) = 1,88 / 3,72 = 0,505 = 50,5% Ответ:: ω((С2Н5ОН) = 49,5%; ω((С6Н5ОН) = 50,5% 9.4. Задачи и упражнения для самостоятельного решения294. Напишите структурные формулы следующих веществ: а) 3-этилгептан; 2, 3- диметилпентен-1 б) 2- метилбутанол-2; 2, 3- диметилпентадиол-1,2. в) 2,3-диметилфенол; 2-метил, 4-этилфенол г) изомерных фенолов состава С7Н8О д) ароматических спиртов состава С8Н10О е) м-хлорфенол; 2,4-динитрофенол; 2,4,6-трибромфенол; п-гидроксибензиловый спирт. 295. Почему фенол проявляет в большей степени кислотные свойства, чем алифатические спирты? Какой реакцией это можно подтвердить? 296. В чем причина большей реакционной способности бензольного ядра у фенола по сравнению с ароматическими углеводородами? Какой реакцией это можно подтвердить? 297. С какими из указанных веществ будет реагировать фенол: гидроксид калия, металлический натрий, гидрокарбонат натрия, азотная кислота. 298. Идентифицируйте следующие вещества. а) пропен; б) фенол; в) пропин. Напишите соответствующие уравнения реакций. Что наблюдается? 299. Составьте уравнения реакций идущие по схеме: карбид алюминия изопропил бензол 300. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: а) карбид алюминия б) карбид кальция 301. Вычислите массу фенола, полученного из метана объемом 13,44л(н.у), если выход продукта реакции составляет 100%. 302. Какая масса хлорбензола была израсходована для образования 4,7 г фенола? 303. Какая масса фенолята натрия может быть получена при взаимодействии фенола массой 4,7г с раствором гидроксида натрия, содержащим 2,4г. гидроксида натрия. 304. Сколько килограммов фенола можно получить из фенолята калия массой 10 кг? Какой объём раствора серной кислоты с плотностью 1,8 г/мл и массовой долей 90% при этом израсходуется? 305. Определите массовую долю веществ в растворе полученном при взаимодействии 94 г фенола с 7 мл раствора гидроксида натрия ( плотность 1,43 г/мл) и массовой долей NaOH ω= 40%. 306. Для полной нейтрализации раствора фенола в уксусной кислоте массой 214 г потребовалось 1500 мл раствора гидроксида натрия с концентрацией 2моль/л. Определите массовую долю фенола в исходном растворе. 307. При бромировании фенола массой 28,2г получили осадок массой 79,44г. Вычислите выход продукта реакции. 308. При взаимодействии раствора фенола в бензоле массой 200 г с избытком бромной воды получили бромпроизводное массой 66,2г. Рассчитайте массовую долю фенола в растворе. 309. При обработке некоторого количества раствора фенола в этаноле натрием выделилось 2,24 л(н.у.) газа, а при взаимодействии такого же количества исходной смеси с бромной водой выпало 33,1 г осадка Рассчитайте массовую долю фенола в растворе. 310. Рассчитайте массу фенолята натрия, которую можно получить при смешении 100 г 10% раствора гидроксида натрия и 188 г 5% раствора фенола. 311. К 200 г водного раствора фенола с массовой долей 5% добавили гидроксид натрия. Вычислите массовую долю фенолята натрия в образовавшемся растворе, учитывая, что исходные вещества прореагировали полностью 312. При действии на смесь массой 31.41г, состоящей из фенола и 2-хлорэтанола металлическим натрием выделился водород, в количестве, необходимом для восстановления оксида меди (II) массой 14,4г. Вычислите массовые доли веществ в исходной смеси. 313. Какой объем 9,4% раствора фенола в этаноле (мг/мл) должен прореагировать с избытком металлического натрия, чтобы выделившимся водородом можно полностью каталитически прогидрировать ацетилен объемом 11,59л (н.у). 314. Какой объём азотной кислоты (плотность 1,4 г/мл) с массовой долей HNO3 68% вступит в реакцию с фенолом для получения 2,4,6-тринитрофенола массой 22,9 г? 315. При нейтрализации 100г раствора фенола в воде потребовалось 25 мл раствора КОН с массовой долей 40% и плотностью 1,4 г/мл. Рассчитайте массу 1% раствора брома, которую необходимо добавить к исходному раствору фенола такой же массы, чтобы весь фенол перевести в осадок. |
