В. Н. Сайтаниди Рецензент членкорреспондент расхн в. Ф. Красота Петухов В. Л. и др. П31 Ветеринарная генетика В. Л. Петухов, А. И. Жигачев, Г. А. Назарова. 2е изд., перераб и доп. М. Колос, 1996. 384 с ил. Учебники
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
|
Соматическая гибридизация. Одним из важных направлений клеточной инженерии является гибридизация соматических клеток. Сущность ее заключается в соединении клеток с хромосомными наборами систематически далеких форм. Впервые гибриды соматических клеток обнаружил в I960 г. французский биолог Ж. Барский. В культуре ткани клеток двух линий мышей он выявил третий тип клеток. Клетки эти оказались гибридными. Они содержали хромосомы клеток обеих исходных линий. Морфологические и биохимические признаки гибридных клеток были промежуточными между признаками исходных. Однако спонтанное слияние клеток наблюдается редко. В связи с этим разработана техника гибридизации соматических клеток с использованием вируса Сендай. Вирус инактивируют ультрафиолетовыми лучами или алкилирующим мутагеном. Инактивированный вирус вносят в смешанную культуру двух типов клеток. Некоторые клетки при этом сливаются с образованием одной с двумя ядрами. После митотического деления из двухъядерной клетки формируются две одноядерные гибридные соматические клетки. В каждой гибридной клетке содержится по одному набору хромосом каждого типа родительских клеток. При помощи вируса Сендай к настоящему времени получены гибриды клеток многих далеких видов (мыши и курицы, мула и мыши, кролика и обезьяны, человека и курицы, коровы и норки и др.). Гибридные клетки могут размножаться в течение длительного времени, но межвидовая несовместимость имеет место и при соматической гибридизации. Так, в культуре клеток с течением времени образуются клоны, которые почти совсем или совсем утрачивают хромосомы второго вида. Это явление открывает возможности для изучения локализации и характера действия тех или иных генов. Можно изучить клеточный клон, в котором сохранилась только одна хромосома другого вида, и по наличию или отсутствию в клетке определенных соединений решить вопрос, имеется ли в той или иной хромосоме определенный ген. Можно установить, какой, например, фермент прекращает вырабатывать клетка при утрате той или иной хромосомы. На этом основании можно 111  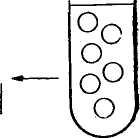 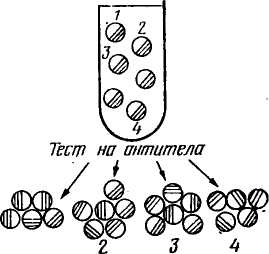 Антиген 7. 3 Антигенная детерминанта (зпнтоп) Лимфоциты клешни мивламы ГГФГ Слияние д полиэтилен -гликоле -У Среда ГАТ ОтВор гибридных клеток *€> Антиген АнтисыЬаротка Клон! Анти- 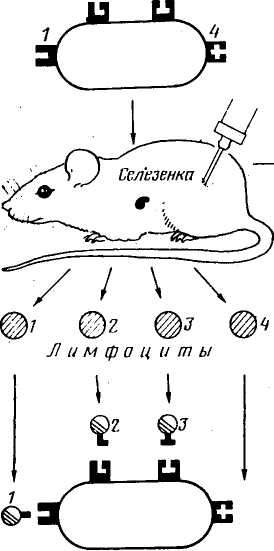 определить, что ген, кодирующий данный фермент, сцеплен с ушедшей хромосомой. Таким путем была определена локализация многих генов в определенных хромосомах человека. определить, что ген, кодирующий данный фермент, сцеплен с ушедшей хромосомой. Таким путем была определена локализация многих генов в определенных хромосомах человека. Соматическая гибридизация может быть использована для картирования хромосом, а также для изучения регуляции действия генов, дифференцировки клеток в онтогенезе и механизма взаимодействия ядра и цитоплазмы. ГИБРИДОМНАЯ ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ Введение антигена (бактерий, вирусов и т. д.) вызывает образование разнообразных антител против многих детерминант антигена. В 1975 г. Г. Кёлер и К. Мильштейн (лауреаты Нобелевской премии) получили моноклональные антитела с помощью гибридомной технологии. Моноклональные антитела — это иммуноглобулины, синтезируемый одним клоном клеток. Моноклональное антитело связывается только с одной антигенной детерминантой на молекуле антигена. Гибридомная технология — слияние с помощью полиэтиленгли-коля лимфоцитов селезенки предварительно иммунизированных организмов определенным антигеном с миеломными (раковыми) клетками, способными к бесконечной пролиферации (делению). Гибридные клетки селекционируют в среде ГАТ (среда, содержащая гипоксантин, аминоптерин и тимидин). Неслившиеся лимфоциты погибают в любой тканевой культуре. Миеломные клетки на этой среде также погибают, так как они были дефектны по ГГФТ (гипоксантин-гуанозин-фосфорибозилтрансферазе). Отбирают клоны клеток, синтезирующие необходимые антитела (рис. 28). Нужные клоны можно хранить в замороженном состоянии. Таким образом, гибридомы представляют собой бессмертные клоны клеток, синтезирующие моноклональные антитела. Получение и использование моноклональных антител — одно из существенных достижений современной иммунологии. С их помощью можно определить любое иммуногенное вещество. В медицине меченные изотопами или иным способом моноклональные антитела можно использовать для диагностики рака и определения локализации опухоли, для диагностики инфаркта миокарда. Получены моноклональные антитела к различным возбудителям: малярии, трипаносомозу, лейшманиозу, токсо-плазмозу и др. Ученые считают, что в самом ближайшем будущем моноклональные антитела займут доминирующее положение в диагностике болезней. Для использования в терапии моноклональные антитела можно соединять с лекарством (например, с токсическими веществами) благодаря специфичности антител они доносят это вещество непосредственно к раковым клеткам 112 Отбор Вариантов и размножение желательных* клинад(1,4) | Выращивание \ в массовой культуре Смешанные антитела Манокланалыные антитела Рис. 28. Получение моноклональных антител (по Милыптейну, 1982) или патогенным микроорганизмам, что позволяет значительно повысить эффективность лечения. Можно использовать моноклональные антитела (против Н — Y-антигена) для определения пола у крупного рогатого скота на предимплантационной стадии развития, а также для стандартизации методов типирования тка- 113 ней при трансплантации органов, при изучении клеточных мембран (так были изучены антигены Т-лимфощггов), для построения антигенных карт вирусов, возбудителей болезней. ЭМБРИОГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ Эмбриогенетическая инженерия — это активная перестройка генома животных путем вмешательства в их развитие на самых ранних стадиях онтогенеза. Перестройка генома — это реконструкция эмбрионов путем клонирования, слияния или непосредственной инъекции в их ядра чужеродной ДНК. Однако получение эмбриональных клонов, химер или трансгенных животных возможно лишь в результате успешной трансплантации реконструированного эмбриона. Трансплантация — метод ускоренного воспроизводства высокопродуктивных животных путем получения и переноса одного или нескольких эмбрионов от высокоценных животных (доноров) менее ценным животным (реципиентам). Использование трансплантации позволяет получать от одной генетически ценной самки в десятки раз больше потомства. Технология трансплантации опирается на крупные достижения в области биологии размножения животных и включает следующие приемы: 1) гормональное вызывание суперовуляции; 2) осеменение доноров семенем производителей, оцененных по качеству потомства; 3) извлечение и оценку качества эмбрионов, сохранение и пересадку или криоконсервирование эмбрионов в жидком азоте, оттаивание и пересадку. Трансплантацию эмбрионов применяют для следующих целей:
5) выявления вредных рецессивных генов и хромосомных аномалий; 114
КЛОНИРОВАНИЕ ЭМБРИОНОВ МЛЕКОПИТАЮЩИХ Истинные клоны позвоночных животных — амфибий были получены путем пересадки ядер соматических клеток в энуклеи-рованные яйцеклетки. Получение эмбриональных клонов основано на свойстве тотипотентности эмбриональных клеток. В 1952 г. Р. Бриггс и Т. Кинг разработали метод пересадки ядер соматических клеток зародышей в энуклеированные яйцеклетки лягушек. Дж. Гёрдон в 1962 г. усовершенствовал технику пересадки. Он разрушал ядра яйцеклеток лягушки ультрафиолетовыми лучами, затем в каждое из яиц вводил ядро из дифференцированной клетки кишечного эпителия плавающего головастика (рис. 29). В ряде случаев такие ядра вызывали развитие генетически идентичных эмбрионов и взрослых лягушек. Впервые были получены истинные клоны позвоночных животных. Затем был использован метод культивирования in vitro клеток кожи взрослых лягушек. Пересадка ядер из таких клеток привела к получению генетических клонов головастиков, но вероятность успеха при трансплантации ядер из клеток кожи взрослых лягушек очень мала. При использовании ядер соматических клеток взрослых животных развитие клонов ограничивалось стадией головастиков. Ядра взрослых организмов и даже поздних эмбрионов по каким-то причинам утрачивают свои потенции. В последние годы установлено, что в ядрах эритроцитов взрослых амфибий имеются гены, контролирующие развитие эмбриона до .стадии головастика, включение таких ядер в цитоплазму ооцитов ведет к реактивации репрессированных участков генома. В последние 10 лет разработан метод пересадки ядер, сочетающий приемы микрохирургии и технику слияния клеточных фрагментов, начато проведение опытов по трансплантации ядер у овец и крупного рогатого скота. Несмотря на сложность проведения работ по трансплантации ядер соматических клеток в энуклеированную зиготу, проблема эта является актуальной, так как открывает возможности копи- 115 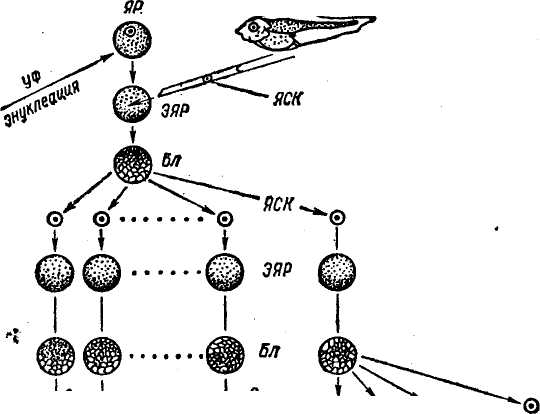   Гй ЯСК © © © яск \ \ \ 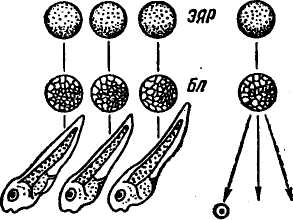 {КС 9 {КС 9 Рис. 29. Серийные ядерные пересадки (по Дж. Гёрдову): © © иксз ЯСК для ШКСЭ ЯР — яйцо-реципиент; ГД ЯСК — головастик—донор ядер соматических клеток; ЭЯР — энуклеированное яйцо-реципиент; ЯСК — ядра соматических клеток; Бл — бластула; КСЭ — клон серийных эмбрионов рования выдающихся по продуктивности животных и создания стад с высоким генетическим потенциалом. Клоны можно получить путем разделения эмбрионов на ранней стадии развития. Установлено, что, если количество клеток эмбриона (бластомеров) не превышает 16, они еще не дифференцированы. Это позволяет разъединять эмбрионы (бластулы) на 2 и большее число и получать однояйцевых близнецов. К настоящему времени получены монозиготные близнецы телят, жеребят, ягнят и поросят. В перспективе предполагается, что обеспечение оптимальных условий для культиви- 116 рования ранних эмбрионов in vitro создаст возможность выращивать половинки эмбрионов с последующим неоднократным их разделением, что позволит в значительной степени увеличить число годных для трансплантации зародышей, происходящих от одного эмбриона, и получить более многочисленные клоны эмбрионов у сельскохозяйственных животных, что будет способствовать более успешной их селекции. ХИМЕРНЫЕ ЖИВОТНЫЕ Одно из перспективных направлений биотехнологии — искусственное получение химер (аллофенных животных). Понятие химера означает составное животное. Сущность метода получения химер заключается в искусственном объединении эмбриональных клеток двух и более животных. Животные могут быть как одной породы, так и разных пород и даже разных видов. Современная микрохирургия позволяет получать химер, имеющих 3—4 и более родителей. Химеры обладают признаками животных разных генотипов. Существует два основных метода получения химер искусственным путем: 1) агрегационный — объединение двух и более морул или бластоцист в один эмбрион; 2) инъекционный — микроинъекция клеток внутриклеточной массы (ВКМ) бластоцисты доноров в бластоцель эмбриона-реципиента. В обоих случаях получают особей, ткани и органы которых построены из клонов клеток объединенных (двух или более) эмбрионов (рис. 30). Первыми созданы химеры лабораторных мышей между линиями агути (кремовые) и не агути (черные). Они выглядели крапчатыми. Их окраска сочетала признаки обоих родителей: полосы пигментированной шерсти чередовались со светлыми, каждая полоса представляла клон клетки-родоначальницы. Их использование помогает изучению фундаментальных проблем дифференцировки клеток в процессе онтогенеза, многих вопросов механизма клеточного развития и происхождения отдельных тканей, иммунологического взаимодействия в развитии и т. д. В настоящее время имеются внутривидовые и межвидовые химеры не только лабораторных животных (мышей, хомяков, крыс), но и сельскохозяйственных животных (коров, коз, овец). Изучение химер позволит понять процесс реализации генома в фенотипе животных. В Великобритании и ФРГ были получены межвидовые химеры между овцой (2п = 54) и козой (2п = 60), названные овцекозами. В крови химер обнаружены красные кровяные тельца и овцы, и козы. Их шерсть представляла собой рмесь волос того и другого вида. Экстерьер соответствовал одному из родителей. Интересным является факт рождения ягненка от козы и козленка от овцы. В США в 1987 г. были получены химеры овец и коз и химеры овцы между породами рамбулье и 117 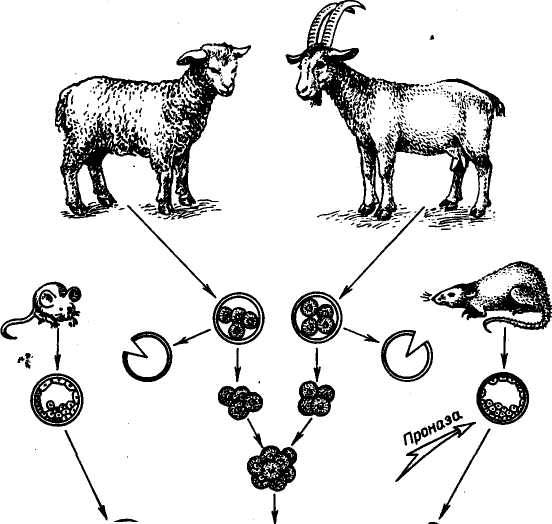 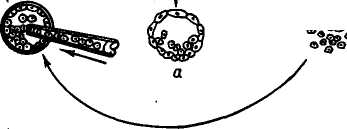 Среда ^ое без Са Мд Рис. 30. Два способа получения генетических химер: а— по Тарковскому-Минцу; б— по Гарднеру финский ландрас. В нашей стране получен химерный бычок от животных черно-пестрой и красной пород. Он в фенотипе сочетал черно-пеструю масть с красными пятнами (Л. К. Эрнст, 1987). Приведенные материалы свидетельствуют о возможности получения химер (генетических мозаиков) в животноводстве. Однако в потомстве химерных животных не сохраняется родительский генотип, происходит расщепление и нарушаются ценные генетические комбинации. Несмотря на это, предполагается, что при усовершенствовании методов получения химер они могут представлять большой 118 интерес для практики животноводства. Таким путем можно получить животных с более высокой резистентностью к ряду болезней и с признаками, которые обычно плохо сочетаются в одном организме. ТРАНСГЕННЫЕ ЖИВОТНЫЕ Трансгеноз — экспериментальный перенос генов, выделенных из определенного генома или искусственно синтезированных, в другой геном. Животные, в геном которых интегрируют чужеродные гены, называют трансгенными. В ряде экспериментов было установлено, что мыши, развивающиеся из зиготы, в которую была введена чужеродная ДНК, содержат в своем геноме фрагменты этой ДНК, а иногда у них происходит и экспрессия чужеродных генов. В 1980 г. Дж. Гордон с сотр. впервые показали возможность трансформации мыши путем введения в пронук-леус оплодотворенной яйцеклетки мыши рекомбинантных молекул, содержащих ген тимидинкиназы (ген ТК) вируса герпеса. Лучшие результаты были получены при Микроинъекции реком-бинантной ДНК в мужской более крупный пронуклеус. Метод микроинъекции чужеродной ДНК в мужской пронуклеус зиготы используется в настоящее время у всех млекопитающих, включая сельскохозяйственных животных. Созданы линии трансгенных мышей, хоторые различались между собой структурой чужеродной ДНК. Мышам были введены гены: гемоглобина кролика, Р-глобина человека, лейкоцитарного интерферона человека, гормона роста крысы и человека. Особого внимания заслуживает опыт Пальмитера и сотр., в котором осуществлена пересадка мышам гена гормона роста крысы. В этом случае промотор бактерий был непригоден. Для микроинъекции была создана рекомбинантная ДНК, состоящая из соединенных фрагментов различных генов: промоторной части гена — металлотионеина МТ-1 мыши и структурной части — гена гормона роста крысы, в котором собственные промотор и инициатор были удалены. В зиготы мыши инъецировали по 600 копий рекомбинантной ДНК. Получен 21 потомок. У семи мышей был обнаружен чужеродный ген — ген гормона роста крысы. Живая масса трансгенных мышат была в 1,8 раза больше, чем контрольных. Таких трансгенных животных назвали супермышами. В среднем у трансгенных мышей интегрируется 25—30 % копий введенной ДНК. Успешные опыты с мышами способствовали проведению работ по получению трансгенных кроликов и сельскохозяйственных животных. Схема получения трансгенных животных в основном такая же, как и при работе с мышами. Она состоит из следующих этапов: 1) выбор, получение и клонирование чужеродного гена; 2) получение зигот и выявление пронуклеусов; 3) 119 микроинъекция определенного числа копий генов в видимый пронуклеус; 4) трансплантация зиготы в половые пути гормонально подготовленной самки; 5) оценка родившихся животных по генотипу и фенотипу: интеграция чужеродной ДНК, экспрессия ДНК, влияние на признак (например, высокая интенсивность роста), установление наследования гена. Наиболее трудной проблемой в опытах по переносу генов в ткани или организмы животных оказалась экспрессия внесенных генов. Выяснилось, что только четыре промотора (генов метал-лотионеина, трансферрина, иммуноглобулина, эластазы) из многих исследованных способны активировать присоединенные к ним гены. Трансгенные кролики были получены Р. Хаммером и Г. Бре-мом с сотр. Они производили микроинъекцию в пронуклеусы кроликов гена гормона роста человека. В нашей стране в отделе биотехнологии ВИЖа получена трансгенная крольчиха с интеграцией и экспрессией гена гормона роста крупного рогатого скота (Ц. К. Эрнст и др., 1990). В Австралии получили первых в мире трансгенных овец. В возрасте 2—4 лет трансгенные овцы в 1,5 раза превосходили по массе сверстников той же породы. Австралийские ученые предполагают ввести овцам и другие гены, которые должны привести к ускорению роста шерсти, усилению резистентности к болезням. Трансгенные свиньи впервые были получены в лабораториях Р. Хаммера (1985) и Г. Брема (1986) на основе инъекции гормона роста человека. У некоторых таких свиней в плазме крови отмечался высокий уровень гормона роста человека. В нашей стране получены трансгенные свиньи на основе инъекции в зиготы гена гормона роста крупного рогатого скота. При работе с крупным рогатым скотом, для того чтобы обнаружить пронуклеусы, применяют ДНК-специфические флуоресцентные окраски и центрифугирование зигот. В 1987 г. родился первый трансгенный теленок молочно-мясного типа. В порядке совершенствования процесса трансгеноза разрабатывается метод оплодотворения яйцеклеток in vitro с помощью микроинъекции одного сперматозоида с включенной в него чужеродной ДНК. В перспективе предполагается получение трансгенных животных для производства новых продуктов, которые можно будет производить в промышленном масштабе, если они будут полезны с медицинской точки зрения. С этой целью будет использоваться рекомбинантная ДНК, с помощью которой от трансгенных животных будут получать, например, из коровьего молока, крови или печени такие белки, как инсулин человека, интерферон и гормоны. Разрабатывается биотехнология производства фактора свертывания крови из молока трансгенных овец. Пред- 120 •полагается, что фактор свертываемости, необходимый для лечения гемофилии, будет синтезироваться в клетках молочной железы овец и переходить в молоко. Внедрение современных биотехнологий — гибридизации соматических клеток, клеточной и генной инженерии в сочетании с эмбриогенетической инженерией — определяет новые подходы в деле создания более устойчивых к болезням высокопродуктивных пород животных с признаками, которых не было у исходных пород или они были слабовыражены. Открываются новые перспективы для получения лекарственных веществ: гормонов, вакцин, аминокислот, витаминов и т. д. Синтез генов и совершенствование методов их введения позволяют ввести в клетку на место поврежденных генов нормальные гомологи, что обеспечит лечение наследственных болезней. Широкое распространение получат способы нейтрализации действия вредных генов с помощью введения репрессоров. |
