В. Н. Сайтаниди Рецензент членкорреспондент расхн в. Ф. Красота Петухов В. Л. и др. П31 Ветеринарная генетика В. Л. Петухов, А. И. Жигачев, Г. А. Назарова. 2е изд., перераб и доп. М. Колос, 1996. 384 с ил. Учебники
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
|
Глава 11 ГЕНЕТИЧЕСКИЕ ОСНОВЫ ОНТОГЕНЕЗА Онтогенез — непрерывный процесс количественных и качественных изменений, происходящих в организме в течение всей жизни при постоянном взаимодействии генотипа и условий среды. Термины «онтогенез» и «филогенез» ввел в биологию немецкий зоолог Е. Геккель. Он же сформулировал и обосновал (1866) биогенетический закон. Термин «онтогенез* означает процесс индивидуального развития особи, «филогенез* — история развития вида. Согласно биогенетическому закону индивидуальное развитие особи (онтогенез) является как бы кратким повторением (рекапитуляцией) филогенеза. А. Н. Северцов считает, что под филогенезом следует понимать ряд исторически отобранных онтогенезов. Филогенез реализуется в онтогенезе через наследственность, составляет основу онтогенеза и направляет онтогенез по пути, пройденному предками. В зиготе (оплодотворенной яйцеклетке) содержится записанная в структуре молекул ДНК генетическая информация о развитии будущего организма. В процессе онтогенеза происходит реализация генетической информации в определенных условиях среды. Онтогенез животных включает два основных взаимосвязанных процесса — рост и развитие. Под ростом понимают процесс увеличения размеров организма, его массы, происходящий за счет накопления в нем активных, главным образом белковых, веществ. В основе роста лежит увеличение числа и размеров клеток и неклеточных образований. Под развитием понимают качественные изменения — процессы усложнения структуры организма, специализацию, дифференциацию и интеграцию его органов и тканей. Одна из основных проблем биологии — выяснение вопроса: каким образом из одной-единственной клетки возникает множество разнообразных типов клеток, значительно различающихся между собой строением, функцией, и как в процессе онтогенеза идет становление признаков и свойств организма? Проблема изучения механизма генетического контроля онтогенеза имеет не только теоретическое, но и практическое значение для успешного решения таких вопросов, как селекция животных и растений, профилактика и лечение генетически обусловленных болезней у животных и человека. 178 РАСКРЫТИЕ СЛОЖНОЙ СТРУКТУРЫ ГЕНА В соответствии с представлениями классической генетики долгое время считалось, что ген — неделимая единица функции, рекомбинации и мутирования. Гены представлялись как бусинки, механически соединенные каким-то материалом в хромосоме. Вопрос о пересмотре представлений о гене как неделимой единице впервые был поставлен в 1929—1930 гг. А. С. Серебров-ским с сотр. Они изучили мутации гена scute (скьют), влияющего на развитие щетинок на теле дрозофилы, и обнаружили явление ступенчатого аллелизма. Было выявлено 14 мутаций гена scute: SCi, SC2, SC3 и т. д. Мутации отличались друг от друга редукцией щетинок на определенных участках тела: в одном случае не было щетинок на голове и предгруди, в другом — на предгруди и груди и т. д. Мы уже знаем, что при скрещивании особей с разными аллельными генами у потомков имеет место доминирование одного из них. В случае же серии аллелей гена scute у гетерозиготных особей был обнаружен частичный возврат к норме. У гетерозиготных потомков не развивались только те щетинки, которых не было у обоих родителей. Щетинки развивались нормально, если изменение наблюдалось только в одном из аллельных генов. Если, например, мутация SQ вызывала редукцию щетинок ABC, а мутация SC2 — редукцию щетинок BCD, то у гетерозиготы отсутствовали щетинки В и С и развивались нормально А и D. При графическом изображении взаимодействия несколько пар аллеломорфов получается как бы лестница, ступенями которой служат отдельные аллели гена scute (скьют): SCi — ABC; SC2 — BCD; SC3 — CDE. Это явление получило название ступенчатого аллеломорфизма. Было показано, что ген не является единицей мутации, он дробим и имеет сложную структуру. На основании проведенных исследований была сформулирована центровая теория гена. Согласно ей ген состоит из отдельных функциональных участков — центров, которые могут независимо изменяться при мутациях. Глубокие исследования тонкой структуры генов фага Т4, поражающего кишечную палочку, были проведены американским генетиком С. Бензером. Дикий тип фага Т4 лизирует разные штаммы кишечной палочки, в том числе штаммы В и К. При этом в бактериальных культурах наблюдается появление мелких стерильных пятен. При посеве фага на штамм В были обнаружены и отобраны мутанты фага, названные rll (г — от англ. rapid, lysis — быстрый лизис), образующие крупные стерильные пятна (по сравнению с фагом дикого типа) и не способные размножаться на штамме К (не образуют стерильных пятен). Для анализа выявленных мутантов С. Бензер разработал тест на компле-ментарность, который заключается в следующем: если бактерии 179 штамма К заразить смесью двух разных мутантов rll и это не приведет к лизису клеток штамма К, значит,- мутации у обоих фагов затрагивают одну и ту же функцию и произошли в одном и том же гене. Если же при совместном заражении восстанавливается дикий тип, т. е. произойдет лизис клеток штамма К, значит, мутации комплементарны и произошли в разных генах. С. Бензер исследовал попарно очень большое число мутантов rll и установил, что они принадлежат к двум функциональным группам: А и В. Любой из мутантов группы А комплементарен любому из мутантов группы В, в то же время два мутанта, относящиеся к одной и той же группе А или В, некомплементарны, они затрагивают одну и ту же функциональную единицу, и в этом случае сохраняется мутантный фенотип. Наличие двух классов мутантов привело к выводу о существовании двух функциональных единиц в пределах rll генома фага Тф Каждая из этих единиц связана, очевидно, с синтезом специфического полипЙЬтида, необходимого для роста на штамме К. Генетическая единица функции, выявленная с помощью теста на компле-ментарность, была С. Бензером названа цистроном. В настоящее время термин «цистрон» используется как синоним гена. Геном называется участок молекулы ДНК (у некоторых вирусов РНК), кодирующий первичную структуру полипептида, молекулы транспортной или рибосомной РНК или взаимодействующий с регу-ляторным белком. Структурной единицей мутации и рекомбинации гена является одна пара нуклеотидов (или один нуклеотид в случае геномов, состоящих из одноцепочных ДНК или РНК). Для обозначения локализации мутаций в пределах гена применяется термин «сайт». Сайт может включать одну пару нуклеотидов, а в некоторых случаях, возможно, и больше. Размер генов в разных организмах различен, однако в среднем ген включает 1500 пар нуклеотидов. Самые короткие — гены, кодирующие тРНК. Они включают приблизительно 190 пар нуклеотидов. Но имеются и очень длинные гены. Например, ген фиброина шелка тутового шелкопряда включает 16 тыс. пар нуклеотидов. Таким образом, ген — очень сложная структура. Установлено, что молекулярное строение генов эукариот отличается от генов прокариот. У последних гены представляют собой непрерывную последовательность триплетов, обеспечивающих кодирование колинеарной последовательности аминокислот в определенной полипептидной цепи. У эукариот многие гены имеют мозаичную структуру. Оказалось, что они составлены из кодирующих участков — экзонов, разделенных некодирующими участками — интронами. Например, в генах тяжелой цепи иммуноглобулинов не менее пяти экзонов и четырех интронов, в гене овальбумина (яичного белка) восемь экзонов и семь интронов. 180 В последние годы у прокариот обнаружены перекрывающиеся гены. Так, у некоторых РНК-содержащих бактериофагов Е. coli (R17 и др.) считались установленными три гена — репликазы, белка оболочки и созревания вирусной частицы. Однако был обнаружен четвертый ген, кодирующий белок L, включающий 75 аминокислотных остатков и блокирующий лизис зараженной клетки. Места для этого гена на РНК не было. Слева у гена обнаружили кодон-инициатор (АУГ), а справа — терминатор (УАА). Между ними расположено 75 триплетов. Оказалось, что ген локализован частично в гене белка оболочки (47 нуклеотидов), 36 нуклеотидов — в межгенном интервале и 142 нуклео-тида расположены в гене РНК — репликазы. Перекрывающиеся гены обнаружены также в некоторых одноцепочных ДНК фагов Е. coli и в ДНК вируса млекопитающих SV 40. Таким образом, используются одни и те же последовательности нуклеотидов для кодирования разных белков. В конце 40-х годов XX в. Б. Мак-Клинток на основе генетических экспериментов на кукурузе предсказала наличие в геноме организмов подвижных элементов — «прыгающих» генов. В конце 60-х годов у бактерий обнаружено два основных класса мобильных («прыгающих») генов, которые различались по длине и сложности организации: 1-й — инсерционные последовательности, или lS-элементы. Длина их около 1000 пар нуклеотидов. Они содержат только один ген, ответственный за их перемещение; 2-й — транспозоны с длиной 3000—20 000 пар нуклеотидов. Транспозоны кроме системы транспозиции содержат дополнительные гены, определяющие устойчивость к антибиотикам, различным токсическим соединениям. В 70-х годах изучены мобильные гены у дрозофилы, затем было выявлено, что у эукариот они составляют не менее 5—10 % их генетического материала. Мобильные гены вносят в геном факторы нестабильности и изменчивости, что может играть, по-видимому, существенную роль в эволюции. ВЛИЯНИЕ ГЕНОВ НА РАЗВИТИЕ ПРИЗНАКОВ Проявление действия генов на биохимическом уровне начали изучать в 1935 г. Билл и Эфрусси с исследований двух рецессивных мутаций окраски глаз у дрозофилы по генам vermilion (яркие глаза) и cinnabar (киноварные глаза). У особей, гомозиготных по этим генам, не образуется пигмент, определяющий нормальную окраску глаз. В результате глаза отличаются от особей дикого типа. Сложные глаза дрозофилы развиваются из зачатка или диска, образование которого происходит на стадии личинки. Глазной имагинальный диск можно пересадить в полость тела другой личинки, где он продолжит свое развитие. Билл и Эфрусси произвели имплантацию эмбриональной ткани 181 дисков глаз из личинок мух с мутантными генами vermilion и cinnabar в личинки нормальных мух-дрозофил и установили, что после метаморфозы этих личинок в зрелых мух имплантированная ткань глаза развилась в дополнительные глаза нормальной окраски. Отсюда был сделан вывод, что в тканях мутантных мух не хватало какого-то вещества для синтеза нормальной окраски глаз. На основании опытов Билл и Эфрусси пришли к выводу, что образование пигмента идет по пути: предшественник — вещество I— вещество II—пигмент. У мутанта по гену vermilion блокирована реакция, в результате которой предшественник преобразуется в вещество I, а у мух с мутацией cinnabar блокирована реакция, в результате которой вещество I преобразуется в вещество И. В последующие годы было установлено, что вещество I (V+) является кинуренином и мутация V блокирует его образование из триптофана. Вещество II (Сп+) оказалось хромогеном — продуктом *февращения кинуренина. Мутация Сп блокировала стадию образования кинуренина хромогена — предшественника пигмента дикого типа. Исследования показали, что мутации в' генах, кодирующих определенные ферменты, ведут к блокированию биохимических реакций, нарушая превращение определенных веществ, что влияет на образование признака — окраски глаз. В 1940 г. Бидл и Татум избрали для своих исследований новый объект — гриб хлебной плесени нейроспору. У нейроспо-ры в результате последовательной цепи реакций из фенилалани-на синтезируется никотиновая кислота. Было обнаружено шесть мутаций, нарушающих нормальный ход ее синтеза. При помощи культивирования на минимальной среде и добавлении веществ, синтез которых был прерван мутацией, были установлены промежуточные продукты и порядок их образования при синтезе никотиновой кислоты: фенилаланин 1+ антраниловая кислота 2+ индол (+ серин) i> триптофан 1+ кинуренин Д. оксиантраниловая кислота \ никотиновая кислота. Генетическое блокирование может происходить на любом из шести этапов, для каждого из которых нужен определенный фермент. Если у штамма нейроспоры произошла мутация на второй стадии, то процесс синтеза заканчивался на образовании антраниловой кислоты и шел дальше, если в среду вводили индол, синтез которого был прерван мутацией. Если мутация произошла на пятой стадии, то синтез обрывался на образовании кинуренина и продолжался только при добавлении в среду окси-антраниловой кислоты. На основании полученных фактов Бидл и Татум предложили теорию: один ген — один фермент — один признак. По этой теории 182 каждый ген имеет только одну первичную функцию — определять синтез только одного фермента. Изменение в структуре гена, кодирующего определенный фермент, ведет к его выключению. Если этот фермент не участвует в последовательной цепи реакции, то синтез определенного вещества в организме приостанавливается на стадии, для которой этот фермент был необходим. При этом возникает новый признак. Впервые связь между генами и ферментами у человека обнаружил Гаррод в 1902 г. При анализе родословных больных аль-каптонурией он пришел к заключению, что эта болезнь связана с обменом веществ и передается по наследству. Однако открытие Гаррода было оценено только через много лет, когда было установлено, что целый ряд болезней у человека обусловлен наследственными пороками метаболизма. При изучении фенилаланин-тирозинового обмена у человека было выявлено несколько заболеваний, связанных с нарушением превращения фенилаланина до конечных веществ биосинтеза (рис. 38). Нарушения связаны с мутацией генов, кодирующих ферменты, принимающие участие на разных этапах метаболизма. Фенилкетонурия возникает в том случае, когда блокируется превращение фенилаланина в тирозин. Это ведет к увеличению фенилаланина в плазме крови, спинномозговой жидкости и в моче. Исследования показали, что у Т  ИРОКСИН ИРОКСИНПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ОБМЕНА ФЕНИЛ• АЛАНИН ФЕНИЛПИРО-ВИНОГРАД-НАЯ КИСЛОТА МЕЛАНИН АДРЕНАЛИН И НОРАД-РЕНАЛИН
Г  ОМОГЕНТИ- ОМОГЕНТИ-ЗИНОВАЯ КИСЛОТА с  о2 + н2о о2 + н2оРис. 38. Схема фенилаланинтирозинового обмена у человека: / — фенилкетонурня (избыток фенилаланина). 2 — альбинизм: 3— тирокетотрия; 4— аль-каптонурия (черный пигмент в моче) 183 большинства больных детей умственное развитие отстает на 70 % и более. При альбинизме потеряна способность к образованию меланина. Кретинизм возникает при нарушении в превращениях тирозина. Заболевание сопровождается задержкой развития и умственной отсталостью. Заболевание тирозинозом связано с мутацией гена, кодирующего фермент, катализирующий образование гомогентизиновой кислоты. При заболевании алькаптонурией наблюдается нарушение синтеза фермента оксидазы, что ведет к накоплению гомогентизиновой кислоты. Моча больных алькаптонурией на воздухе приобретает темную, почти черную окраску. На примере фе-нилаланинтирозинового обмена мы видим, как одно и то же исходное вещество (фенилаланин) под влиянием ферментов — продуктов разных генов, претерпевает превращения в разных направлениях, определяя в конечном итоге разные биохимические признаки. У низших организмов путь от гена до признака сравнительно короткий. У них наследственные признаки определяются "&нами, которые сосредоточены в одной клетке, и активность генов регулируется продуктами метаболизма этой же клетки. У подавляющего большинства многоклеточных организмов путь от гена до признака значительно сложнее и менее изучен. Целый ряд исследований показывает, что характер индивидуального развития высших организмов определяется взаимодействием многих генов, сложным взаимодействием ядра и цитоплазмы, взаимодействиями различных клеточных систем, обладающих активностью разных генов. ДИФФЕРЕНЦИАЛЬНАЯ АКТИВНОСТЬ ГЕНОВ НА РАЗНЫХ ЭТАПАХ ОНТОГЕНЕЗА Дифференцировка клеток — процесс, при котором во время дробления оплодотворенного яйца клетки постепенно начинают отличаться одна от другой, что приводит в конечном итоге к формированию зародыша со многими специализированными тканями. Клетки разных тканей одного и того же организма отличаются друг от друга формой, размерами и строением. В то же время клетки одинаковых тканей даже у животных разных видов имеют сходство. Это связано с тем, что каждый из типов клеток специализирован для выполнения только им свойственных функции. Например, нервные клетки приобретают способность передать нервные импульсы, железистые клетки — способность к секреции соответствующих веществ и т. д. Выяснение механизмов дифференцировки клеток — одна из главных задач современной биологии. Поскольку дифференцировка необратима, некоторые ученые в конце прошлого века считали, что в ее основе лежит неравное распределение генов в те или иные дифференцирующиеся клетки в ходе последователь- 184 ных клеточных делений. Это предположение было опровергнуто. В начале нашего века было показано, что каждая соматическая клетка имеет такой же набор хромосом, как и исходная оплодотворенная яйцеклетка. Доказательством являются специальные опыты по пересадке ядер. Дж. Гёрдон (1962) разрушал ядра яйцеклеток лягушки ультрафиолетовыми лучами и инъецировал в энуклеированные яйцеклетки ядра дифференцированных клеток кишечного эпителия плавающего головастика. Небольшой процент таких ядер обеспечивал развитие головастиков и нормальных лягушек. Опытами было показано, что ядра кишечных клеток содержат все гены, необходимые для дифференцировки всех типов клеток. В последующей работе по пересадке ядер Дж Гёрдон показал, что в течение первых десяти клеточных делений при развитии эмбриона лягушки в ядрах не наблюдается синтеза РНК. Клетки в этот период быстро делятся, реплицируют ДНК. Однако в клетках идет синтез белка. Дело в том, что у животных в период роста и созревания яйцеклетки в цитоплазме накапливается большое количество молекул РНК, которые, соединившись с белками-гистонами, образуют гранулы — информосомы. Информосомы до оплодотворения яйцеклетки находятся в неактивном состоянии. Сразу же после оплодотворения мРНК освобождается от белков-гистонов, поступает в рибосомы цитоплазмы яйцеклетки и начинается синтез определенных белков по программе материнской ДНК. Поэтому начальный период развития зиготы осуществляется под контролем генов материнского организма. С начала стадии гаструляции и в дальнейшем синтез белка осуществляется под влиянием мРНК, образующейся в ядрах клеток эмбриона, т. е. под контролем генов обеих родительских особей. На первых этапах исследований основными экспериментальными объектами были иглокожие (морские ежи) и земноводные (лягушки, саламандры), потому что у них легко получать и оплодотворять яйцеклетки и следить за ходом эмбрионального развития. Лишь в последние годы разработаны приемы, при помощи которых появилась возможность изучать ранние стадии эмбриогенеза у мышей. На рисунке 39 приведена схема изменения активности генов в раннем эмбриогенезе лягушки и мыши. Одним из примеров дифференциальной активности генов в период органогенеза может служить процесс формирования пуф-фов в гигантских хромосомах дрозофилы. Гигантские хромосомы слюнных желез являются политенными и включают до 1000 нитей. Они имеют по длине определенный рисунок. На хромосомах видны диски, которые представляют собой соединение гомологичных генов. Было установлено, что на определенных стадиях отдельные диски деспирализуются и принимают форму вздутий, получивших название пуффов. При помощи использования ра- 185 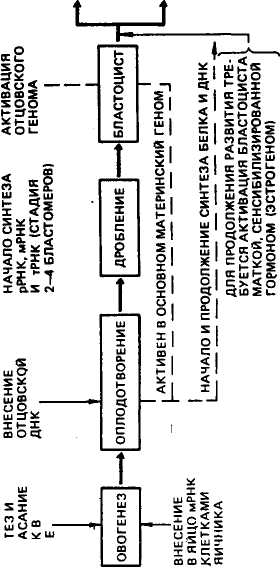 IO< On ИИ il Ш 00 s 25 Us I UlX S3 xm ш ш II JiiJU ISES III
диоактивного уридина было установлено, что в пуффах происходит интенсивный синтез молекул иРНК. Разные стадии развития личинок сопровождаются активностью определенных пуффов. Это говорит о том, что на разных этапах развития вступают в действие разные гены. О неодновременной активности различных генов может свидетельствовать изменение состава белков организма в связи с возрастом. На стадиях раннего эмбрионального развития у человека идет образование гемоглобина F, который состоит из двух цепей полипептидов — а и у. Приблизительно с 13 нед эмбрионального развития начинается синтез гемоглобина А, характерного для взрослого человека. У гемоглобина А цепь полипептида у заменена на цепь р несколько иного строения. Цепь а у обоих гемоглобинов одинакова, и ее синтез контролируется одним и тем же геном. У новорожденного гемоглобин F составляет 70— 80 % общего количества. И только к году происходит полная замена гемоглобина F гемоглобином А. По данным В. В. Пиль-ко, Е. К. Меркурьевой и С. Мигле, полная замена гемоглобина F гемоглобином А у телят происходит к ПО—120-дневному возрасту. Обнаружены существенные возрастные изменения в количестве и составе белков сыворотки крови у телят в эмбриональный период. По данным В. М. Холода, первый период эмбрионального развития характеризуется низким содержанием сывороточных белков (2,62 г%), затем количество их постепенно с возрастом плода увеличивается и к 9 мес достигает 4,44 г%. Отношение альбуминов к глобулинам возрастает с 0,40 у 2-месячного плода до 1,21 к моменту рождения. В постэмбриональный период также наблюдаются изменения белкового спектра сыворотки крови. По данным А. С. Гурьяновой, у телок бурой латвийской породы содержание общего белка сыворотки крови с 3- до 18-месячного возраста увеличилось с 6,12 до 7,54 %, в том числе глобулинов с 3,03 до 4,24 %. Некоторые органы и ткани специализируются на синтезе каких-то определенных белков, и количество РНК в них в отдельные периоды возрастает или снижается. И. Я. Шихов изучал содержание ДНК и РНК в вымени телок, нетелей и коров. Он обнаружил, что отношение количества РНК к количеству ДНК составляет в среднем у половозрелых телок 0,48, у нетелей и коров в конце стельности 1,0, у коров в начале лактации 2,34 (с большими колебаниями), в конце лактации 1,72. Наблюдалась высокая степень связи (г = 0,71) между содержанием РНК в вымени и удоем коров. Это показывает, что образование РНК усиливается, когда в вымени коров синтезируется много белка при высоких удоях, и снижается при уменьшении удоев. 187 ВЗАИМОДЕЙСТВИЕ ЯДРА И ЦИТОПЛАЗМЫ В РАЗВИТИИ Б. Л. Астауров в экспериментах по межвидовому андрогенезу с тутовым шелкопрядом убедительно показал главенствующую роль ядра в процессе индивидуального развития. Он получил межвидовые гибриды путем осеменения яиц дикого шелкопряда спермой домашнего шелкопряда и наоборот. Женские ядра инактивировались с помощью теплового шока (путем прогревания). В этом случае в оплодотворении яйцеклетки участвовали ядра двух сперматозоидов. Ядерно-цитоплазматические гибриды получали цитоплазму от одного вида, а ядра — от другого. Развившиеся особи всегда были мужского пола и по всем изученным признакам похожи на вид, от которого они получали ядра. Однако цитоплазма играет очень важную роль в реализации наследственной информации и формировании некоторых признаков организма. Известно, что основная часть цитоплазмы поступает в зиготу с яйцеклеткой. Цитоплазма яйцеклетки отличается dr цитоплазмы соматических клеток большим разнообразием белков, РНК и других видов молекул, синтезированных в оогенезе. Бовери, Конклин, Дриш и др. уже давно указывали на то, что определенные участки цитоплазмы яйцеклетки могут содержать факторы, определяющие судьбу тех или иных дифференцирующихся клеток. В результате неодинакового пространственного распределения веществ в цитоплазме яйцеклетки при дроблении зиготы идет неравнозначное распределение веществ (РНК, белков и др.) в бластомеры. На этом основании предполагалось, что активность генов зависит от цитоплазмы, и это нашло свое подтверждение в работах на молекулярном уровне за последние 10—15 лет. Дж. Гёрдон наглядно показал роль цитоплазмы в регуляции активности генов. Он вводил ядра дифференцированных клеток в энуклеированные яйцеклетки амфибий. Функциональное состояние ядра оценивал по синтезу ДНК и РНК, что определялось с помощью меченых предшественников. Обнаружено, что в ядре нейрона взрослой лягушки, введенном в активированную неоплодотворенную яйцеклетку, начинается синтез ДНК, а синтез РНК прекращается. Отсюда следует, что в цитоплазме яйцеклетки имеется активатор синтеза ДНК и репрессор синтеза РНК, которые действуют независимо друг от друга. Если ядра из клеток мозга взрослой лягушки пересадить в зрелый ооцит, то в них синтезируется РНК и не синтезируется ДНК. Если эти ядра пересадить в ооцит, находящийся на стадии делений созревания, то в них не происходит синтеза ни ДНК, ни РНК. Харрис с помощью методов авторадиографии показал, что ядро эритроцита курицы, введенное в клетку тканевой культуры человека или мыши, реагирует на сигнал «чужой» цитоплазмы и начинает синтез ДНК и РНК. Некоторые органоиды цитоплазмы, имеющие свою систему белкового синтеза (митохондрии, 188 пластиды), могут влиять на развитие определенных признаков. Наследование признаков через цитоплазму получило название цитоплазматической или внеядерной наследственности. Так, у растений наследование пестролистности идет по материнской линии и связано с передачей дочерним клеткам при делении разных типов пластид: зеленых, способных синтезировать хлорофилл, и белых, не способных к его образованию. Большое практическое значение имеет открытие цитоплазматической мужской стерильности у кукурузы М. И. Хаджиновым и М. Роде. Она обусловливается цитоплазматическим фактором щл5. Но имеет место и контролирующая роль ядра. Стерильность пыльцы наблюдается только при наличии в ядре гена if в гомозиготном состоянии (rfif). При наличии доминантного гена Rfb генотипе (RfRfvum Bfif) стерильность пыльцы не развивается. К настоящему времени цитоплазматическая мужская стерильность обнаружена у ряда сельскохозяйственных культур (пшеницы, сорго, лука, огурцов и др.). Таким образом, в процессе развития имеет место сложное взаимодействие ядра и цитоплазмы. В целом же у растений и особенно животных главная роль в формировании признаков организма принадлежит ядру. РЕГУЛЯЦИЯ СИНТЕЗА иРНК И БЕЛКА Все клетки организма, как бы они ни были дифференцированы, как правило, тождественны по генотипу. В каждой клетке имеются все хромосомы и весь набор свойственных данному организму генов. Однако клетки разных тканей любого организма отличаются по качественному и количественному составу белков. Различия наблюдаются даже в одной клетке в разное время. Это говорит о том, что в клетке транскрибируются не все гены сразу, а только те, которые кодируют белки и ферменты, необходимые клетке в данный момент для выполнения ее функций. Отсюда следует, что в клетке должен существовать механизм, регулирующий активность генов и обеспечивающий в нужное время синтез необходимых ей белков в достаточном количестве. На основании изучения синтеза ферментов у кишечной палочки французские генетики Ф. Жакоб и Ж. Моно предложили теорию индукции (возбуждения) и репрессии (подавления) белкового синтеза. По теории Ф. Жакоба и Ж. Моно, гены, влияющие на синтез какого-то фермента или белка, расположены в молекуле ДНК последовательно друг за другом в порядке их влияния на ход реакции синтеза. Такие гены были названы структурными. Перед группой структурных генов расположен общий для них ген-оператор, а перед ним — промотор. В целом эта функциональная группа называется опероном. На структурных генах опе-рона образуется одна общая молекула иРНК (полицистронная 189  иРНК), так как структурные гены находятся одновременно в активном или неактивном состоянии. В той же молекуле ДНК на некотором расстоянии расположен ген-регулятор, под контролем которого вырабатывается белок, называемый репрессором. Молекула репрессора имеет два специфических участка — один для присоединения к оператору, другой для связывания индуктора. Присоединяясь к оператору, репрессор блокирует транскрипцию. Когда ферменты на данном опероне не синтезируются, репрессор соединен с геном-оператором. Синтез фермента начинается под влиянием индуктора. Индуктором является определенное химическое соединение, которое служит материалом для данного фермента, или сходное с ним вещество. Индуктор соединяется с репрессором и инактивирует его. Оператор освобождается, начинается синтез иРНК на структурных генах и соответственно синтез фермента. иРНК), так как структурные гены находятся одновременно в активном или неактивном состоянии. В той же молекуле ДНК на некотором расстоянии расположен ген-регулятор, под контролем которого вырабатывается белок, называемый репрессором. Молекула репрессора имеет два специфических участка — один для присоединения к оператору, другой для связывания индуктора. Присоединяясь к оператору, репрессор блокирует транскрипцию. Когда ферменты на данном опероне не синтезируются, репрессор соединен с геном-оператором. Синтез фермента начинается под влиянием индуктора. Индуктором является определенное химическое соединение, которое служит материалом для данного фермента, или сходное с ним вещество. Индуктор соединяется с репрессором и инактивирует его. Оператор освобождается, начинается синтез иРНК на структурных генах и соответственно синтез фермента.Рассмотрим принципы функционирования оперона на примере регулйЬии синтеза ферментов, участвующих в усвоении лактозы кишечной палочкой (рис. 40). В лактозном опероне три структурных гена (гень генг, генз). Они занимают участок, включающий около 6000 нуклеотидных пар. Первым идет ген, определяющий структуру молекулы (J-галактозидазы, вторым — ген, кодирующий галактозидпермеазу, и третьим — ген, кодирующий галактозидтрансацетилазу. Все три гена транскрибиру- 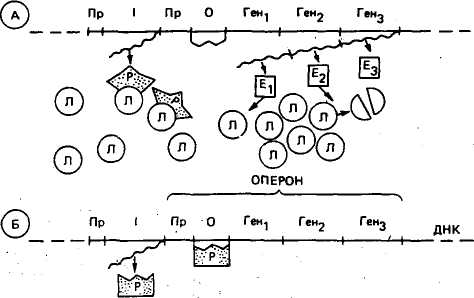 ДНК ОПЕРОН Рис. 40. Регуляция транскрипции (по Э. Гюнтеру) П  ример: область лактозного оперона у Е. coli: ример: область лактозного оперона у Е. coli:А — в присутствии лактозы; Б — без лактозы; Яр—промотор; О—оператор; / — регулятор-ный ген; структурные гены — геш, генг, генэ; Р— репрессор; Л — молекула лактозы; волнистая линия — иРНК 190 ются вместе. РНК-полимераза присоединяется к промотору и продвигается вдоль оперона, транскрибируя его. Активность структурных генов регулируется белком-репрессо-ром, который кодируется геном-регулятором. Репрессор вырабатывается в небольшом количестве непрерывно и, если нет в питательной среде лактозы, прикрепляется к оператору, препятствуя продвижению РНК-полимеразы от промотора к структурным генам. Гены оказываются репрессированными, и синтез трех кодируемых ими ферментов не осуществляется. При поступлении в клетку лактозы она быстро связывается с молекулами репрессора, освобождая ген-оператор. Это ведет к тому, что РНК. полимеразы присоединяется к промотору и продвигается вдоль оперона, поочередно транскрибируя все три гена. В результате синтезируются ферменты, расщепляющие лактозу. Индукция вызывается тем, что белок-репрессор не прикрепляется к оператору. После полной утилизации лактозы белок-репрессор освобождается и вновь связывается с геном-оператором, и процесс синтеза уже ненужных ферментов прекращается. Опероны анаболических ферментов, аминокислот и азотистых оснований функционируют по принципу обратной связи. В этом случае синтез ферментов идет только до тех пор, пока конечного продукта в клетке недостаточно. Избыток продукта репрессирует синтез ферментов, участвующих в его образовании. Механизмы регуляции у эукариот значительно сложнее и менее изучены. Это связано со сложной дифференцировкой клеток разных органов и тканей. У эукариот выявлены гены, проявляющие активность во всех клетках организма. Они ответственны за образование структур, общих для всех клеток. Имеются гены, действие которых проявляется только в специализированных тканях. Кроме того, есть гены, ответственные за выполнение ограниченных функций — синтез гемоглобина, кератина волос и т. д. Это говорит о том, что и у эукариот должны быть механизмы регуляции генов. Возможно, эукариоты используют такой же механизм регуляции синтеза белков, как и прокариоты, но, кроме того, у них имеются и другие процессы регуляции, характерные для этих организмов. У эукариот возможно одновременное групповое подавление активности генов: во всем ядре, в целой хромосоме или в большом ее участке. Предполагается, что такая репрессия генов осуществляется в значительной мере гистонами — основными белками, которые входят в состав хромосом эукариот. Примером групповой регуляции активности генов является полное прекращение транскрипции всех генов при спермиогенезе у животных. Считают, что такое выключение всех генов при образовании спермиев и постепенная их дерепрессия при эмбриогенезе связаны с изменениями белковых компонентов хромосом. Групповое выключение активности генов в одной из Х-хромосом наблюдается в 191 онтогенезе у самок млекопитающих, обладающих двумя Х-хро-мосомами. В этих хромосомах находятся гены, детерминирующие дифференцировку пола на ранних стадиях онтогенеза. Затем одна из Х-хромосом инактивируется, превращаясь в так называемое тельце Барра. Этим достигается сбалансированность эффекта генов из Х-хромосом у самок и самцов. Имеется много примеров, указывающих на большую роль гормонов в регуляции активности генов. Мы уже разбирали вопрос о том, что в гигантских хромосомах двукрылых можно обнаружить активно транскрибирующиеся участки, которые становятся разрыхленными и наблюдаются в виде пуффов. Пуффы появляются на разных стадиях развития в разных участках хромосом. Если вводить гормон экдизон особям, у которых выделение гормона еще не начиналось, то можно добиться появления пуффов, как при естественной секреции гормона. Вначале наблюдается появление «ранних» пуффов, а через 3—10 ч имеется уже около 100 «поздних» пуффов. Гормон щитовидной железы, очевидно, влияет на проявление активности генов, обусловливающих процессы метаморфоза. При добавлении этого гормона в среду совершается быстрое превращение головастиков в лягушек. Известно, что гормон поджелудочной железы инсулин нормализует содержание глюкозы в крови. Вебер установил, что инсулин активирует три гена, которые кодируют ферменты, использующие глюкозу (гликолиз и синтез гликогена), и в то же время он является репрессором для четырех генов, которые кодируют ферменты, влияющие на гли-конеогенез (синтез глюкозы из неуглеводистых веществ). В последние годы исследуется роль пистонов и негистоновых хромосомных белков в регуляции действия генов. Исследования показывают, что гистоны, по-видимому, тормозяще действуют на синтез РНК. Например, у бобовых белок глобулин in vivo образуется только в семядолях. Однако если удалить из хроматина других частей растения гистоновые компоненты, то и в них in vitro будет синтезироваться тот же глобулин. Это говорит о том, что гистоны, по-видимому, блокируют гены. Негистоновые хромосомные белки представлены большим многообразием, обнаружено разное их содержание в хроматине различных тканей на разных стадиях развития. Предполагается, что они также участвуют в регуляции синтеза белка — снимают блокирующее действие гистонов. Однако регуляторная функция гистонов и негистоновых белков пока точно не выяснена. К механизмам регуляции синтеза белка относится синтез дополнительной ДНК, которая затем поступает в цитоплазму. В цитоплазме на ДНК синтезируется иРНК, а на ней белки, необходимые для клетки. В яйцеклетках амфибий и цитоплазме рыб в период роста и созревания ооцитов было обнаружено большое количество активной ДНК. Таким образом, ДНК ядра может образовывать фракции, 192 переходящие в цитоплазму, и синтез белка может регулироваться не только подавлением, но и усилением действия генов. Проблема регуляции действия генов у высших организмов имеет большое практическое значение в животноводстве и медицине. Структура ДНК определяет химическое строение и функции белков, т. е. их качественный состав. Но в процессах развития и жизни организма очень важное значение имеет и количество синтезируемого белка, а это связано с регуляцией активности генов. Установление факторов, регулирующих синтез белка, раскрыло бы широкие возможности управления онтогенезом, создания животных с более высоким уровнем продуктивности и лучшей устойчивостью к разного рода болезням. ВЛИЯНИЕ СРЕДЫ НА РАЗВИТИЕ ПРИЗНАКОВ Фенотип каждого организма формируется под влиянием генотипа и условий среды. Генотип определяет норму реакции организ-. ма — границы изменчивости выражения признака под влиянием изменяющихся условий окружающей среды. Те различия, которые зависят только от условий среды, называются модификациями. Роль генотипа и определенных факторов среды в образовании разных признаков организма может быть очень различной. Есть такие признаки, которые в основном обусловлены генотипом. К ним относятся качественные признаки, такие как группы крови, форма ушей у свиней, окраска тела и др. В то же время на формирование целого ряда признаков, особенно хозяйственно полезных (удой, содержание жира и белка в молоке, живая масса и др.), во многом влияют условия внешней среды. Иногда под воздействием определенных факторов могут изменяться и устойчивые признаки. Так, у кроликов, гомозиготных по рецессивному гену горностаевой окраски, имеющих белую окраску туловища и черные уши, хвост, конец морды и концы лапок, рисунок окраски можно изменить под влиянием температуры. Н. А. Ильин выбривал у горностаевых кроликов участки белых и черных волос и создавал условия пониженной или повышенной температуры. В зависимости от температуры на выбритых участках тела отрастали белые или черные волосы. Для каждой части тела был установлен порог раздражения — температура, выше которой развивалась белая шерсть, а ниже — черная. Так, на боку кролика при температуре ниже 2 °С вырастала черная шерсть, на ухе при температуре выше 30 "С — белая шерсть и т. д. Таким образом, наследуется не рисунок кролика, а способность или неспособность в зависимости от температуры образовывать пигмент в волосе. При изменении условий среды иногда признак изменяется так же, как и под влиянием действия генов, но возникшие особенности не являются наследственными. Такие изменения называют фенокопиями. Например, у кур 193 врожденный дефект бесхвостости наследуется, но в некоторых случаях обусловливается влиянием внешней среды в период насиживания. Среда особенно влияет на развитие хозяйственно полезных признаков сельскохозяйственных животных. Неблагоприятные условия кормления и содержания в первую очередь влияют на высокопродуктивных животных. В таблице 27 приведены данные по удою дочерей и внучек трех быков-производителей симментальской породы. 27. Продуктивность коров — дочерей и внучек разных быков-производителей в зависимости от условий кормления и выращивания (по О. А. Ивановой) Быки-производители— отцы и деды коров У  дой коров за 300 дней лактации, кг дой коров за 300 дней лактации, кгвыращенных в посредственных условиях и датировавших при кормлении обильном в  ыращенных и лактировавших при обильном кормлении ыращенных и лактировавших при обильном кормленииумеренном
Как видим, у коров, выращенных в посредственных условиях и лактировавших при умеренном кормлении, между потомками разных быков имеются незначительные различия. При обильном кормлении у потомков Цезаря удой оказался меньше по сравнению с потомками Наследника на 449 кг и по сравнению с потомками Биса на 504 кг. Еще значительнее была разница в удое потомков, выращенных и лактировавших при обильном кормлении. В этом случае потомки Биса превзошли по удою дочерей Цезаря на 722 кг и дочерей Наследника на 462 кг. При улучшении кормления потомство Цезаря повысило удой на 2059 кг, Наследника — на 2302, а Биса — на 2803 кг. Это показывает, что реакция на улучшение условий среды у потомства разных быков была различной. Из приведенного примера видно, что среда может сгладить наследственные различия между животными, в результате чего лучшие и худшие по генотипу особи по продуктивности оказываются одинаковыми. Правильно отобрать наиболее ценных по генотипу животных можно только при оптимальных условиях среды. Имеются наблюдения эмбриологов, говорящие о том, что резкое изменение среды в определенные периоды эмбрионального развития организма может привести к гибели плода. Такие периоды называют критическими. Критические периоды обнаружены в онтогенезе рыб, птиц, млекопитающих и человека. Они выявляются после поздней бластулы и предшествуют основным процессам морфогенеза. У человека первый критический период 194 относится к 1-й — началу 2-й недели после зачатия, второй — к 3—5-й недели развития, когда происходит закладка отдельных органов эмбриона человека. Третий критический период наблюдается между 8-й и 11-й неделями, когда формируется плацента. В критические периоды наблюдается чувствительность эмбриона к недостаточному снабжению кислородом и питательными веществами, ионизирующей радиации, перегреванию, охлаждению, лекарственным и ядовитым веществам, попадающим в кровь плода через плаценту. Указанные факторы могут вызвать замедление и остановку развития, появление уродств, высокую смертность зародышей. У кур критические периоды приходятся на 2—3-й день инкубации, когда начинает формироваться система кровообращения; на 8—9-й день развития, когда начинается резко выраженная дифференцировка характерных для птиц органов и тканей; на 19-й день инкубации, когда снова усиливаются процессы диффе-ренцировки и начинает изменяться тип дыхания. В критический период эмбрионы птиц особенно чувствительны к изменению режима инкубации: температуры и влажности воздуха, а также аэрации яиц. Предполагают, что у крупного рогатого скота также существуют критические периоды и первый период приходится на первые три дня развития зиготы. В критические периоды происходит, очевидно, смена матриц белкового синтеза и в связи с этим ослабление физиологических процессов. При изучении соотношения среды и наследственности большой интерес представляют особи человека и животных, совершенно идентичные по генотипу, — однояйцовые близнецы. У них генотипы тождественны, и они принадлежат к одному полу. Близнецов широко используют для выяснения вопроса о влиянии различных факторов среды и наследственности на формирование признаков организма. Изучая близнецов, можно получить данные о том, в какой степени среда может модифицировать проявление патологических симптомов определенной болезни. Контрольные вопросы. 1. В чем заключается центровая теория гена? 2. Что такое ген, что вы знаете о строении гена? 3. Как проявляется влияние генов на развитие признаков? 4. Что понимается под дифференциальной активностью генов на разных этапах онтогенеза? 5. Что вы знаете о взаимодействии ядра и цитоплазмы в развитии? 6. Как происходит регуляция синтеза иРНК и белка в клетке? 7. Как влияет среда на развитие признаков? 8. Что вы знаете о критических периодах в развитии?  |
