В. Н. Сайтаниди Рецензент членкорреспондент расхн в. Ф. Красота Петухов В. Л. и др. П31 Ветеринарная генетика В. Л. Петухов, А. И. Жигачев, Г. А. Назарова. 2е изд., перераб и доп. М. Колос, 1996. 384 с ил. Учебники
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
|
ХИМИЧЕСКИЙ СОСТАВ И СТРУКТУРА НУКЛЕИНОВЫХ КИСЛОТ Нуклеиновые кислоты впервые открыл И. Ф. Мишер в 1868 г. Он выделил из ядер клеток особое вещество кислотной природы и назвал его нуклеином. Впоследствии ему дали название «нуклеиновая кислота». Было обнаружено два типа нуклеиновых кислот. Их назвали в зависимости от углеводного компонента, входящего в состав. Нуклеиновую кислоту, в состав которой входит углевод дезоксирибоза, назвали дезоксирибонуклеиновой кислотой (ДНК), а в состав которой входит углевод рибоза, — рибонуклеино- 76 вой кислотой (РНК). В период с 1900 по 1932 г. был определен химический состав нуклеиновых кислот. Они включают следующие компоненты: РНК Аденин, гуанин Цитозин, урацил Рибоза ДНК Аденин, гуанин Цитозин, тимин Дезоксирибоза Пуриновые основания Пиримидиновые основания Углеводный компонент Обе нуклеиновые кислоты включают остатки фосфорной кислоты. Различие заключается в том, что в состав РНК входит азотистое основание урацил вместо тимина и рибоза вместо дезоксирибозы. В 1936 г. на кафедре биохимии растений Московского университета А. Н. Белозерский с И. И. Дубровской впервые выделили ДНК в чистом виде из растительного материала. К середине 40-х годов было выяснено, что ДНК и РНК одновременно присутствуют в каждом живом организме. В конце 40-х — начале 50-х годов при изучении нуклеиновых кислот стали использовать новые физические и химические методы исследования. В 1950 г. Э. Чаргафф установил правила нукле-отидных отношений, лежащие в основе строения всех ДНК. Правила Чаргаффа заключаются в том, что в ДНК содержание аденина равно содержанию тимина (А = Т), а содержание гуанина равно содержанию цитозина (Г = И), отсюда А + Г/Т + Ц = 1; сумма пуриновых нуклеотидов равна сумме пиримидиновых нуклео-тидов. В соответствии с этим правилом нуклеотидный состав разных организмов может варьировать только по величине А+Т/Г+Ц. К 1952 г. Р. Франклин и М. Уилкинс добились получения высококачественных рентгенограмм ДНК, показавших, что она имеет форму спирали и двойственную структуру. В 1953 г. Дж. Уотсон и Ф. Крик, опираясь на данные рентге-ноструктурного анализа и правила Чаргаффа, установили структуру ДНК. Согласно их модели молекула ДНК имеет двойную спираль, состоящую из двух полинуклеотидных цепей с общей осью (рис. 17). Диаметр двойной спирали ДНК равен 2 нм, а расстояние между витками 3,4 нм. На каждый виток спирали приходится 10 пар нуклеотидов, отсюда расстояние между азотистыми основаниями равно 0,34 нм. Структурными единицами полинуклеотидных цепей являются нуклеотиды. В состав нуклеотида входят: одно из азотистых оснований — пуриновое (аденин или гуанин) или пиримидиновое (тимин или цитозин), дезоксирибоза, фосфатный остаток. Эти компоненты соединены друг с другом в следующем порядке: азотистое основание — дезоксирибоза — фосфатный остаток. Соединение одного из оснований с дезоксирибозой приводит к образованию нуклеозида. В случае присоединения фосфатной группы к углеводной части нуклеозида образуется нуклеотид. 77   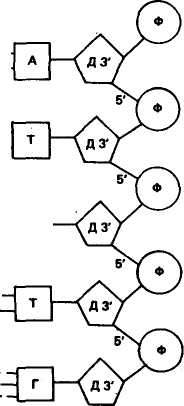 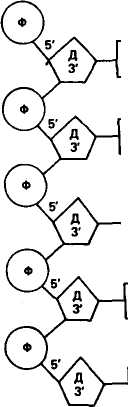 Дезоксирибоза в нуклеотидах соединяется с основаниями гли-козидной связью, а с фосфорной кислотой — эфирными связями. Следовательно, по химическому составу любой нуклеотид — это фосфорный эфир нуклеозидов. В соответствии с этим нукле-отиды называются дезоксиадениловой, дезоксигуаниловой, дезокси-цитидиловой и тимидиловой кислотами. Дезоксирибоза в нуклеотидах соединяется с основаниями гли-козидной связью, а с фосфорной кислотой — эфирными связями. Следовательно, по химическому составу любой нуклеотид — это фосфорный эфир нуклеозидов. В соответствии с этим нукле-отиды называются дезоксиадениловой, дезоксигуаниловой, дезокси-цитидиловой и тимидиловой кислотами.Наряду с главными азотистыми основаниями ДНК содержит также метилированные основания, такие, как 5-метилцитозин, 5-оксиметилцитозин и др. У животных количество 5-метилцито-зина в ДНК обычно не превышает 1,5—2 %. В каждой из цепей ДНК нуклеотиды последовательно соединены друг с другом с помощью остатка фосфорной кислоты и молекулы дезоксирибозы. Дезоксирибоза связывается с одной молекулой фосфорной кислоты через углерод в положении 3', а с другой — через углерод 5', образуя углеводно-фосфатный остов (рис. 18). Обе цепи в молекуле ДНК имеют противоположную полярность. Это означает, что межнуклеотидная связь в одной цепи имеет направление 5'-»3', а в другой
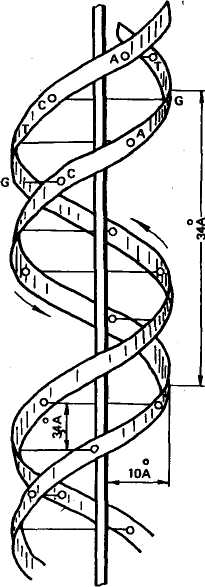 Азотистые основания нуклеотидов обеих цепей ДНК заключены внутри между витками спирали и соединены водородными связями. В соответствии с правилами Чаргаффа аденин одной цепи связан только с тимином другой цепи, а гуанин — только с цитозином. Пара аденин — тимин соединена двумя водородными связями, а пара гуанин — цитозин — тремя. Такой порядок соответствия азотистых оснований (А **Т и Г **Д) называется комплементарностью, и, следовательно, цепи в ДНК комплементарны, они взаимно дополняют друг друга. Углеводно-фосфатный остов по всей длине во всех молекулах ДНК имеет однотипную структуру и не может нести генетической информации. В противоположность этому рас- Рнс. 17. Схема строения молекулы ДНК из двух спирально закрученных цепей (по Д. Уотсо-ну и Ф. Крику) (Цифры указывают на расстоя- ния ■ А между разными точками молекулы) 78 Рис. 18. Схема отрезка двухцепочной молекулы ДНК (по С. М. Гершензону) положение пуриновых и пиримидиновых оснований нуклеотидов вдоль цепи ДНК очень изменчиво и характерно для каждого данного типа молекул ДНК. Значит, наследственная информация зашифрована различной последовательностью оснований. Нуклеотидный состав ДНК значительно варьирует в зависимости от принадлежности организма к той или иной систематической группе (табл. 7). Специфичность ДНК выражается соотношением А + Т/Г + Ц, получившим название коэффициента видовой специфичности.
30,9 19,9 19,8 29,4 1,52 Человек Животные: 28,3 1,36 29,2 1,38 27.1 1,19 32,9 1,79 24,9 1,00 23,6 0,93
овиа курица Растения, грибы, зерна пшеницы Дрожжи Aspergillus niger Бактерии: Е. coli Staphylococcus ayreus Clostridium perfinngens Bnicella abortus Sarcina lutea 79 топоизомераза 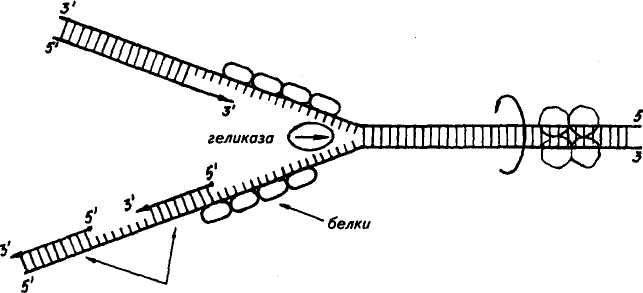 В ДНК животных наблюдается избыток А + Т по отношению к Г + Ц. У грибов и бактерий встречаются формы как богатые А + Т, так и с преобладанием Г + Ц, в то же время есть близкие по коэффициенту специфичности к животным. Это говорит о том, что изменчивость в расположении оснований уже достаточна для того, чтобы обеспечить различия между генами этих организмов. В ДНК животных наблюдается избыток А + Т по отношению к Г + Ц. У грибов и бактерий встречаются формы как богатые А + Т, так и с преобладанием Г + Ц, в то же время есть близкие по коэффициенту специфичности к животным. Это говорит о том, что изменчивость в расположении оснований уже достаточна для того, чтобы обеспечить различия между генами этих организмов. Молекулы ДНК состоят примерно из 2-Ю3— МО8 и более нуклеотидов и имеют большую относительную молекулярную массу. Репликация (удвоение) ДНК. ДНК находится в хромосомах, и репликация ее происходит перед каждым удвоением хромосом и делением клетки. Дж. Уотсон и Ф. Крик предложили схему удвоения ДНК, согласно которой спиралевидная двухцепочная ДНК сначала раскручивается (расплетается) вдоль оси. При этом водородные связи между азотистыми основаниями рвутся и цепи расходятся. Одновременно к нуклеотидам каждой цепи пристраиваются комплементарные азотистые основания нуклеотидов второй цепи, где против аденина встает тимин, против тимина — аденин, против гуанина — цитозин и т. д., которые с помощью ферментов ДНК-полимераз связываются в новые полинуклеотидные цепи. В результате из одной образуются две новые дочерние молекулы ДНК. Каждая дочерняя молекула, наследуя структуру одной цепи материнской молекулы, строго сохраняет специфичность заключенной в ней информации. Поскольку матрицей для репликации служит одна из двух цепей молекулы, такой тип синтеза ДНК носит название полуконсервативной ауторепродукции. Дальнейшие исследования показали, что репликация бактериальных и других молекул ДНК начинается в определенной точке старта. В хромосомах эукариот обнаружено по нескольку таких начальных точек. Цепи ДНК в точке инициации репликации разъединяются под влиянием особого белка геликазы (рис. 19). Возникают одноцепочные участки ДНК, которые становятся матрицами для репликации-притяжения комплементарных нуклеотидов. Эти одноцепочные участки связываются с особыми белками, которые их стабилизируют (препятствуют их комплементарному взаимодействию). Особый фермент топоизомераза (у прокариот назьгаается ДНК-гиразой) способствует расщеплению спирали ДНК в области репликационной вилки. Репликация на материнской цепи, идущей от точки старта в направлении 5'-*3', идет в виде сплошной линии. Эта цепь получила название лидирующей. Синтез на второй цепи 3'->5' идет отдельными фрагментами в противоположном направлении (тоже 5'-»3')- Эта цепь получила название запаздывающей. Фрагментами являются небольшие участки ДНК (у кишечной палочки около 2000 нуклеотидов, у эукариот около 200). Они называются по 80 фрагменты Окозаки Рис. 19. Синтез лидирующей (вверху) и запаздывающей (внизу) цепей ДНК в вилке репликации (по В. Alberts, R. Sternglanz) имени открывшего их японского ученого Р. Оказаки. После завершения синтеза фрагменты Оказаки соединяются при помощи фермента лигазы в общую полинуклеотидную цепочку. У эукариот репликация ДНК и соединение различных ее репликационных участков происходят в фазе S-периода интерфазы. После завершения этой фазы в каждой хромосоме имеется две молекулы ДНК, которые становятся двумя идентичными хроматидами. Структура, способная к репликации (хромосома, плазмида, вирусный геном), называется репликоном. Самоудвоение молекул ДНК — основа устойчивости генетической информации данного вида и обеспечивает материальную непрерывность наследственного вещества клетки. СТРОЕНИЕ И ТИПЫ РНК Многочисленными исследованиями было установлено, что синтез белка в клетке происходит не в ядре, где находится ДНК, а в цитоплазме. Следовательно, сама ДНК не может служить матрицей для синтеза белка. Вставал вопрос о молекулярных механизмах переноса информации, закодированной в ДНК (генах), из ядра в цитоплазму к месту синтеза белка. Сравнительно недавно выяснилось, что молекулами, ответственными за считывание и перенос информации, а также за преобразование этой информации в последовательность аминокислот в структуре белковой молекулы, являются рибонуклеиновые кислоты (РНК). Молекулы рибонуклеиновой кислоты имеют одну полинуклеотидную цепь, Нуклеотиды молекулы РНК называются адениловой гуаншовой, уридшювой и цитцдиловой кислотами. На долю РНК приходится около 5—10 % общей массы клетки. 81 АМИНОКИСЛОТА АКЦЕПТОРНЫЙ КОНЕЦ D - ПЕТЛЯ Т - ПЕТЛЯ АНТИКОДОННАЯ ПЕТЛЯ 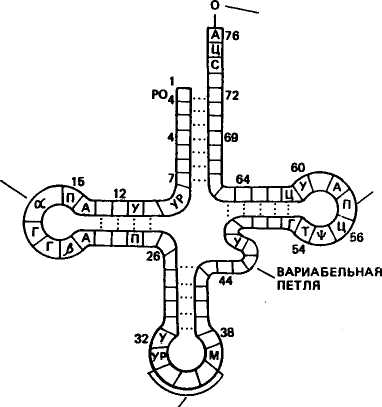 Существует три основных вида РНК: информационная (иРНК), или матричная (мРНК), рибосомная (рРНК), и транспортная (тРНК). Они различаются по величине молекул и функциям. Все типы РНК синтезируются на ДНК при участии ферментов — РНК-полимераз. Информационная, или матричная, РНК составляет 2—3 % всей клеточной РНК, рибосомная — 80—85, транспортная — около 15 %. Существует три основных вида РНК: информационная (иРНК), или матричная (мРНК), рибосомная (рРНК), и транспортная (тРНК). Они различаются по величине молекул и функциям. Все типы РНК синтезируются на ДНК при участии ферментов — РНК-полимераз. Информационная, или матричная, РНК составляет 2—3 % всей клеточной РНК, рибосомная — 80—85, транспортная — около 15 %. Информационная РНК (иРНК) впервые была обнаружена в 1957 г. Роль ее в том, что она считывает наследственную информацию с участка ДНК (гена) и в форме скопированной последовательности азотистых оснований переносит ее в рибосомы, где происходит синтез определенного белка. Каждая из молекул иРНК по порядку расположения нуклеотидов и по размеру соответствует гену в ДНК, с которого она была транскрибирована. В среднем иРНК содержит 1500 нуклеотидов (75— 3000). Каждый триплет (три нуклеотида) на иРНК называется кодоноц. От кодона зависит, какая аминокислота встанет в данном меЬте при синтезе белка.' Информационная РНК может обладать относительной молекулярной массой от 250 до 1000 тыс. Д (дальтон). Существует большое разнообразие иРНК как в отношении состава, так и величины молекулы. Это связано с тем, что в клетке находится большое количество разнообразных белков, а строение каждого белка обусловлено своим геном, с которого иРНК считала информацию. Транспортная РНК (тРНК) обладает относительно невысокой молекулярной массой порядка 24—29 тыс. Д и содержит в молекуле от 75 до 90 нуклеотидов. До 10 % всех нуклеотидов тРНК приходится на долю минорных оснований, что, по-видимому, защищает ее от действия гидролитических ферментов. Роль тРНК заключается в том, что они переносят аминокислоты к рибосомам и участвуют в процессе синтеза белка. Каждая аминокислота присоединяется к определенной тРНК. Ряд аминокислот обладает более одной тРНК. К настоящему времени обнаружено более 60 тРНК, которые отличаются между собой первичной структурой (последовательностью оснований). Вторичная структура у всех тРНК представлена в виде клеверного листа с двухцепочным стеблем и тремя одноцепочными петлями (рис. 20). На конце одной из цепей находится акцепторный участок — триплет ЦЦА, к аденину которого присоединяется специфическая аминокислота. Аминокислота присоединяется к тРНК под действием фермента аминоацил-тРНК-синтетазы, который «узнает» одновременно и аминокислоту, и тРНК. В головке средней петли тРНК находится антикодон — триплет, состоящий из трех нуклеотидов. Антикодон комплементарен определенному кодону мРНК. При помощи антикодона тРНК «узнает» соответствующий кодон в иРНК, т. е. определяет место, куда 82 АНТИКОДОН Рис, 20. Вторичная структура тРНК (по Ричу и Киму) должна быть поставлена данная аминокислота в синтезируемой молекуле белка. Предполагается, что петли тРНК, не вовлеченные в связывание и выполнение декодирующей функции аминокислоты, используются для связывания тРНК с рибосомой и со специфической аминоацил-тРНК-синтетазой. Рибосомная РНК (рРНК). Размер рибосомных РНК эукариот составляет 5—28S (S — единица Сведберга, характеризующая скорость осаждения, седиментации частиц при ультрацентрифугировании), молекулярная масса 3,5-104— 1,5-106 Д. Они содержат 120—3100 нуклеотидов. Рибосомная РНК накапливается в ядре, в ядрышках. В ядрышки из цитоплазмы транспортируются рибосомные белки, и там происходит спонтанное образование субчастиц рибосом путем объединения белков с соответствующими рРНК. Субчастицы рибосомы вместе или врозь транспортируются через поры ядерной мембраны в цитоплазму. Рибосомы представляют собой органеллы величиной 20— 30 нм. Они построены из двух субчастиц разного размера и формы. На определенных стадиях белкового синтеза в клетке происходит разделение рибосом на субчастицы. Рибосомная РНК служит как бы каркасом рибосом и способствует первоначальному связыванию иРНК с рибосомой в процессе биосинтеза белка. Субчастицы обозначают у эукариот как 60 и 40S. Целые рибосомы 83 осаждаются при 80S. 408-субчастица содержит 18S РНК и примерно 30 белков; 608-субчастица содержит 28S РНК, 5S РНК и 5,8S РНК. В состав этой частицы входит примерно 50 различных белков. У прокариот функциональная рибосома имеет константу седиментации 70S. 7015-рибосомы состоят из малой (30S) и большой (50S) субчастиц. SOS-рибосомы содержат примерно равное количество рРНК и белка, у 70S-pn6ocoM соотношение РНК и белка составляет 2:1. Число рибосом в клетке прокариот равно примерно 104, у эукариот — около 105. В период синтеза белка рибосомы могут объединяться в полисомы, образуя более высокоорганизованные комплексы. ГЕНЕТИЧЕСКИЙ КОД Представление о том, что генетическая информация о структуре белковых молекул зашифрована в ДНК путем определенного расположения нуклеотидов, конкретизировал Ф. Крик в гипотезе последовательности, согласно которой последовательность элементов гена определяет последовательность аминокислотных остатков в полипептидной цепи. Было установлено, что наследственную информацию с ДНК считывает иРНК, которая образуется комплементарно одной из цепей ДНК. Однако не было известно, каким образом переводится нуклеотидная последовательность иРНК в аминокислотную последовательность полипептидной цепи. Можно было предположить, что генетический код не может состоять из одного или двух нуклеотидов, так как их только четыре и сочетаний из двух (43) может быть только 16, а аминокислот 20. Г. Гамов в 1954 г. впервые высказал мысль о том, что генетический код должен быть триплетным. В этом случае получается (43) 64 сочетания, и их вполне достаточно для кодирования всех аминокислот. Начало экспериментальному анализу природы генетического кода положили М. Ниренберг и Дж. Маттеи в 1961 г. Они создали простейшие синтетические полимеры типа иРНК. Искусственно полученный полимер, содержащий только уридиновые нуклеотиды, в которых основанием является урацил, вводили в бесклеточную среду, полученную из кишечной палочки. В результате был получен полипептид, состоящий только из фенил-аланина — полифенилаланин. Кодон для фенилаланина был расшифрован как УУУ. К расшифровке генетического кода активно подключился С. Очоа с сотр. В течение 3—4 лет в лабораториях М. Ниренбер-га и С. Очоа был определен состав большинства кодонов. Однако требовалось определить последовательность нуклеотидов в ко-донах. Это удалось сделать при помощи двух методов. Г. Корана с сотр. разработал метод химического синтеза ДНК-подобных полимеров с заданной последовательностью нуклеотидов, что 84 позволяло получить РНК также с заранее известной последовательностью нуклеотидов и использовать ее в бесклеточной системе белкового синтеза. Второй метод предложили М. Ниренберг и П. Ледер, исходя из того, что промежуточными продуктами при синтезе белка являются аминокислоты, связанные с тРНК. Убедившись в том, что одного триплета иРНК (трех нуклеотидов) достаточно для связывания с рибосомой и тРНК, ученые использовали тринуклеотидные матрицы с известным чередованием оснований для того, чтобы изучить, какую аминокислоту доставит тРНК. В результате использования методов, разработанных Г. Кора-ной, М. Ниренбергом и П. Ледером, к 1966 г. были определены все триплеты, кодирующие ту или иную аминокислоту. Триплет иРНК получил название кодона. Генетический код был полностью расшифрован (табл. 8), значит, была выяснена природа связи между структурой гена и соответствующего белка. Было установлено, что 61 триплет кодирует аминокислоты, 3 триплета не соответствуют никакой аминокислоте и определяют конец трансляции. . Выявлены следующие особенности генетического кода: 1) генетический код триплетный (каждая аминокислота кодируется тремя нуклеотидами); 2) неперекрывающийся (соседние триплеты не имеют общих нуклеотидов); 3) вырожденный (за исключением метионина и триптофана все аминокислоты имеют более одного кодона); 4) универсальный (в основном одинаков для всех живых организмов); 5) в кодонах для одной аминокислоты первые два нуклеотида, как правило, одинаковы, а третий варьирует; 6) имеет линейный порядок считывания и характеризуется колине-арностью, т. е. совпадением порядка расположения кодонов в иРНК с порядком расположения аминокислот в синтезирующейся полипептидной цепи. Сравнительно недавно выяснилось, что в митохондриях нарушается универсальность генетического кода. Четыре кодона в митохондриях изменили свой смысл: кодон УГА отвечает триптофану, АУА — метионину, а кодоны АГА и АГГ стали терминирующими. В митохондриях синтезируется небольшое количество белков, которые используются ими же. Открытие новых кодонов у митохондрий может служить доказательством того, что код эволюционировал, что он не сразу стал таким, каким мы его знаем теперь. СИНТЕЗ БЕЛКА В КЛЕТКЕ В настоящее время можно считать установленным, что наследственность реализуется в процессе биосинтеза белка. Синтез ферментов и других белков, необходимых для жизнедеятельности и развития организмов, происходит в основном на первой стадии 85 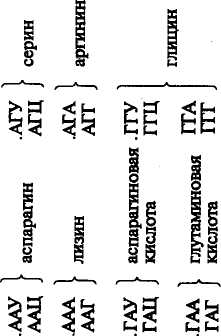 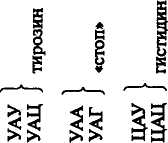 00 86 II >.i=r ? интерфазы, до начала репликации ДНК. В процессе синтеза белка различают этапы транскрипции и трансляции. Транскрипция заключается в том, что наследственная информация, записанная в ДНК (гене), точно транскрибируется (переписывается) в нуклеотидную последовательность иРНК. Синтез иРНК начинается с участка инициации транскрипции, называемого промотором. Промотор расположен перед геном и включает около 80 нуклеотидов. У вирусов и бактерий этот участок включает около 10 нуклеотидов (один виток спирали). Транскрипция осуществляется с помощью ферментов РНК-полимераз. РНК-полимераза прочно связывается с промотором и «расплавляет» его, разъединяя нуклеотиды комплементарных /цепей. Затем этот фермент начинает двигаться вдоль гена и по *" мере разъединения цепей ДНК на одной из них, которая является смысловой, ведет синтез иРНК, согласно принципу компле-ментарности присоединяя аденин к тимину, урацил к аденину, цитозин к гуанину и гуанин к цитозину. Те участки гена, на которых полимераза образовала иРНК, вновь соединяются, а синтезируемая молекула иРНК постепенно отделяется от ДНК. Конец синтеза иРНК определяется участком остановки транскрипции — терминатором. Нуклеотидные последовательности промотора и терминатора узнаются специальными белками, регулирующими активность РНК-полимеразы. В 1977 г. было обнаружено, что у эукариот в последователь-• ности нуклеотидов ДНК имеются отрезки, не содержащие информации, которые были названы интронами. Участки ДНК, несущие информацию, называются экзонами. При считывании информации с определенного участка ДНК (гена) сначала образуется транскрипт всей последовательности (про-мРНК), а затем происходит процесс созревания иРНК, называемый процессингом. При процессинге происходит сплайсинг, который заключается в том, что в ядре интроны из РНК как бы «выпетливаются» и удаляются, а информативные участки — экзо-ны соединяются при помощи ферментов лигаз в одну непрерывную последовательность иРНК. Перед выходом из ядра к начальной части иРНК (5'-концу) присоединяется остаток метилированного гуанина, называемый «колпачком», а к концу иРНК (З'-концу) присоединяется примерно 200 остатков адениловой кислоты. В таком виде зрелая иРНК (матричная РНК) проходит через ядерную мембрану в цитоплазму, где соединяется с рибосомой. Считают, что у эукариот «колпачок» иРНК играет роль в связывании с малой субчастицей. Трансляция заключается в том, что последовательность расположения нуклеотидов в иРНК переводится в строго упорядоченную последовательность расположения аминокислот в молекуле синтезируемого белка. Процесс трансляции включает два 87 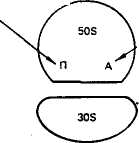 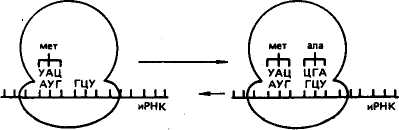 ПЕПТИДИЛЬНЫП ЦЕНТР АМИНОАЦИЛЬНЫЙ ЦЕНТР ПЕПТИДИЛТРАНС-ФЕРАЗА этапа: активирование аминокислот и непосредственно синтез белковой молекулы. Активирование свободных аминокислот и присоединение их к тРНК осуществляются при помощи ферментов аминоацил-тРНК-синтетаз. Точность процесса трансляции зависит, по-видимому, в значительной мере от того, с какой точностью каждая синтета-за выберет одну определенную аминокислоту и присоединит ее к соответствующей тРНК. Считается, что в молекуле каждой ами-ноацил-тРНК-синтетазы имеется по крайней мере три дентра связывания: для аминокислоты, тРНК и АТФ. Сначала осуществляется связь аминоацил-тРНК-синт етазы с определенной чами-нокислотой, а затем активированная аминокислота присоединяется к акцепторному участку (ЦЦА) транспортной РНК. В результате образуется аминоацил-тРНК (аа-тРНК). Нагруженная аминокислотой тРНК взаимодействует с одним из белковых факторов, который в комплексе с ГТФ необходим для транспорта тРНК к рибосоме и связывания с ней. В период трансляции происходит реализация генетической информации в процессе синтеза белковой молекулы определенной структуры. Синтез подразделяется на три стадии: инициации, элонгации и терминации. Инициация. В__период стадии инициации рибосома сначада представлена двумя отдельными субчастицами, так как для начала процесса необходима рибосома диссоциированная. Инициация синтеза полипептидной цепи начинается с присоединения малой субчастицы рибосомы к соответствующему центру связывания на иРНК. Сигналом инициации трансляции служит кодон для метионина АУТ, который расположен в начале иРНК (рис. 21). К кодону АУГ своим антикодоном УАЦ присоединяется тРНК, нагруженная аминокислотой метионином (у бактерий инициаторной является тРНК, которая переносит фор-милметионин). Затем к комплексу, состоящему из малой субъединицы, иРНК и тРНК, присоединяется большая субъединица рибосомы. В результате образуется полностью собранная рибосома (80S), включающая одну молекулу иРНК и инициаторную тРНК с аминокислотой. В большой субъединице имеется аминоацильный и пептидильный центры. Сначала первая аминокислота (метио-нин) попадает в аминоацильный центр. В процессе присоединения большой субчастицы рибосомы иРНК продвигается на один кодон, тРНК из аминоацильного центра перемещается в пептидильный центр. В аминоацильный центр поступает следующий кодон иРНК, который может принять следующую аминоацил-тРНК. С этого момента начинается вторая стадия трансляции. Элонгация. В эту стадию многократно повторяется цикл присоединения аминокислот к растущей полипептидной цепи. Так, в аминоацильный центр рибосомы строго в соответствии с кодо-ном иРНК поступает вторая нагруженная тРНК, которая своим 88 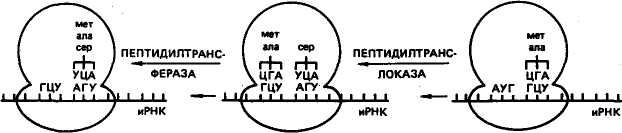 Рис. 21. Схема синтеза белка в клетке: вверху — инициация; внизу — элонгация антикодоном соединяется с комплементарным кодоном иРНК. Сразу же при помощи фермента пептидилтрансферазы предшествующая аминокислота (метионин) своей карбоксильной группой (СООН) соединяется с аминогруппой (NH2) вновь пришедшей аминокислоты. Между ними образуется пептидная связь (—СО—NH—). В результате тРНК, принесшая метионин, освобождается, а в аминоацильном центре к тРНК присоединен уже дипептид. Для дальнейшего процесса элонгации требуется освободить аминоацильный центр. И он освобождается. В результате процесса транслокации дипептидил-тРНК продвигается из аминоацильного центра в пептидильный. Это происходит благодаря перемещению рибосомы на один кодон при участии фермента транслоказы и белкового фактора элонгации. Освободившаяся тРНК и кодон иРНК, который был связан с ней, выходят из рибосомы. В освободившийся аминоацильный центр следующая тРНК приносит аминокислоту в соответствии с поступившим туда кодоном. Эта аминокислота при помощи пептидной связи соединяется с предыдущей. При этом рибосома снова продвигается еще на один кодон, и процесс повторяется. Полипептидный синтез в рибосоме идет до тех пор, пока в аминоацильный центр не поступит терминирующий кодон. Терминация. После того как в аминоацильный центр рибосомы поступит терминирующий кодон иРНК (УАА, УАГ или УГА), к нему присоединяется один из белковых факторов терминации 89 и блокируется дальнейшая элонгация цепи. Полипептидная цепь отделяется от тРНК и рибосомы, освобождаются тРНК и иРНК. Рибосомные субъединицы диссоциируют и могут принять участие в синтезе следующей полипептидной цепи. На одной молекуле иРНК работает не одна рибосома, а многие (до 100). На каждой из рибосом строится полипептидная цепь. У бактерий транскрипция и трансляция связаны между собой и трансляция начинается до завершения синтеза иРНК на ДНК. Образующиеся при синтезе белка полипептидные цепи претерпевают посттрансляционные преобразования и в конечном итоге выполняют специфические функции, принимая участие в определении признаков организма. Ингибиторы синтеза белка. В последние годы был выявлен целый ряд ингибиторов, вызывающих нарушение реализации генетической информации у микроорганизмов. Примером могут служить антибиотики. Одним из мощных ингибиторов является пуромицин. Он имеет структурное сходство с концевым остатком адеймловой кислоты в аминоацил-тРНК, легко взаимодействует с А-участком пептидил-тРНК с образованием пептидилпу-ромицина. Пептидилпуромицин нарушает элонгацию, вызывая обрыв реакции. Предполагается, что стрептомицин и неомицин вызывают ошибки в трансляции иРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами. Например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате образуется аномальный белок, что ведет к гибели бактерий. Тетрациклины являются ингибиторами синтеза белка в 708-рибосоме. Считается, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром рибосом. Синтез клеточной иРНК тормозит антибиотик рифа-мицин, используемый при лечении туберкулеза. Этот препарат тормозяще действует на ДНК-зависимую РНК-полимеразу путем связывания с ней. Наиболее чувствительна к нему бактериальная РНК-полимераза. Недавно обнаружено и противовирусное действие рифамицина. Его используют при лечении трахомы, которая вызывается ДНК-содержащим вирусом. Известно ингиби-рующее действие на синтез белка у микроорганизмов и целого ряда других антибиотиков. Контрольные вопросы. 1. В чем состоит биологическая роль нуклеиновых кислот? 2. Как была доказана роль ДНК в наследственности? 3. Как построена ДНК? 4. Каким образом происходит репликация ДНК? 5. Каковы различия молекул иРНК, рРНК, тРНК? 6. Что такое транскрипция? 7. Что означает термин «трансляция»? 8. Как осуществляется синтез полипептида в рибосомах? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
