Инфекции. ИНФЕКЦИИ. В. В. Макаров, А. К. Петров, Д. А. Васильев основы учения
 Скачать 1.76 Mb. Скачать 1.76 Mb.
|
|
Болезнь Акабане (БАК). Впервые установлена в 1959 г. в Японии. Возбудитель - ортобуньявирус семейства Buniaviridae - поражает беременных коров, овцематок и коз, патогенетической мишенью служат плоды. Переносится мокрецами рода Culicoides, которые эффективно распространяют инфекцию с лета до зимы, в том числе на большие расстояния потоками ветров. Эпизоотически и клинически БАК протекает в виде многочисленных массовых конгенитальных пороков (врожденной мальформации) у телят, а также ягнят и козлят. Рождение сильно деформированных животных с уродливыми конечностями, изменениями мозга, вплоть до отсутствия, редко сопровождается их выживанием. По аналогии с блутангом, при БАК большинство телок инфицируются до первой беременности, и их иммунитет защищает плод от внутриутробного заражения; инфекция развивается только при отсутствии у беременных коров достаточного уровня нейтрализующих антител. При заражении интактных беременных животных вирус размножается и персистирует в трофобластах плацентарных котиледонов и последовательно инвазирует плод, поражает быстро размножающиеся клетки, преимущественно нервной системы и скелетных мышц, вызывая некротизирующий энцефаломиелит и полимиозит. Если плод не погибает, у него существенно нарушается органогенез со структурными последствиями и развивается синдром мальформации - артрогрипоз, гидранэнцефалия, порэнцефалия, микроэнцефалия, гидроцефалия. БАК распространена в виде спорадических вспышек и эпизоотий в Японии, Австралии, Малайзии и на Индийском субконтиненте. Есть очевидные свидетельства присутствия возбудителя на Среднем Востоке (Кипр, Израиль, Турция), где в 1969-1970 гг. произошли крупные эпизоотические вспышки с поражение сотен голов крупного и мелкого рогатого скота. Этим подтверждается вероятность периэкваториального распространения инфекции по аналогии с блутангом и ЭГБО, т.е. везде, где существуют Culicoides. Клиническая же форма инфекции - спорадические вспышки артрогрипоза и гидранэнцефалии телят, ягнят, козлят - регистрируется только в двух крупных регионах мира - Южной Азии от Японии до Австралии и Среднем Востоке до Южной Африки. Болезнь Айно. Возбудитель - тератогенный ортобуньявирус, серологически регистрируемый в Западно-Тихоокеанском регионе от Японии до Австралии в инди- генных популяциях КРС, буйволов, овец и коз, верблюдов, оленей, а также у человека. Инфекция сходна с БАК в отношении трансмиссии Culicoides местных видов, клинических признаков и патогенеза с аналогичным поражением плодов КРС и овец. Клинические формы наблюдаются только в Австралии и Японии. Эпизоотическое проявление значительно меньше, чем БАК. После первичной бессимптомной инфекции инкубационный период развития тератогенных эффектов у коров составляет около 5 месяцев. Болезнь Шмалленберг (БШ). Заболевание возникло в ноябре 2011 г. на северо-западе Европы (Германия, Нидерланды, Бельгия) как эмерджентная эпизоотия новой, неизвестной ранее инфекции КРС, овец и коз, которая сопровождалась врожденными пороками развития плодов и мертворождаемостью. Эпизоотологически появление БШ совпало с признаками возникновения и распространения на северо-запада Европы пятью годами раньше вируса блутанга 8 серотипа (трансмиссивно сть, нозогеография, восприимчивые животные, сезонность). Передача новой инфекции осуществлялась аналогичным вектором - мокрецами рода Culicoides. Возбудителем БШ оказался новый для науки вирус рода ортобуньявирусов семейства Buniaviridae, получивший то же топонимическое название, имеющий природное реассортационное происхождение и генетическое родство с другими представителями рода. Первичные случаи БШ проявлялись как массовое острое переболевание 2070% дойных коров с угнетением, отказом от корма, повышенной температурой (> 40°), снижением продуктивности, иногда диареей, без вовлечения овец. Полная клиническая картина патологии воспроизводства, преимущественно среди овец, регистрировалась через 2-3 месяца - аборты, преждевременные роды, рождение мертвого и нежизнеспособного потомства, тератогенные эффекты мальформации (трясущаяся шея, аномальная кривизна спины, контрак-  Рисунок 17. Врожденные уродства плодов овец при БШ. тура конечностей-артрогрипоз, гидроцефалия, гипоплазия головного мозга, тортиколлис, деформация челюстей, атаксия, асциты грудной и брюшной полостей, параличи, слепота, отеки подкожной клетчатки). В различных случаях количество врожденных уродств составляло от 20 до 50%. Инфекционный цикл был аналогичен таковому при других блутангоподобных заболеваниях - первичное заражение интактных беременных животных, их первичное острое переболевание, затем поражение потомства (рисунок 17). В дальнейшем БШ оказалась широко распространенной во многих странах Европы во все стороны от зоны первичного неблагополучия. Серопозитивность выявлена у КРС, овец, коз, диких жвачных. БШ идентифицирована у потомства собак с нейрологическими расстройствами. Преобладающая серопозитивность отмечена у КРС повсеместно (> 70% в Нидерландах, 90% - в Бельгии). В числе прочих, КРС наиболее восприимчив и является основным хозяином в паразитарной эписистеме БШ аналогично блютангу. Литература. Блютанг и блютангоподобные инфекции (учебное пособие). В.В.Мака- ров, Ф.И.Василевич, О.И.Сухарев. М.: ФГБОУ ВПО МГАВМиБ / РУДН. 2014, 69 с., илл., библ. Atlas of Transboundary Animal Diseases. P.Fernandez, W.White. OIE, 2010. Bluetongue in northern Europe. Ed. Saegerman C. et al. OIE, ULg., 2008, 88 p. Контрольные вопросы. Приведите определение блутанга и охарактеризуйте его ветеринарное значение. В чем сущность природной очаговости блутанга? Какие животные восприимчивы к блутангу? Какова значимость животных разных видов в эпизоотологии блутанга? Каков механизм передачи инфекции при блутанге? Опишите мировое распространение блутанга. Опишите основные особенности симптомов и патогенеза блутанга. Какие животные являются источниками и резервуарами инфекции при блу- танге? Охарактеризуйте сущность трансмиссивного механизма передачи блутан- га. Какое мероприятие лежит в основе контроля блутанга? Какие характеристики блутангоподобных инфекций положены в основу выделения этой категории болезней? Перечислите блутангоподобные инфекции и их основные характеристики. В чем заключается эпизоотологическое значение блутангоподобных инфекций для РФ? В чем выражается тератогенез блутангоподобных инфекций? Является ли экзотическая локализация нозоареалов блутанга и блутанго- подобных инфекций гарантией благополучия стран с умеренным климатом, в частности РФ? Сибирская язва опасна по-прежнему. Маринин Л. И. и др. (2017) СИБИРСКАЯ ЯЗВА3 Свидетельства о болезни, подобной сибирской язве, упоминаются в первых письменных памятниках сельскохозяйственной цивилизации на Ближнем Востоке, датированных 4-5 тысячелетиями до новой эры. Самая же ранняя регистрация заболевания на скоте, принадлежащем фараону в Египте, содержится в папирусе, датированном 1500 г. до н.э. В 30 г. до н.э. впервые описано заражение людей от скота, больного СЯ. Крупные эпизоотии были отражены в документах 14 в. в Германии, 17 в. - в России и Центральной Европе. В 1769 г. впервые сообщено о возникновении СЯ у людей в результате рабочих контактов с инфицированными шкурами и шерстью животных (Jean Fournier). На протяжении многих веков глобальное неблагополучие по СЯ представляло чрезвычайное препятствие для хозяйственно-экономического и, возможно, социального развития человечества. В частности, в Европе, особенно в аграрной Франции к середине 18 века, из-за прогрессирующего увеличения «проклятых полей», выпасаемый скот в массовом порядке подвергался заражению с высокой смертностью и огромными потерями для сельского, преобладающего населения страны. Заболевание стало рассматриваться как фактор кризиса скотоводства и превращаться в национальное бедствие. Именно поэтому, вовсе не случайно, B. anthracis стала первым открытием среди возбудителей заразных болезней (Роберт Кох, 1875), а гениальный Луи Пастер в 18771879 гг. не любопытства ради создал средство специфической профилактики - исторически первую вакцину, полученную экспериментальным, эмпирическим путем, что было своего рода социальным заказом (рисунок 18). Аналогичная ситуация возникла в России в связи с необходимостью освоения Новороссии - обширной малонаселенной степной территории Северного Причерноморья, присоединённой к Российской империи в результате побед в русско-турецких войнах во второй половине 18 века. Без преувеличения можно сказать, судя по массовой многотысячной смертности завозимых туда для разведения овец и КРС, что эти перспективные для сельского хозяйства земли оказались теми же «проклятыми полями», массивно контаминированными  Рисунок 18. Вакцинация овец по методу Пастера. Книжная иллюстрация [regnum.ru]. сибиреязвенными спорами за многовековый период беспорядочного кочевого образа жизни различных населяющих их племен и народов. Проблема была решена аналогичным образом - выдающийся русский ученый Лев Семенович Ценковский в 1882-1884 гг. самостоятельно создал вакцину, аналогичную пастеровской, что позволило безопасно осуществлять не только выпасное животноводство, но и сельское хозяйство в целом. Этот успех явился решающим фактором быстрого социального и экономического развития Новороссии, ставшей впоследствии мощным промышленным районом дореволюционной России и СССР. Глобальной парадигмой в борьбе с СЯ явились разработки уже не на эмпирическом, а научном уровне живых вакцин для предупреждения заболеваемости жвачных животных как критической основы неблагополучия. Успешное применение разработанных в 1930-х гг. Максом Стерном в ЮАР ветеринарной бескапсульной вакцины и, позднее, аналогов в СССР - вакцин СТИ (Н. Н Гинсбург) и ГНКИ (С. Г. Колесов) позволили в последующие два десятилетия резко сократить заболеваемость СЯ во всем мире, в результате чего СЯ по существу перестала рассматриваться как заболевание, имеющее важное медицинское или ветеринарно-экономическое значение. Однако, несмотря на очевидные успехи национальных программ и значительное глобальное снижение эпидемической и эпизоотической напряженности, СЯ по-прежнему с разной степенью интенсивности регистрируется в отдельных районах Канады и США, в некоторых странах Средиземноморья, Центральной и Южной Америки, Центральной Азии, Африки к югу от Сахары, на западе Китая. Спорадические случаи и вспышки систематически происходят в развитом секторе мира, в частности, в скандинавских странах, Франции, Великобритании, Германии, РФ. Возбудитель. Bacillusanthracis - палочковидная бактерия, грамположительная, анаэробная в вегетативной внутриорганизменной стадии, эндоспорообразующая вне организма, размером 4 х 1 мкм, в мазках диагностических образцов тканей при микроскопии выглядит в виде коротких цепочек из двух или более клеток, в мазках из культур - в виде бесконечных нитей, ответственных за характерную слизистость колоний и хлопьевидный вид бульонных культур. Хромосомная ДНК Bac. anthracis очень близка по структуре с ДНК другого представителя бацилл - Bac. cereus. Bac. anthracis - один из самых мономорфных видов микроорганизмов; все изоляты из различных источников или географических зон почти идентичны фенотипически и генотипически, а различия проявляются только в неколичественных или полуколичественных характеристиках (морфологии колоний, LD50 в тестах на лабораторных животных, и т. п.). В присутствии кислорода воздуха, т.е. вне организма, а также к концу экспоненциальной фазы роста каждая бактериальная клетка формирует одну эллипсоидную спору размером 2 х 1 мкм, как правило, расположенную центрально (в этом диагностически важное отличие бацилл от клостридий - других патогенных анаэробионтов, формирующих терминально расположенные споры). В условиях макроорганизма в отсутствие кислорода, при высокой концентрации СО2 и наличии бикарбоната (HCO“) в вегетативной клетке синтезируются полипептиды, при выделении образующие капсулу. Наряду с трехкомпонентным экзотоксином, синтез которого обусловливается трансмиссивными внехромосомными генетическими элементами-плазмидами, капсула является одним из двух факторов вирулентности invivo, установленных у Bac. anthracis, обеспечивая защиту возбудителя от фагоцитоза. Наличие или отсутствие капсулы служит основным дифференцирующим признаком вирулентных и авирулентных вариантов возбудителя. Иллюстрации и пояснения по плазмидной природе вирулентности и морфологии B. anthracis приведены на рисунках 19, 20 и в легендах к ним. Эпизоотологические данные. СЯ в естественных условиях - фатальное, т.е. абсолютно смертельное, заболевание всех млекопитающих. Восприимчивость различных животных к СЯ значительно варьирует, диапазон заражающих доз спор (ЛД50) для животных разных видов распространяется от менее 10 (подкожно) до 10 миллиардов (алиментарно). Болезнь неконтагиозна, т.е. больное животное непосредственным, прямым источником заражения не является. Проявляется в виде спорадических случаев или, реже, вспышек. Относится к природно-очаговым нетрансмиссивным инфекциям почвенного экотипа. Болезнь поражает главным образом травоядных животных и чаще всего представителей жвачных (Ruminantia). На протяжении всей естественной истории, вплоть до настоящего времени, оно получило повсеместное территориальное распространение в мире именно благодаря зоографическому распространению животных этой категории (рисунок 21). Формы течения СЯ у наиболее распространенных животных различают по скорости развития - молниеносная апоплексическая инфекция у овец, острая у КРС и лошадей, хроническая у свиней. Другие домашние животные, в том числе мелкие, и человек обладают относительной резистентностью. Первые признаки вспышки СЯ - внезапная смерть одного или более животных в стаде как неотъемлемый итог патогенеза и этап инфекционного цикла (см. рисунок 22), хотя ретроспективно отмечают некоторые клинические отклонения от нормы (отказ от корма, снижение удоя, опухание в подчелюстной ямке; именно в этой стадии возможна и эффективна этиотропная терапия). У 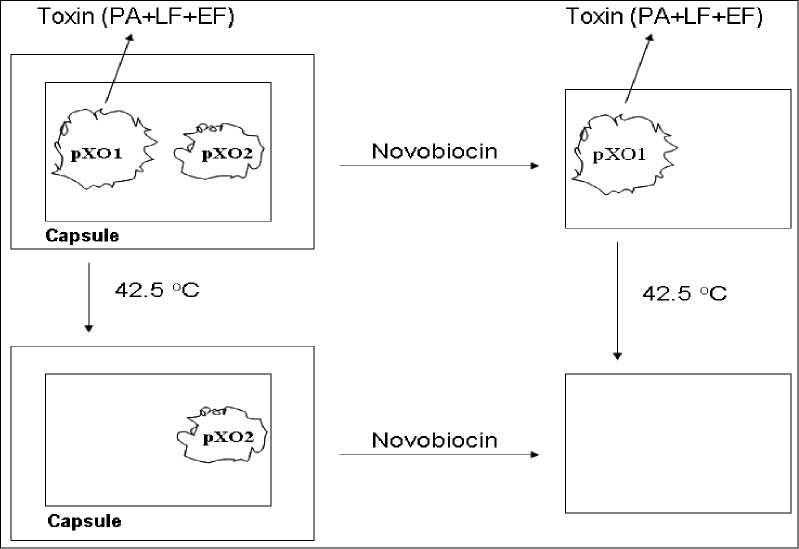 Рисунок 19. Диаграмма, представляющая плазмиды вирулентности Bac. anthracis и результаты их селективного исключения. Плазмида pXO1 кодирует комплекс токсинов, включающий протективный антиген (PA), летальный (LF) и отечный (EF) факторы, плазмида pXO2 - капсульные полипептиды. Вверху слева полноценная бактерия с комплексом факторов вирулентности. Внизу слева - исключение pXO1 культивированием при повышенной температуре приводит к потере способности образования токсинов с сохранением капсу- лообразования (это вакцинный вариант Bac. anthracis пастеровского типа). Вверху справа - исключение pXO2 под действием новобиоцина (антибиотик, блокирующий ДНК-гиразу, фермент, необходимый для репликации ДНК) приводит к отмене капсулообразования (это вариант Bac. anthracis вакцины Стерна). Внизу справа - при воздействии обоих факторов Bac. anthracis может быть «вылечена» от обеих плазмид [Anthrax in humans and animals]. 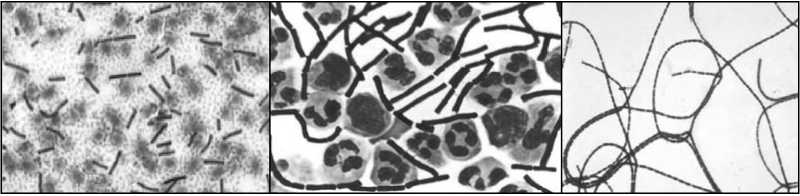 Bac. anthracis в мазках крови на фоне клеточных элементов, в спинно-мозговой жидкости среди полиморфно-ядерных лейкоцитов и чистая бактериальная культура. 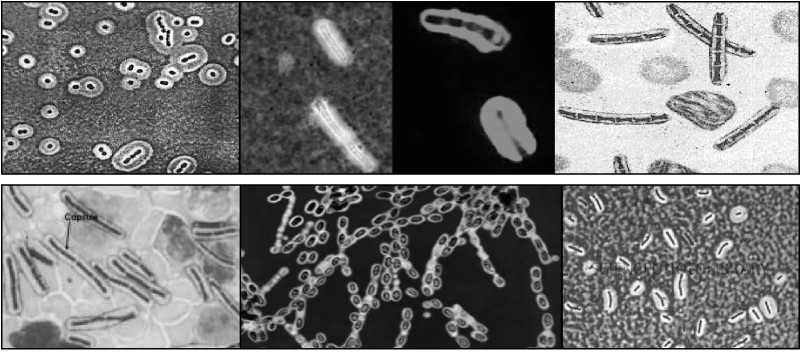 Капсулы Bac. anthracis - нативные и при различном окрашивании. 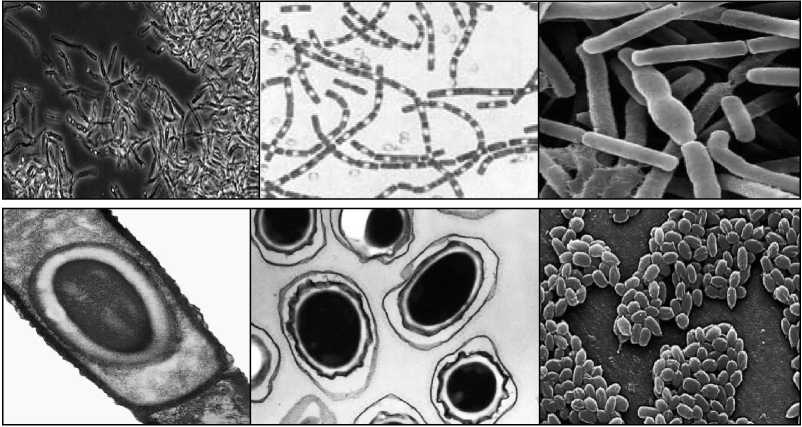 Спорообразование и споры Bac. anthracis. Рисунок 20. Bacillusantracis: вегетативные формы (окрашенные по Граму фиолетовые палочки), капсула, споруляция и споры (световая и электронная микроскопия) [cdc.gov]. животных с высокой восприимчивостью период между появлением видимых симптомов и смертью может составлять всего несколько часов. В таком случае первостепенное значение для немедленного подозрения на СЯ имеет история эпизоотической обстановки в регионе, случаи внезапной смертности, особенно хронологически близкие к землеройным работам (пахота, раскопки, углубление водоемов и т.п.). Наружных карбункулезных поражений, подобных кожной форме СЯ у человека, у животных не регистрируется. Любые инвазивные манипуляции с животными и трупами, подозрительными по заболеванию анаэробными инфекциями, чрезвычайно опасны с точки зрения последующей контаминации спорами возбудителей окружающей среды и законодательно запрещены. Основное внимание в посмертной диагностике уделяется состоянию трупа; признаки, дающие основание подозревать СЯ у КРС и других жвачных, - отсутствие трупного окоченения, чрезмерное прогрессирующее вздутие, выделение крови из отверстий, «лаковая» (несвернувшаяся) кровь. Хроническая форма течения СЯ, характерная для свиней, встречается редко, сопровождается проявлениями фарингеального ангинозного воспалительного процесса в области миндалин, отеком горла и подчелюстного пространства. Иллюстрации павших животных приведены на рисунке 22. По сравнению с травоядными животными плотоядные, как домашние, так и дикие, в естественных условиях проявляют достаточную резистентность к СЯ. Собаки считаются мало восприимчивыми, но регистрируются нередкие   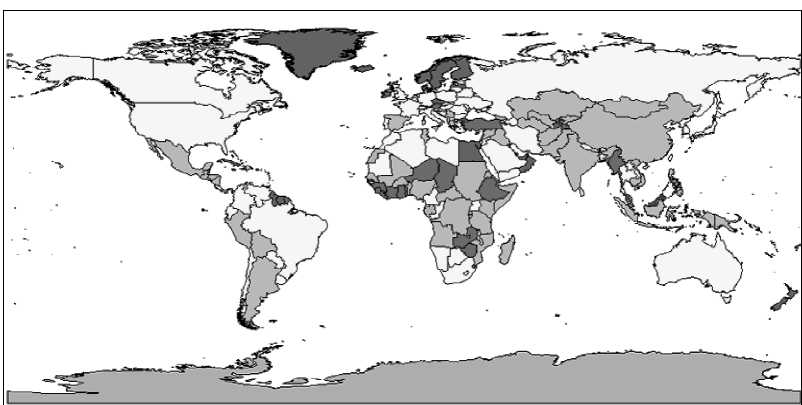 гиперэндемии / эпидемии эндемии спорадическая заболеваемость свободные территории |
