Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
Химические свойства солей При химических реакциях солей проявляются особенности как катионов, так и анионов, входящих в их состав. Катионы металлов, находящиеся в растворах, могут вступать в реакции с другими анионами с образованием нерастворимых соединений. С другой стороны, анионы, входящие в состав солей, могут соединяться с катионами с образованием осадков или малодиссоциированных соединений (или же в окислительно-восстановительные реакции). Таким образом, соли могут реагировать:
4.____________________________________ Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию: H3PO4 + 2KOH K2HPO4 + 2H2O. В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4. С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН. Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1. Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1. Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности: H3PO4 + 3KOH K3PO4 + 3H2O fЭ(H3PO4) = 1/3 H3PO4 + KOH KН2PO4 + H2O fЭ(H3PO4) = 1. Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть. Таблица 1.1 – Расчет фактора эквивалентности
Эквивалент всегда в z раз меньше, чем соответствующая формульная единица, например: 1/2Ca+2, 1/5KMnO4, 1/3Cr(OH)3, … 1/zФЕ. В одной формульной единице вещества содержится z эквивалентов этого вещества. Число z называют эквивалентным числом, z≥1. Определение эквивалентных чисел неодинаково для обменных и окислительно-восстановительных процессов. Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль». Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента (
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
гдеm1 и m2 – массы реагентов и (или) продуктов реакции, г; V1, V2 – объемы реагентов и (или) продуктов реакции, л; Эквивалент в окислительно-восстановительных реакциях Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен: fэкв(X) = где n – число отданных или присоединенных электронов. Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия: 2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O. 2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH. 2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O. В результате получаем следующую схему превращения KMnO4 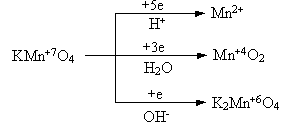 Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1. Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6: Cr2O72 + 6e + 14 H+ = 2 Cr3+ + 7 H2O. 5. Развитие представлений о строении атома. Современные представления о строении атома (квантово-механическая модель); понятие орбитали. Принцип неопределенности, двойственная природа электрона. Атом – наименьшая нейтрально заряженная частица химического элемента, сохраняющая все его свойства. Это сложная микросхема, состоящая из находящихся в движении элементарных частиц. Атом состоит из положительно заряженного ядра, расположенного в центре атома, и отрицательно заряженных электронов. Орбиталь – область атомного пространства, где наиболее вероятно могут находиться электроны. При написании электронно-графических формул ее обозначают клеткой: Число орбиталей на s-подуровне равно 1, на p-подуровне – 3, на d-подуровне – 5. Число орбиталей соответствует числу значений магнитного квантового числа при заданном значении орбитального. Принцип неопределенности Гейзенберга: невозможно одновременно с достаточной точностью определить положение микрочастицы в пространстве и ее импульс. Корпускулярно-волновой дуализм – предположение о двойственной природе элементарных частиц. В 1924г. Де Бройль выдвинул гипотезу, что все микрочастицы, в том числе, электрон, имеют двойственную природу, т.е. обладают некоторыми свойствами дискретных частиц (корпускул) и некоторыми свойствами волн, причем длина волны равна: λ = h/mν где h – постоянная Планка, m – масса частицы, ν – скорость частицы 6._________________ | |||||||||||||||||||||||||||||||||||||||||||

 или
или 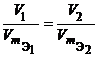 или
или 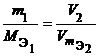 ,
,