Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
1._________________________________ Важнейшие химические понятия и законы Химический элемент – это определенный вид атомов с одинаковым зарядом ядра Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов Молекула – наименьшая частица вещества, обладающая его химическими свойствами, которые определяются ее составом и строением Простые вещества – вещества, состоящие из атомов одного элемента Сложные вещества – вещества, образованные атомами разных элементов Изотопы - разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый заряд ядра (порядковый номер), но при этом разные массовые числа. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числапротонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон). Относительная атомная масса – значение массы атома, выраженное в атомных единицах массы. Определяется как отношение массы атома данного элемента к 1/12 массы нейтрального атома изотопа углерода 12C. Из определения следует, что относительная атомная масса является безразмерной величиной Относительная молекулярная масса – сумма относительных атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Количество вещества – величина, пропорциональная числу формульных единиц, находящихся в данной порции вещества Моль – количество вещества, содержащее 6,02*1023 его частиц (атомов, молекул, ионов и др.) Молярная масса – масса 1 моль вещества (г/моль) Молярный объем (для газообразных веществ) – объем 1 моль вещества (л/моль) Соотношение между величинами Количество вещества – n (В)=N (В)/ NА Молярная масса – М(В) = m (В) / n (В) Молярный объем - Vm = V (газа в-ва) / n (газа в-ва) – при н.у. составляет 22,4 л/моль Плотность газообразного вещества по газу – D (г) = M(В) / M (г), чаще всего рассчитывают по водороду D (H2) = M(В) / M (H2), или по воздуху D (возд) = M(В) / 29 Массовая доля элемента в веществе - ὼ (э) = m / M Стехиометрические законы Закон сохранения массы – масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции Закон постоянства состава – каждое чистое вещество, независимо от способа получения, всегда имеет один и тот же состав и свойства (исключение составляют вещества с атомарной структурой – см. аллотропные модификации) Закон Авогадро – в равных объемах газов при одинаковых условиях содержится одно и то же число частиц (атомов, молекул) Закон эквивалентов - открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
2.___________________________________ Классы неорганических соединений 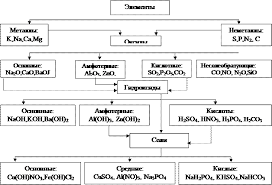 Гидроксиды Среди многоэлементных соединений важную группу составляют гидроксиды. Некоторые из них проявляют свойства оснований (основные гидроксиды) – NaOH, Ba(OH)2 и т.п.; другие проявляют свойства кислот (кислотные гидроксиды) – HNO3, H3PO4 и другие. Существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как свойства оснований, так и свойства кислот – Zn(OH)2, Al(OH) 3 и т.п. Классификация, получение и свойства оснований Основаниями (основными гидроксидами) с позиции теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов ОН-. По современной номенклатуре их принято называть гидроксидами элементов с указанием, если необходимо, валентности элемента (римскими цифрами в скобках): КОН – гидроксид калия, гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, гидроксид хрома (II) – Cr(OH)2, гидроксид хрома (III) – Cr(OH)3. Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами - Li, Na, K, Cs, Rb, Fr, Ca, Sr, Ba и поэтому называемые щелочами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов ОН- в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее, небольшие равновесные концентрации иона ОН- даже в растворах нерастворимых оснований определяют свойства этого класса соединений. По числу гидроксильных групп (кислотность), способных замещаться на кислотный остаток, различают: - однокислотные основания – KOH, NaOH; - двухкислотные основания – Fe(OH)2, Ba(OH)2; - трехкислотные основания – Al(OH)3, Fe(OH)3. Получение оснований 1. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания: CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4, K2SO4 + Ba(OH)2 = 2KOH + BaCO3↓. При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль. При получении нерастворимых в воде оснований, обладающих амфотерными свойствами, следует избегать избытка щелочи, так как может произойти растворение амфотерного основания, например, AlCl3 + 3KOH = Al(OH)3 + 3KCl, Al(OH)3 + KOH = K[Al(OH)4]. В подобных случаях для получения гидроксидов используют гидроксид аммония, в котором амфотерные оксиды не растворяются: AlCl3 + 3NH4OH = Al(OH)3↓ + 3NH4Cl. Гидроксиды серебра, ртути настолько легко распадаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды: 2AgNO3 + 2KOH = Ag2O↓ + H2O + 2KNO3. 2. Щелочи в технике обычно получают электролизом водных растворов хлоридов: 2NaCl + 2H2O = 2NaOH + H2 + Cl2. (суммарная реакция электролиза) Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой: 2Li + 2H2O = 2LiOH + H2↑, SrO + H2O = Sr(OH)2. Химические свойства оснований 1. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов: 2Fe(OH)3 = Fe2O3 + 3H2O, Ca(OH)2 = CaO + H2O. 2. Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания: NaOH + HNO3 = NaNO3 + H2O, Cu(OH)2 + H2SO4 = CuSO4 + 2H2O. 3. Щелочи взаимодействуют с кислотными и с амфотерными оксидами: 2KOH + CO2 = K2CO3 + H2O, 2NaOH + Al2O3 = 2NaAlO2 + H2O. 4. Основания могут вступать в реакцию с кислыми солями: 2NaHSO3 + 2KOH = Na2SO3 + K2SO3 +2H2O, Ca(HCO3)2 + Ba(OH)2 = BaCO3↓ + CaCO3 + 2H2O. Cu(OH)2 + 2NaHSO4 = CuSO4 + Na2SO4 +2H2O. 5. Необходимо особенно подчеркнуть способность растворов щелочей реагировать с некоторыми неметаллами (галогенами, серой, белым фосфором, кремнием): 2NaOH + Cl2 = NaCl +NaOCl + H2O (на холоду), 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O (при нагревании), 6KOH + 3S = K2SO3 + 2K2S + 3H2O, 3KOH + 4P + 3H2O = PH3↑ + 3KH2PO2, 2NaOH + Si + H2O = Na2SiO3 + 2H2↑. 6. Кроме того, концентрированные растворы щелочей при нагревании способны растворять также и некоторые металлы (те, соединения которых обладают амфотерными свойствами): 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑, Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2↑. Растворы щелочей имеют рН > 7 (щелочная среда), изменяют окраску индикаторов (лакмус – синяя, фенолфталеин – фиолетовая). 3._________________________________ Соли Наиболее сложными среди неорганических соединений являются соли. Они очень разнообразны по составу. Их делят на средние, кислые, основные, двойные, комплексные, смешанные. Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода и гидроксид-ионы. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов (или группами атомов): H2SO4 → NaHSO4 → Na2SO4, Или как продукты замещения гидроксогрупп в основном гидроксиде кислотными остатками: Zn(OH)2 → ZnOHCl → ZnCl2. При полном замещении получаются средние (или нормальные) соли: Ca(OH)2 + H2SO4 = CaSO4 + 2H2O. При растворении средних солей образуются катионы металла и анионы кислотного остатка: Na2SO4 →2Na+ + SO42. При неполном замещении водорода кислоты получаются кислые соли: NaOH + H2CO3 = NaHCO3 + H2O. При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного остатка, в том числе ионы Н+: NaHCO3 →Na+ + HCO3 HCO3 При неполном замещении гидроксогрупп основания - основные соли: Mg(OH)2 + HBr = Mg(OH)Br + H2O. При растворении основных солей в растворе образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН: Mg(OH)Br → (MgOH)+ + Br , (MgOH)+ Таким образом, в соответствии с данным определением, соли делятся на средние, кислые и основные. Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и один анион: CaCO3MgCO3 (доломит), KCl∙NaCl (сильвинит), KAl(SO4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: CaOCl2 (или CaCl(OCl)) – кальциевая соль соляной и хлорноватистой (HOCl) кислот (хлорид-гипохлорит кальция). Комплексные соли содержат комплексные катионы или анионы: K3+[Fe(CN)6]−3, K4+[Fe(CN)6]−4, [Cr(H2O)5Cl]2+Cl2−. Согласно современным номенклатурным правилам, названия солей образуются из названия аниона в именительном падеже и названия катиона в родительном падеже. Например FeS - сульфид железа (II), Fe2(SO4)3 - сульфат железа (III). Атом водорода, входящий в состав кислой соли, обозначается приставкой гидро- (NaHSO3 –гидросульфит натрия), а группа ОН – приставкой гидроксо- (Al(OH)2Cl – дигидроксохлорид алюминия). Получение солей Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса.  1. Взаимодействие основных, кислотных и амфотерных оксидов друг с другом: BaO + SiO2 = BaSiO3, MgO + Al2O3 = Mg(AlO2)2, SO3 + Na2O = Na2SO4, P2O5 + Al2O3 = 2AlPO4. 2. Взаимодействие оксидов с гидроксидами (с кислотами и основаниями): ZnO + H2SO4 = ZnSO4 + H2O, CO2 + 2KOH = K2CO3 + H2O, 2NaOH + Al2O3 = 2NaAlO2 + H2O. 3. Взаимодействие оснований со средними и кислыми солями: CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4, K2SO4 + Ba(OH)2 = 2KOH + BaSO4↓. 2NaHSO3 + 2KOH = Na2SO3 + K2SO3 +2H2O, Ca(HCO3)2 + Ba(OH)2 = BaCO3↓ + CaCO3↓ + 2H2O. Cu(OH)2 + 2NaHSO4 = CuSO4 + Na2SO4 +2H2O. 4. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов: 2Mg + Cl2 = MgCl2. |

 или
или 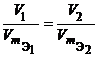 или
или 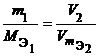 ,
,