Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
12. Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы. Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора. 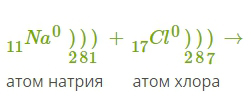 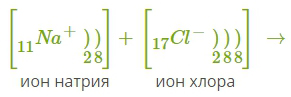 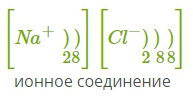 Na0+Cl0→Na++Cl−→Na++Cl− Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются. Свойства веществ с ионной связью 1) Прочные и Твердые, Есв = 500÷1000 кДж/моль; 2) Хрупкие - не выдерживают воздействий, приводящих к смещению ионных слоев; 3) Не проводят эл ток и тепло (с твердом состоянии), т.к нет свободных электронов Металлическая связь - Связь металлов и сплавов за счет электронного взаимодействия свободных е- и положительно заряженных катионов металлов. Особые свойства: Металлическая связь, как и ионная,ненасыщена и ненаправлена, так как это взаимодействие катионов и электронов. Свойствавеществ с ме.связью: прочность, твердость, агрегатное состояние, tкипения, tплавления зависят от числа валентных электронов. Межмолекулярные взаимодействия. Силы Ван-дер-Ваальса (ориентационное, индукционное, дисперсионное взаимодействия). Водородная связь. Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей. Ван-дер-Ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим приполяризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году. К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул. Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами. Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий: Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями. Дисперсионное притяжение. Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. Водородной связью называют химическую связь между атомами водорода одной молекулы ( или ее части) и атомами наиболее электроотрицательных элементов (фтор , кислород , азот) другой молекулы (или ее части) . Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры). Агрегатные состояния веществ. Понятие о кристаллической решетке. Типы кристаллических решеток, свойства веществ, связанные с ними (с примерами). Агрегатные состояния веществ: Газообразное: молекулы находятся на значительном расстоянии друг от друга, практически не взаимодействуют, хаотично движутся. Структура неупорядоченная. Жидкое: молекулы занимают фиксированный объем, в некоторой системе упорядоченные, в сравнении с газами расстояние между молекулами меньше, молекулы постоянно в броуновском движении. Твердое: частицы максимально сближаются друг с другом, образуют прочные связи, движение частиц почти отсутствует, структура высокоупорядоченная, частицы регулярно расположены в пространстве, образуя кристаллическую решетку. Кристаллическая решетка - твердое состояние вещества, при котором частицы находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Типы кристаллических решеток, свойства веществ, связанные с ними: Ионная: в узлах положительно и отрицательно заряженные ионы, удерживаемые силами электростатического притяжения. Обычно диэлектрики с высокой температурой плавления, в расплавленном состоянии проводят ток. Пример: NaCl Металлическая: в узлах катионы металла, а между уздами движущийся электронный газ. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость. Пример: Na, Zn, Mg Атомная: в узлах атомы ковалентно связанные с друг с другом. Высокопрочные, твердые. Пример: алмаз, кремний Молекулярная: в узлах молекулы, соединенные межмолекулярными силами, удерживаются незначительно. Пример: в основном газы и органические соединения. Гибридизация атомных орбиталей при образовании химической связи. Типы гибридизации. Пространственная структура и полярность молекул (на конкретных примерах). Гибридизация атомных орбиталей – перераспределение электронных плотностей близких по энергии орбиталей, которое приводит к их равноценности. Из разных по форме и энергии атомных орбиталей образуется гибридные. Эти орбитали с неравномерно распределенной электронной плотностью, одинаковы по форме и энергии, причем их ориентация в пространстве отличаются от ориентации исходных. они имеют форму, близкую к неправильной объемной восьмерке
Главное преимущество гибридных орбиталей – более глубокое перекрывание с орбиталями соединяющих атомов, образование более прочных связей, что проводит к более выгодному низкому энергетическому состоянию образовавшейся молекулы. гибридизация требует затрат энергии, компенсировать которую может только химическая реакция. 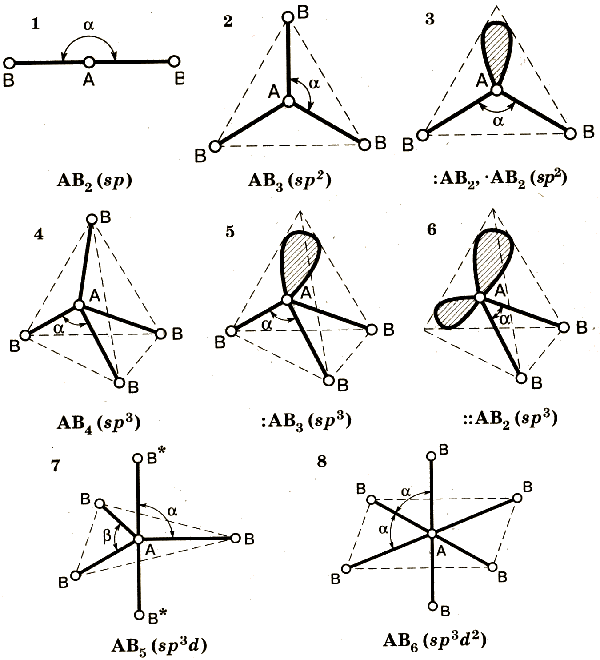 Полярность молекул – степень смещения электронной плотности связи к более электроотрицательному атому. Степень полярности характеризуется дипольным моментом μ, равный произведению элементарного заряда на длину диполя μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы. Если молекула образована атомами одного и того же элемента (например, N2, O2, Cl2 и т.п.), то она неполярна, поскольку электроотрицательность одинаковых атомов также одинакова. Поэтому смещения электронной плотности к одному из них в данном случае быть не может. (дипольный момент равен 0)  16.Строение комплексных соединений (на примерах). Комплементраность. Диссоциация комплексных соединений. Константа нестойкости. Комплексное соединение – это молекулярные соединения, образующие комплексные ионные, в которых имеется хотя бы одна связь, образованная по донорно – акцепторному механизму, и способные к существованию как в растворе, так и в кристалле. В комплексных соединениях различаются внутреннюю и внешнюю сферы, например: 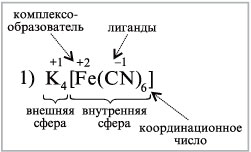 Между внутренней и внешней сферой реализуется ионная связь, а во внутренней сфере – ковалентная. Внутренняя сфера от внешней отделена при написании квадратными скобками . Комплексообразователь – центральный атом или ион во внутренней сфере комплексного соединения. обычно в качестве комплексного- образователя выступают ионы d и f элементов (переходных металлов) Fe, Ag, Au, Cu, Zn, Co, Ni, и др .Комплексообразователь располагают в центре схемы комплексного соединения . Координациионное число комплексообразователя - число монодентатных лигандов, распложенных около центрального атома. 95 % всех комплексных соединений имеют КЧ 4 и 6. В зависимости от КЧ молекулы комплексов имеют определенную геометрическую конфигурацию – линейную, плоскую, тетраэдрическую, октаэдрическаю и др. Кратность связи – это число электронных пар, которые осуществляют связь между атомами. чем выше кратность, тем прочнее связь Лиганды (L)- нейтральные молекулы или ионы, которые координированы вокруг комплексообразователя, например: а) нейтральные молекулы – NH3 . H2O . CO б) ионы :Cl ̄ , Br ̄ , I ̄ , CN ̄ , SO4 ̄ Лигандами могут быть: а) полярные молекулы – NH3, Н2О, CO, NO; б) простые ионы – F–, Cl–, Br–, I–, H–, H+; в) сложные ионы – CN–, SCN–, NO2–, OH– Комплементраность – пространственная взаимодополняемость молекул или их частей, приводящая к образованию водородных связей. Диссоциация комплексных соединений. Комплексные соединения диссоциируют в растворах как сильные электролиты на ионы внешней сферы и внутреннюю сферу (комплексный ион). Это - первичная диссоциациякомплексных соединений. Она протекает одноступенчато и необратимо. Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это - вторичная диссоциациякомплексных ионов. Константа нестойкости – показывает какая доля из числа комплексных ионов продиссоциировала (распалась на ионы). Вопрос 17 Классификация и номенклатура комплексных соединений (с примерами). Значение комплексных соединений. Комплексные соединения классифицируют: По электрическому заряду комплекса: Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например [Cu(NH3)4]2+, [Ni(H2O)4]2+ Анионные комплексы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, [Zn(CN)4]2-, [PF6]-, [Al(OH)4]- Нейтральные комплексы имеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул. Например, [Ni(CO)4], [Pt(NH3)2Cl2]. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды: В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают: Монодентантные (одна орбиталь), например NH3, Cl- Бидентантные, например N2H4 или En (молекула этилендиамина H2N—CH2—CH2—H2N) Полидентантые, например кислота (ЕДТА), являющаяся шестидентантным лигандом 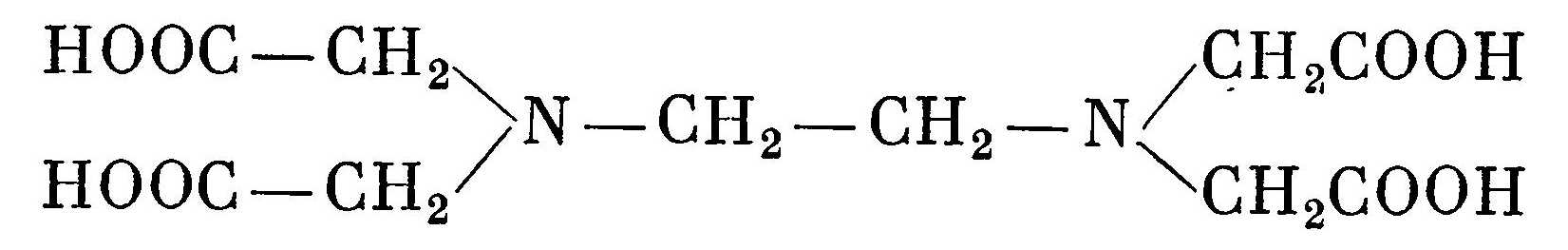 По количеству комплексообразователей Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2] Многоядерные — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6] По типу лиганда Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2 Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4], . Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43–и др., а также ОН–). Например, K4[Ni(CN)6], Na2[FeCl4] Гидроксокомплексы— комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]  Значение комплексных соединений Коплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами, например макроцикл порфин. Комплексы с участием порфина называют порфиринами. Они отличаются друг от друга комплексообразователями. В зелёном катализаторе фотосинтеза - хлорофилле роль комплесообразователя выполняет магний. Макроциклический комплекс железа входит в состав гемоглобина. Сложные лиганды широко используются в аналитической химии, в энергетике для очистки парогенераторов от накипи, в медицине - для очистки почек от камней, для выведения ядов из организма, в химии как катализаторы некоторых реакций, например восстановления кислорода. |
