Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
35. Ионное произведение воды. pH. Индикаторы. Буферные растворы. Ионное произведение воды При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе. 2H2O ↔ H3O+ + OH— Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+заменить на H+ H2O ↔ H+ + OH— Запишем выражение для константы равновесия, опираясь на закон действия масс: K = [H+]·[OH—]/[H2O] Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды: KН2О = [H+]·[OH—] При температуре 25ºС KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений. KН2О = [H+]·[OH—] = 1·10-14 При повышении температуры ионное произведение воды сильно возрастает. Полученное выражение применимо не только к чистой воде, но и к растворам. Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14) Водородный показатель pH Кислотно – основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H+] и [OH—] — переменные, то по их величинам можно говорить о кислотности или щелочности раствора. При нейтральном характере раствора, т.е. [H+] = [OH—], получаем следующее: [H+] = [OH—] = (KН2О)1/2 = (1·10-14)1/2 = 10-7 М Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона. Выражение характера среды данным способом информативно, но сопряжено с некоторыми трудностями в случае выражения небольших значений концентрации иона водорода. Более удобно пользоваться отрицательным логарифмом этой величины, называемой водородным показателем pH: pH = -lg[H+] = lg (1/[H+]) Отметим, что изменению [H+] в 10 раз соответствует изменение pH всего на 1 единицу. pOH = -lg[OH—] = lg (1/[OH—]) pH и pOH нейтрального раствора равен 7: pH = -lg[H+] = -lg(1·10-7) = 7
На следующем рисунке наглядно показано зависимость характера среды от величины pH 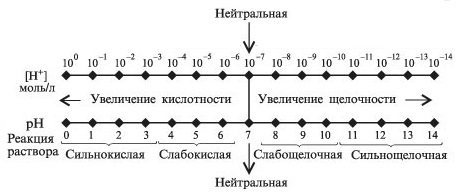 шкала pH шкала pHВсе рассмотренные нами представления об ионном произведении воды справедливы для случая диссоциации химически чистой воды. Если же равновесные концентрации H+ или ОH— составляют большие величины, то ионное произведение воды выражается формулой: aH+aOH— = K`H2O где aH+ и aOH— — соответственно активности ионов водорода и ионов гидроксила; K`H2O — истинная константа, значение которой не зависит от величины ионной силы раствора. Учитывая, что aH+ = [H+] · fH+ , aOH— = [OH—] · fOH— преобразуем выражение: [H+]·[OH—] = K`H2O/(fH+· fOH— ) где fH+· fOH— — коэффициенты активности Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. Далее приведены некоторые индикаторы и зависимость изменения их окраски от концентрации ионов водорода. 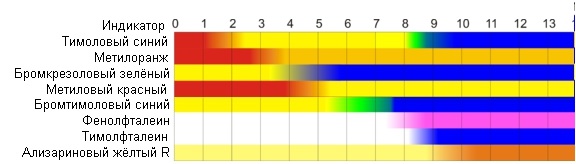 изменение окраски индикатора в зависимости от характера среды изменение окраски индикатора в зависимости от характера средыБуферные растворы — растворы с определённой устойчивой концентрацией водородных ионов. рН буферных растворов мало изменяется при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании 36. Растворы малорастворимых электролитов. Растворимость. Произведение растворимости. Условие образования осадков малорастворимых электролитов. Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе, есть величина постоянная при данной температуре и называется произведением растворимости (ПР). Для вещества состава AnBm произведение растворимости вычисляется по формуле: ПР = (aAz+)n · (aBx-)m , где: aAz+ - коэффициент активности иона Az+; aBx- - коэффициент активности иона Bx-. Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности ионов мало отличаются от единицы. В подобных случаях произведение активностей ионов в выражении для вычисления ПР можно заменить произведением их концентраций и формула расчета произведения растворимости для вещества состава AnBm может быть записана в виде: ПР = [Az+]n · [Bx-]m , где: [Az+] - концентрация иона Az+; [Bx-] - концентрация иона Bx-. При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Напротив, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР. Добавление в раствор электролита, не имеющего общих ионов с малорастворимым, приводит к увеличению растворимости малорастворимого электролита за счет увеличения ионой силы раствора (так называемый солевой эффект). Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Произведе́ние раствори́мости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости— величина постоянная. В общем случае условие образования осадка малорастворимого сильного электролита КnАm, состоящего из п катионов Кm+ и танионов An- , имеет вид: cn(Кm+)сm(An-)> т. е. ионное произведение должно быть больше произведения растворимости сильного малорастворимого электролита. Если ионное произведение меньше произведения растворимости, то осадок не выпадает. Вопрос 37 Гидролиз солей. Виды гидролиза(на примерах). Способы смещения равновесия процесса гидролиза. Гидролиз – обменное взаимодействие соли с водой приводящее к образованию слабого электролита и смещающее равновесие диссоциации воды, что сказывается на хар-ре среды. Любую соль можно представить, как продукт взаимодействия к-ты и основания. Слаб к-та(HCN, HNO2, H2S, H2CO3) (HCl, HBr, HI, HNO3, H2SO4, HCClO4) Слаб осн (NH4OH, Mn(OH)2, Al(OH)2), Сильн осн (NaOH, Ba(OH)2, KOH). 1тип Слаб к-та+ сильн осн-гидролиз по аниону 1)KCN=KOH+HCN-сл к-та. 2) KCN=K++CN- 3) Гидролиз: a)CN+ HOH=HCN (слаб к-та)+ OH-(pH>7) Сокр ион ур-е гидролиза отображает мех-м процесса (слаб к-та-щел среда-вывод гидролиз по аниону) б)K++CN-+H2O=HCN+OH++K+ в) KCN+H2O=HCN+KOH –молек. Ур-е гидролиза. 2тип слаб осн+ сильн к-та –гидролиз по катиону. 3тип Слаб к-та+слаб осн – гидр по кат и аниону одновременно 4тип сильн к-та+сильн осн - не подверг гидролизу. Ступ гидролиз: Если гидролиз подвергается многозарядн ион,то проц идет по ступеням.Число ступеней равно заряду иона.Посл ступень практич не идет. При ступ гидр по аниону- образ кислые соли и среда становится щелочной. Вопрос 38 Степень и константа гтдролиза .Определение рН растворов гидролизующихся солей,образованных кислотами и основаниями разной силы (на примерах). Колич хар-ка гидролиза β=Cгидр ион/С –степ гидр, Конст гидр – КГ =КВ/Кдис слаб к-ты. An-+HOH=HАn(сл к-та)+OH- - Ур-е гидр по аниону в общ виде. КР=[НAn][OH-]/[An-][H2o] – const KP[H2O]=KГ =[HAn][OH-]/[An-] [OH-]=KB[H+] K=[HAn]KB/[An-][H+] –перв конст дис. При гидр по аниону: КГ =КВ/Кдис слаб к-ты. При расч Кг по 1й ступени в ф-лу подставляется Кд по последн ступени. Степень гидр β=Cгидр ион/С Кг=Сβ2 β=√(Кг/С)= √(КВ)/(КСЛ. К-ТЫ*С) Зв-ть для конст гидролиза и степени гидролиза при гидролизе по катиону и аниону, выводится аналогично. Влияет на гидролиз – Т,С. 1.Расчет рН в растворах сильных кислот и оснований. Расчет рН в растворах сильных одноосновных кислот и оснований проводят по формулам: рН = - lg Cк и рН =14 + lg Со Где Cк , Со –молярная концентрация кислоты или основания, моль/л 2.Расчет рН в растворах слабых кислот и оснований Расчет рН в растворах слабых одноосновных кислот и оснований проводят по формулам:рН = 1/2 (рКк – lgCк) и рН = 14 - 1/2( рКО - lg CО) 3.Расчет рН в растворах гидролизующихся солей Различают 3 случая гидролиза солей: а) гидролиз соли по аниону ( соль образована слабой кислотой и сильным основанием, например CH3COO Na). Значение рН рассчитывают по формуле: рН = 7 + 1/2 рКк + 1/2 lg Сс б) гидролиз соли по катиону ( соль образована слабым основанием и сильной кислотой, например NH4Cl ).Расчет рН в таком растворе ведут по формуле : рН = 7 - 1/2 рКо - 1/2 lg Сс в) гидролиз соли по катиону и аниону ( соль образована слабой кислотой и слабым основанием, например CH3COO NH4 ). В этом случае расчет рН ведут по формуле : рН = 7 + 1/2 рКк - 1/2 рКо Если соль образована слабой многоосновной кислотой или слабым многопротонным основанием, то в перечисленные выше формулы (7-9) расчета рН подставляются значения рКк и рКо по последней ступени диссоциации Вопрос 39 Окислительно-восстановительные свойства веществ, их обоснование с точки зрения строения атома (на примерах). Степень оскисления.Типы ОВР (с примерами). Метод электронного баланса (на примере). ОВР – р-и в к-х имеет место изменение степеней окисления взаимодействующих атомов Степень окисления – формальный заряд на атоме, вычисленный из предположения, что молекула состоят из ионов. СО Н=+1,искл гидроксиды щелочных металлов NaH- О=-2, искл Н2О2-1, +2ОF2. Окислитель – если взял электрон и восстановился. Типичные окислители О2, галогены, элементы в высших степенях окисления. Восстановитель – если отдал электрон и сам окислился. Типичные восстановители – металлы, водород, элементы в низших степенях окисления. СО min= № группы-8 СО max=№ группы Типы ОВР: 1.Межмолекулярные ОВР протекает в разных молекулах. 2Al+3Cl=2AlCl3. 2.Внутримолекулярное ОВР – разные атомы внутри 1й молекулы. 2KClO3=2KCl+3O2 3.Диспропорционирования (самок-я/вос-я) – атомы одного элемента Cl2+H2O=YCl+HClO. Если расположить в порядке возрастания СО азота, то получим ряд: NH3 N2H4 N2 N2O NO N2O3(HNO2) NO2 HNO3 (влево-вос-е, вправо-ок-е.) Элемент в низшей СО – только восстановитель, элемент в высшей СО – только окислитель, элементы в промежуточных СО м.б либо окислителем, либо восстановителем, в зависимости от партнера в р-и С сильным ок-м – восстановитель, с сильным вос-м – окислитель. Мет с HNO3 – не выдел водород. Отметим, что иногда ок-ль расходуется не только на ОВР, но и на Солеобразование. Тогда уравнивание идет с прав части Ур-я с учетом расхода на солеобразование. Степень окисления – формальный заряд на атоме, вычисленный из предположения, что молекула состоят из ионов. СО Н=+1,искл гидроксиды щелочных металлов NaH- О=-2, искл Н2О2-1, +2ОF2. Метод электронного баланса :Be + HNO3 → Be(NO3)2 + NO + H2O Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2 Be0 - 2e = Be+2 (коэффициент 3) N+5 +3e = N+2 (коэффициент 2) 3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O Вопрос 40 Общие закономерности электрохимических процессов. Возникновение электродного потенциала. Шкала стандартных электродных потенциалов. Зависимость электродных потенциалов металлических и газовых электродов от факторов среды. Уравнение Нернста. Изменение активностей ионов в анодной и катодной зонах при работе ГЭ (на примере). Электрохимические процессы - это окислительно-восстановительные процессы, сопровождающиеся протеканием электрического тока и взаимным превращением химической и электрической форм энергии. К ним относятся процессы, протекающие в гальванических элементах, а также электролиз и электрохимическая коррозия металлов. Электролиз – это электрохимический процесс, протекающий на электродах, погруженных в раствор или расплав электролита, по действием постоянного электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Электродный потенциал – разность потенциалов между металлом и раствором, обусловленная возникновением двойного электрического слоя. Абсолютное значение электродного потенциала не измеряют, а определяют потенциал относительно эталонного электрода (электрода сравнения), для чего используют стандартный водородный электрод, потенциал которого принят равным 0. Электродный потенциал, измеренный при нормальном атмосферном давлении, температуре 298К и активности ионов металла в растворе 1 моль/л , называют стандартным электродным потенциалом и обозначают Еᵒ. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электронным потенциалом -  . .Электрохимический ряд напряжения – последовательность расположения электродов в порядке возрастания стандартного электродного потенциала. С увеличением потенциала активность металлов уменьшается, окислительная способность их ионов увеличивается. Металлы с более отрицательным потенциалом могут вытеснять металлы с менее отрицательным потенциалом из растворов их солей. Металлы, потенциал которых меньше, чем у водородного электрода, реагируют с растворами кислот с вытеснением водорода. Типы электродов Необратимые – изменение направления эл.тока влияет на процесс.Серебряная пластинка в р-ре кислоты. Обратимые – изменение направления эл.тока не влияет на процесс. Серебряная пластинка в р-ре нитрата серебра. В зависимости от свойств в-в и свойств заряженных частиц обратимые электроды подразделяются: Электроды 1го рода а) Металлическая пластинка в р-ре своей соли.б) Амальгамные электроды – металл в ртути.(Элемент Вестана) в) Газовые электроды: водородный, кислородный. Электроды 2го рода – металлическая пластинка. Покрытая слоем малорастворимого в-ва этого металла, погруженная в насыщенный раствор соли,содержащей одноименный анион с осадком. Имеют постоянный потенциал. ОВ-электрод Платиновая проволока, контактирующая одновременно с окислительно-восстановительной парой. Как отмечалось выше, знак и величина потенциала зависят от положения равновесия между металлом и раствором. Электродный потенциал зависит от следующих основных факторов: От природы металла. Чем большей химической активностью обладает данный металл, т. е. чем легче он растворяется, тем в большей степени равновесие смещено вправо – тем отрицательнее потенциал. От концентрации ионов металла в растворе. Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие смещается влево, и потенциал становится более положительным. От температуры. С повышением температуры потенциал становится более положительным, т. е. равновесие смещается влево. Чтобы понять причины этого эффекта, необходимо учесть, что переход ионов в раствор связан с гидратацией, а гидратация – процесс экзотермический (действие принципа Ле Шателье). Уравнение Нернста: где Если в формулу Нернста подставить числовые значения констант Про изменение на аноде и катоде: Среда меняется… на одном из электродов среда становится кислой а на другой щелочной. 41. 42. |
