Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
Для количественной характеристики основности соединения в водном растворе служит константа равновесия K реакции:
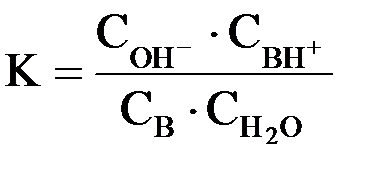 С учетом того, что 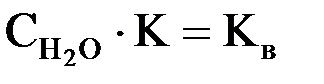 (константа основности), можно записать: (константа основности), можно записать: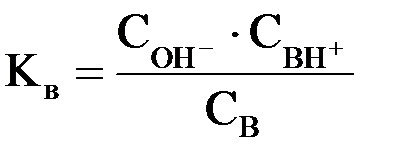 Для оценки силы слабых оснований, как и в случае слабых кислот, также удобнее применять не значение Kв, а ее отрицательный десятичный логарифм: pKв = –lg Kв На практике для оценки основных свойств соединения часто вместо Kв (pKв) используют величину Ka (pKa) сопряженной данному основанию кислоты ВН+: 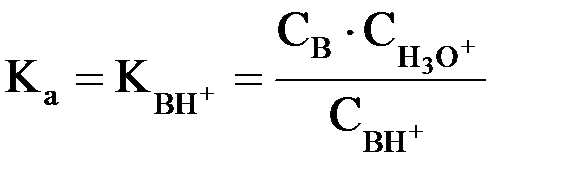 Например, мерой основности NH3 служит величина Ka иона аммония NH4+ (сопряженной аммиаку кислоты): NH4+ + H2O ↔ NH3 + H3O+ 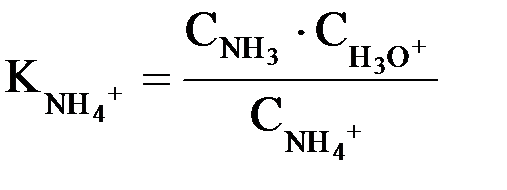 Чем меньше значение 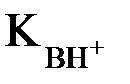 , тем более сильным является основание. , тем более сильным является основание.Для кислоты и сопряженного ей основания в разбавленном водном растворе справедливо равенство: Kw = Ka · Kв где Kw – ионное произведение воды. Кислотные свойства вещества в растворе зависят не только от его способности отдавать ион Н+, но и от способности молекул растворителя его принять. Так, хлороводород при растворении в воде практически полностью распадается на ионы, а его растворы в бензоле, наоборот, не содержат ионов и не проводят электрический ток. Чем больше у растворителя сродство к протону, тем легче диссоциирует в нем кислота. Растворители с ярко выраженным сродством к ионам Н+ называются протофильными. В таких растворителях (жидкий NH3, гидразин) даже очень слабые в водных растворах кислоты – HCN, H2S – являются сильными. Растворители, обладающие гораздо большей способностью к отдаче протона, чем к его присоединению, называются протогенными. К ним относятся: ледяная уксусная кислота, концентрированная (100%) H2SO4 и др. В их среде затрудняется диссоциация кислот, но облегчается ионизация оснований. Растворители, обладающие сравнимой способностью к присоединению или отдаче ионов Н+, называются амфипротными. К ним относятся Н2О, насыщенные одноатомные спирты (СН3ОН, С2Н5ОН) и т.д.). Существуют также апротонные или инертные растворители: бензол, толуол, CCl4, дихлорэтан и др. Способность присоединять или отщеплять от себя ион Н+ у них выражена крайне слабо. В их среде кислоты и основания практически не диссоциируют. Таким образом, в теории кислот и оснований Бренстеда-Лоури понятия кислоты и основания относятся лишь к функции, которую выполняет рассматриваемое соединение в том или ином процессе. Одно и то же вещество может в одних условиях проявлять себя как кислота, а в других – как основание. Например, в водных растворах СН3СООН ведет себя как кислота: СН3СООН + Н2О ↔ СН3СОО– + Н3О+ а в 100% H2SO4 – как основание СН3СООН + H2SO4 ↔ HSO4– + СН3СООН2+ Таким образом, в системе из двух способных взаимодействовать с протоном веществ основанием всегда служит то, которое его прочнее связывает, т.е. характеризуется большим протонным сродством. Все реакции кислотно-основного взаимодействия (ионизации, нейтрализации, гидролиза), согласно теории Бренстеда-Лоури, состоят в обратимом переносе протона от кислоты к основанию, вследствие чего их часто называют протолитическими. В результате такого взаимодействия образуется пара новых частиц, одна из которых опять способна отдавать протон (сопряженная кислота), а другая – его присоединять (сопряженное основание). Таким образом кислота оказывается в равновесии с сопряженным основанием, а основание – с сопряженной кислотой:
Данный процесс называется кислотно-основным равновесием. До наступления равновесия он преимущественно протекает в сторону образования более слабой кислоты и основания. Рассмотрим примеры некоторых протолитических реакций. 1. Реакция ионизации:
Реакция, протекающая в прямом направлении, является реакцией ионизации уксусной кислоты, а в обратном направлении – реакцией нейтрализации основания (ацетат-иона) кислотой. Равновесие данного обратимого процесса в значительной степени смещено влево, т.к. СН3СООН и Н2О являются более слабыми кислотой и основанием, чем Н3О+ и СН3СОО– (табл. 13). 2. Реакция гидролиза:
Данная прямая реакция является реакцией гидролиза ацетат-иона, а обратная – реакцией нейтрализации уксусной кислоты сильным основанием ОН–. Более слабыми кислотой и основанием являются Н2О и СН3СОО– (табл. 13) и поэтому в данном обратимом процессе обратная реакция превалирует над прямой. Теория Бренстеда-Лоури хоть и является более совершенной, чем теория Аррениуса, однако тоже имеет определенные недостатки, и не является всеобъемлющей. Так, она не применима ко многим веществам, проявляющим функцию кислоты, но не содержащим в своем составе ионов Н+, например: BCl3, AlCl3, BF3, FeCl3 и др. В 1923 г. Г.Н. Льюисом была выдвинута электронная теория кислот и оснований, в которой кислотные свойства соединения вообще не связываются с наличием в нем ионов водорода. Гильберт Нильтон Льюис (1875 – 1946).Американский физикохимик. Его работы связаны с химической термодинамикой и теорией строения вещества. Ввел в термодинамике понятие активности, разработал теорию обобщенных электронных пар в моделях ковалентной связи (структуры Льюиса). В 1926 г. практически одновременно с Бренстедом и Лоури предложил новую концепцию кислот и оснований, в которой основой является передача электронной пары: кислоты Льюиса — акцепторы, а основания Льюиса — доноры электронной пары. В 1930-х гг. Льюис разработал метод получения тяжелой воды. Кислотой по Льюису является частица (молекула или ион), способная присоединять электронную пару (акцептор электронной пары). Она должна содержать в своем составе атом с незаполненной до октета внешней электронной оболочкой: BF3, AlCl3, BeCl2, H+, Cu2+ и т.д. Основанием является частица (молекула или ион), способная предоставлять для образования связи электронную пару (донор электронной пары). Основание по Льюису должно содержать в своем составе атом с неподеленной электронной парой на внешнем слое: :NH3, :NH2–NH2, :OH–, :Cl–. Согласно теории Льюиса, кислота и основание взаимодействуют друг с другом с образованием ковалентной связи по донорно-акцепторному механизму:
Теория Льюиса не противоречит теории Бренстеда-Лоури. Понятие основания в обеих этих теориях практически совпадает, однако понятие кислоты в концепции Льюиса значительно шире и охватывает, кроме иона Н+, многие другие электронноакцепторные частицы, в том числе и катионы металлов Men+. Соответственно, значительно увеличивается и число реакций, которые по своему характеру относятся к кислотно-основному взаимодействию. Так, например, согласно теории Льюиса, кислотно-основными являются многочисленные реакции комплексообразования:
Теория Льюиса широко используется для объяснения реакционной способности органических соединений и очень удобна при описании механизма химических реакций, протекающих с их участием. 34. Условия протекания реакций обмена в растворах электролитов. Условия выпадения осадка. Реакция нейтрализации Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов. Правила составления ионных уравнений реакций 1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют. 2. В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов. 3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым. 4. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой. Порядок составления ионных уравнений реакции 1. Записывают молекулярное уравнение реакции MgCl2 + 2AgNO3 2. Определяют растворимость каждого из веществ с помощью таблицы растворимости
3. Записывают уравнения диссоциации растворимых в воде исходных веществ и продуктов реакции: MgCl2 AgNO3 Mg(NO3)2 4. Записывают полное ионное уравнение реакции Mg2+ + 2Cl- + 2Ag+ + 2NO3- 5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон: Mg2+ + 2Cl- + 2Ag+ + 2NO3- Ag+ + Cl- Условия необратимости реакций ионного обмена 1. Если образуется осадок ( Pb(NO3)2 + 2KI Pb2+ + 2I- 2. Если выделяется газ ( Na2CO3 + H2SO4 CO32- + 2H+ 3. Если образуется малодиссоциированное вещество (H2O) Ca(OH)2 + 2HNO3 H+ + OH- 4. Если образуются комплексные соединения (малодиссоциированные комплексные ионы) CuSO4 • 5H2O + 4NH3 Cu2+ + 4NH3 В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O) или комплексных ионов реакции обмена обратимы . Условие выпадения осадка только одно: произведение концентраций соответствующих ионов в степенях стехиометрических коэффициентов больше, чем произведение растворимости соли при данной температуре. Чтобы ответить на вопрос, выпадет ли осадок в данных условиях, необходимо рассчитать величину произведения концентраций ПК и сравнить ее с табличной величиной ПР. При этом возможны 3 случая: 1. ПК< ПР. Такой раствор называется ненасыщенным. Осадок в таком растворе не образуется. Молекулы осадка сразу же распадаются на ионы, т.к. их концентрация ниже равновесной. 2. ПК = ПР. Этот раствор называется насыщенным. В нем наступает подвижное равновесие. Осадок не выпадает. 3. ПК > ПР. Осадок образуется только в пересыщенном растворе. Образование осадка будет продолжаться до наступления равенства ПК = ПР и превращения раствора из пересыщенного в насыщенный. Наступает равновесие и дальнейшее образование осадка прекращается. Свойство насыщенного раствора сохранять постоянным произведение активностей (концентраций) ионов в соответствующих степенях называют правилом произведения растворимости. По этому правилу невозможно существование таких растворов, в которых произведение активностей превышало бы табличное значение ПР при данной температуре. Если произведение активностей в соответствующих степенях превышает ПР, то должно произойти образование осадка и концентрация ионов в растворе должна уменьшится до таких значений, которые удовлетворяли бы правилу ПР. В соответствии с правилом ПР, если концентрация (активность) одного из ионов, входящих в выражение ПР, увеличивается, то концентрация (активность) другого уменьшается. Это действие одноименного ионалежит в основе методов количественного осаждения и используется в аналитической химии. Рассчитаем, например, растворимость AgCl (ПРт = 1,78·10-10). в воде и в 0,01М растворе KCl: 1) S = 2) Если обозначить равновесную концентрацию ионов серебра и хлорид-ионов через х, то в 0,01М растворе KCl произведение растворимости хлорида серебра можно записать ПР = x·(x + 0,01). Отсюда Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода). Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия: HCl + NaOH → NaCl + H2O. Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда). Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом: H+ + OH– → H2O. После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl. Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций: необратимые реакции – образованная соль не распадается на составляющие вещества – кислоту и щёлочь (протекают в одну сторону); обратимые реакции – образованные соединения способны распадаться на изначальные вещества и вновь взаимодействовать (протекают в обе стороны). Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием: H2SO4 + 2KOH → K2SO4 + 2H2O; HNO3 + KOH → KNO3 + H2O. Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой: H2SO3 + 2NaOH ↔ Na2SO3 + 2H2O; Fe(OH)3 + H3PO4 ↔ FePO4 + 3H2O. Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду: Cu(OH)2 + 2HNO3 ↔ Cu(NO3)2 + 2H2O. |
