Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
Современная модель строения атома строение атома
Строение электронной оболочки Электронная оболочка состоит из энергетических уровней, каждый из которых содержит подуровни или атомные орбитали. Атомная орбиталь – это область пространства, в которой вероятность пребывания электрона с определенной энергией является наибольшей. Существует четыре типа (s, p, d, f) форм атомных орбиталей.
Устойчивое состояние атома обусловлено наименьшей энергией его электронной оболочки, иначе атом переходит в возбужденное состояние. Правила заполнения электронных орбиталей в основном состоянии Принцип наименьшей энергии – первоначально заполняются орбитали с наименьшей энергией, энергия возрастает в ряду:
Принцип Паули – на каждой орбитали могут находиться 2 электрона с разными спинами (характеристика электрона, определяющая его поведение в магнитном поле) Принцип Гунда – на орбиталях с одинаковой энергией располагаются как можно больше электронов с одинаковыми спинами 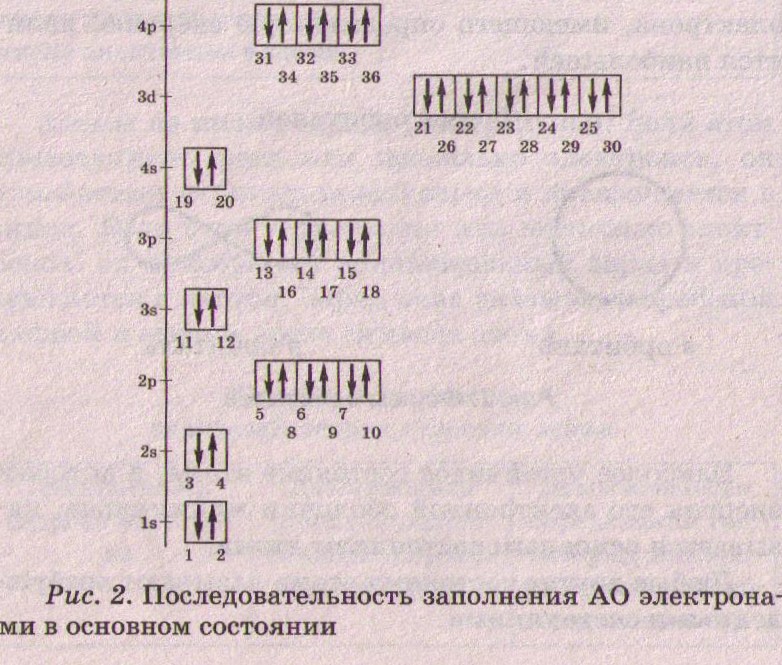 Распределение электронов по орбиталям называется электронной конфигурацией (формулой) атома и происходит в соответствии с выше указанными правилами.
Электронные конфигурации d5, d10 обладают повышенной устойчивостью, поэтому в атомах хрома и меди наблюдается проскок электрона с 4s на 3d подуровень. 24 Хром: 1s2 2s2 2p6 3s2 3p6 3d5 4s1 29 Медь: 1s2 2s2 2p6 3s2 3p6 3d10 4s1 Периодичность свойств атомов
7. ___________________ Основные свойства атомов (радиус, энергия ионизации, сродство к электрону, электроотрицательность, окислительно-восстановительные свойства) и закономерности их изменения в группах и периодах. Периодический закон. Периодическая система элементов – это отображение периодического закона в форме таблицы, в которой элементы систематизированы по периодам – горизонтальным рядам и группам – вертикальным столбцам. Период – последовательный ряд элементов, атомы которых имеют одинаковое число энергетических уровней, равное номеру данного периода, совпадающего со значением главного квантового числа. Также показывает, из скольких подуровней состоит данный уровень. Группа – вертикальный ряд элементов, Атомы которых имеют одинаковое число электронов на внешнем и предвнешнем электронных подуровнях (валентных электронов). Различают главные, или А-подгруппы, в них расположены элементы, у которых идет заполнение внешнего уровня, и побочные (Б-подгруппы), в них расположены элементы, у атомов которых идет заполнение предвнешнего уровня. Основные свойства атомов: Радиус атома (rат) – это расстояние от ядра до места прекращения действия сил притяжения (отталкивания). Размер атома не может быть точно определен, т.к. электронные орбитали атомов не имеют строго ограниченных контуров, поэтому говорят о размерах атомов и кристаллах, молекулах, т.е. об эффективных радиусах (rэф). По группе сверху вниз rэф увеличивается, т.к. увеличивается число энергетических уровней. По периоду слева направо уменьшается, т.к. увеличивается притяжение электронов ядром. Энергия ионизации Еи (I, кДж/моль) – энергия, необходимая для отрыва электрона от атома с образованием катиона. Она является сложной функцией ряда свойств атома: заряда ядра, Атомного радиуса и характера межэлектронного взаимодействия. По группе сверху вниз Eи уменьшается, потому что увеличивается эффективный радиус атома и ослабевает притяжение внешних электронов ядром. По периоду слева направо Еи увеличивается, так как rэф уменьшается. Энергия сродства к электрону (Еср) – это энергия, выделяющаяся в результате присоединения электрона атомом элемента с образованием аниона. Обладает периодичностью: возрастает по периоду, достигая максимума у галогенов, которые получают устойчивую октетную оболочку при присоединении электрона. Изменение по группе: у элементов А-подгрупп Еср уменьшается. Для элементов Б-подгрупп увеличивается. Электроотрицательность (ЭО) – величина, характеризующая способность атома элемента притягивать к себе общие (связевые) электроны в молекуле. ЭО уменьшается по группе. Периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов (формулировка Менделеева) Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов (современная формулировка) Периодическая повторяемость свойств элементов и их соединений обусловлена периодически повторяющимися электронными конфигурациями. 8.____________ 9. Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей. В Периодической таблице химических элементов Д. И. Менделеева все атомы отображены в их основном состоянии (состоянии с минимальной энергией). Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице. В определенных ситуациях, некоторые атомы, получая энергию извне, переходят в, так называемое, возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние. Рассмотрим основное и возбужденное состояние атома на конкретных примерах. 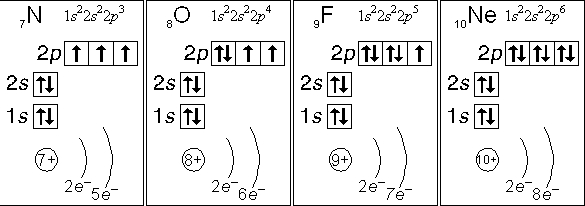 Рис. Электронные конфигурации атомов азота, кислорода, фтора, неона. атом азота (N): кол-во неспаренных электронов: 3 ковалентность: 3 атом кислорода (О): кол-во неспаренных электронов: 2 ковалентность: 2 атом фтора (F): кол-во неспаренных электронов: 1 ковалентность: 1 атом неона (Ne): кол-во неспаренных электронов: 0 ковалентность: 0 Азот, кислород, фтор и неон не могут иметь возбужденного состояния по той простой причине, что они не имеют свободной орбитали с более высокой энергией, на которую могли бы "перескакивать" спаренные электроны с орбиталей с меньшей энергией. Рассмотрим атом серы, который находится в одной с кислородом группе - 16 (VIa), но, в отличие от кислорода, у атома серы имеется свободная d-орбиталь, существенно расширяющая валентные возможности элемента: 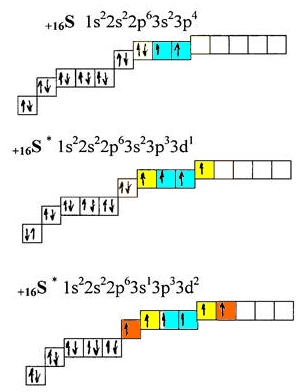 Рис. Возбужденное состояние атома серы. В основном состоянии атом серы имеет 2 валентных электрона (голубой цвет). Как видно из вышеприведенного рисунка, получая энергию извне, у атома серы могут появляться еще 2 (желтый цвет) или 4 (желтый+оранжевый) дополнительных валентных электрона, при этом общее кол-во валентных электронов увеличивается до 4 или 6 соответственно. 10. Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Теория валентных связей (метод валентных связей, метод валентных схем, метод локализованных электронных пар) — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Теория валентных связей заложена в 1927 году В. Гайтлером и Ф. Лондоном на примере квантовохимического расчёта молекулы водорода. В основе теории валентных связей лежит гипотеза о том, что при образовании молекулы из атомов, последние в значительной мере сохраняют свою электронную конфигурацию, а связывание атомов достигается в результате обмена электронов между ними и спаривания спинов двух электронов, находящихся на атомных орбиталях исходных атомов. Расчёт Гайтлера — Лондона оказался весьма значительным по своим результатам в развитии квантовой химии. В подтверждение электронной октетной теории (правило октета) Г. Льюиса было показано, что химическая связь в молекуле водорода действительно осуществляется парой электронов. Стандартной энергией разрыва химической связи называют изменение энтальпии при химической реакции, в которой происходит разрыв одного моля данной связи. При этом принимается, что исходное вещество и продукты реакции находятся в своих стандартных состояниях гипотетического идеального газа при давлении 1 атм и температуре 250 C. Синонимами энергии разрыва химической связи считаются: энергия связи, энергия диссоциации двухатомных молекул, энергия образованияхимической связи. Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Длина химической связи — расстояние между ядрами химически связанных атомов. Длина химической связи — важная физическая величина, определяющая геометрические размеры химической связи, её протяжённость в пространстве. Различают следующие виды химической связи: Ковалентная (полярная и неполярная; обменная и донорно-акцепторная). Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи. Ионная (Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы. Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью). Водородная - это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер. Металлическая (Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла). 11. Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Образование связи при рекомбинации атомов Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путём обобществления двух неспаренных электронов, принадлежащих разным частицам. H + H → H2; ·CH3 + ·CH3 → CH3 — CH3. Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействии атомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике при атомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется поток атомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой на небольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500°C. Большим достоинством «пламени атомного водорода» является равномерность нагрева, позволяющая сваривать очень тонкие металлические детали. Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы». Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени. Образование связи по донорно-акцепторному механизму Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и отрицательного иона водорода H-, называемого гидрид-ионом: H+ + H- → H2 При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным. Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма образования, поэтому называть химическую связь, полученную по донорно-акцепторному механизму, донорно-акцепторной связью некорректно. В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главных подгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента. Так, ещё Йоханнес Брёнстед установил, что протон не существует в растворе в свободном виде, в воде он образует катион оксония: H+ + H2O → H3O+ Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот[10]. Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония: NH3 + H+ → NH4+ Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые, сульфониевые и другие соединения. В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H3+: H2 + H+ → H3+ Связывающая электронная пара молекулярного иона водорода H3+ принадлежит одновременно трём протонам. Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы). Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам. Электроны тем подвижнее, чем дальше они находятся от ядер. Существуют три вида ковалентной химической связи, отличающихся механизмом образования: 1. Простая ковалентная связь. Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными. Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора. Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью. 2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу. 3. Семиполярная связь. Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа: Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном). Обобществление неспаренных электронов (как в случае простой ковалентной связи). При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






 сложная розетка
сложная розетка