Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
Вопрос 18 Термодинамические системы и процессы. Понятие о фазах. Фазовые равновесия. Фазовая диаграмма состояния воды. Правило фаз. Термодинамическая система - совокупность нескольких веществ, взаимодействующих друг с другом, более или менее обособленных от окружающей среды. Она может быть однофазной (гомогенной) и многофазной (гетерогенной). Неизолированная система - система в которой возможен обмен веществом или энергией с окружающей средой в противном случае системы изолированные. Различают открытые (обмен и массой и энергией) и закрытые (обмен только энергией) неизолированные системы. Процесс в термодинамике – это не развитие события во времени, а последовательность равновесных состояний системы, ведущих от начального набора термодинамических переменных к конечному. Процесс адиабатный - процесс, протекающий в системе, не обменивающейся с окружающей средой теплотой, изменение внутренней энергии происходит за счёт совершения системой работы. Процесс изобарный - процесс, протекающий при постоянном давлении. Процесс изохорный - процесс, протекающий при постоянном объеме. Процесс изотермический - процесс, протекающий при постоянной температуре. Процесс обратимый - процесс, который можно реализовать таким образом, что система и окружающая среда возвратятся в исходное состояние. Процесс необратимый - такой процесс, после проведения которого в системе или окружающей среде остаются какие-либо изменения. Фаза - часть системы, однородная во всех своих точках по химическому составу и свойствам, и отделённая от других фаз поверхностью раздела. Фазовое равновесие - равновесие процесса перехода вещества из одной фазы в другую без изменения химического состава. Условие фазового равновесия: скорость прямого процесса равна скорости обратного процесса, энергия Гиббса равна нулю ( 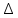 G=0). G=0).Для фазового равновесия соблюдается принцип Ле Шателье. Фазовая диаграмма воды: 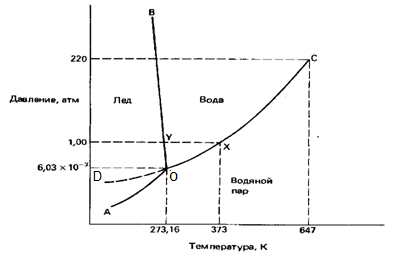 Кривая ОС отражает равновесие процесса кипения. Кривая ОВ - кривая плавления Кривая ОА отражает процесс сублимации (перехода из твёрдого состояния в газообразное) Кривая OD Описывает поведение воды в неустойчивом состоянии. Правило фаз(Дж. Гиббс) - числа степеней свободы С, фаз Ф, независимых компонентов К и внешних условий n, влияющих на равновесие, взаимосвязаны соотношением 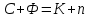 Компонент - химически однородная составная часть вещества. Число степеней свободы - число внешних условий, которые можно изменять в определённых пределах без изменения числа и вида фаз. На фазовое равновесие обычно влияют температура и давление, и в этом случае правило фаз можно записать в виде 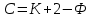 Вопрос 19 Понятие о термодинамических функциях. Внутренняя энергия и энтальпия. Первый закон термодинамики. Тепловой эффект реакции. Термохимические уравнения. Закон Гесса в термохимических уравнениях. Термодинамические функции - свойства системы независящие от пути протекания процессе, а только от начального и конечного состояния системы. Внутренняя энергия тепловой эффект энтальпия энтропия энергия Гиббса энергия Гельмгольца Внутренняя энергия ( 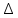 U) - полная энергия системы складывающаяся из кинетической и потенциальной энергии её частей, энергии всех её частиц и энергии всех её взаимодействий. Абсолютного значения внутренней энергии не существует, можно определить только её изменение. U) - полная энергия системы складывающаяся из кинетической и потенциальной энергии её частей, энергии всех её частиц и энергии всех её взаимодействий. Абсолютного значения внутренней энергии не существует, можно определить только её изменение.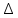 U=U2-U1 U=U2-U1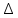 U=[ U=[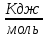 ] ]Энтальпия( 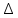 H) - характеризует суммарный запас внутренней и внешней энергии системы. В изобарно-изотермических системах определяет тепловой эффект процесса. H) - характеризует суммарный запас внутренней и внешней энергии системы. В изобарно-изотермических системах определяет тепловой эффект процесса.H=U+pV 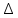 H=[ H=[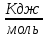 ] ]Первый закон термодинамики - теплота подведённая к системе расходуется на изменение внутренней энергии этой системы и на совершение работы. Тепловой эффект реакции - количество выделенного или поглощённого в ходе реакции тепла отнесённая к 1 молю при условии, что процесс идёт при стандартных условиях, а система не совершает никакой работы кроме расширения. +Q - экзотермический ( 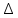 H<0) H<0)-Q - эндотермический ( 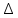 H>0) H>0)Термохимические уравнения - уравнение процессов, в которых указаны тепловые эффекты. Например, H2+1/2O2=H2O (ж), 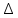 H0298=-285,8 Кдж H0298=-285,8 КджЧтобы отнести энтальпию реакции к одному молю какого-либо вещества, термохимические уравнения имеют дробные коэффициенты. Закон Гесса - тепловой эффект реакции не зависит от пути протекания химического процесса, т.е. от числа и характера промежуточных стадий, а только от конечного и начального состояния веществ. Следствия из закона Гесса: Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции Тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ с учётом стехиометрических кэффициентов. aA+bB→cC+dD - реакция 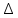 H=(c* H=(c*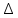 H(C)+d* H(C)+d*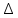 H(D))-(a* H(D))-(a*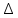 H(A)+b H(A)+b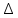 H(B)) - тепловой эффект H(B)) - тепловой эффектВопрос 20 Энтропия как функция состояния системы. II и III законы термодинамики. Определение изменения энтропии в ходе химической реакции. Изменение энтропии при фазовых переходах. Энтропия (S) - мера неупорядоченности состояния системы. Состояние системы можно характеризовать микросостояниями составляющих её частиц. Число микросостояний системы называется термодинамической вероятность системы (W). Термодинамическая вероятность выражается огромными числами, поэтому используют логарифм термодинамической вероятности ln W. S=R*lnW S=[ 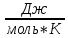 ] ]При повышении температуры энтропия увеличивается Стандартная энтропия образования - это изменение энтропии, при переходе вещества из состояния при абсолютном нуле к состоянию при to=298K Второй закон термодинамики - в изолированных системах самопроизвольно идут лишь процессы увеличивающие беспорядочность системы. Третий закон термодинамики (Планк) - при абсолютном нуле энтропия идеального кристалла равна нулю. Изменение энтропии системы в результате протекания химической реакции равно сумме энтропий продуктов реакции за вычетом энтропий исходных веществ с учётом стехиометрических коэффициентов. При переходе вещества из твердого состояния в жидкое значительно увеличивается неупорядоченность и соответственно энтропия вещества. Особенно резко возрастает энтропия вещества при его переходе из жидкого в газообразное состояние. Энтропия вещества увеличивается при его переходе из кристаллического состояния в аморфное. ВОПРОС 21 Определение направления и предела самопроизвольного протекания реакций. Энтальпийный и энтропийный факторы. Свободная энергия Гиббса. Температура равновесия.  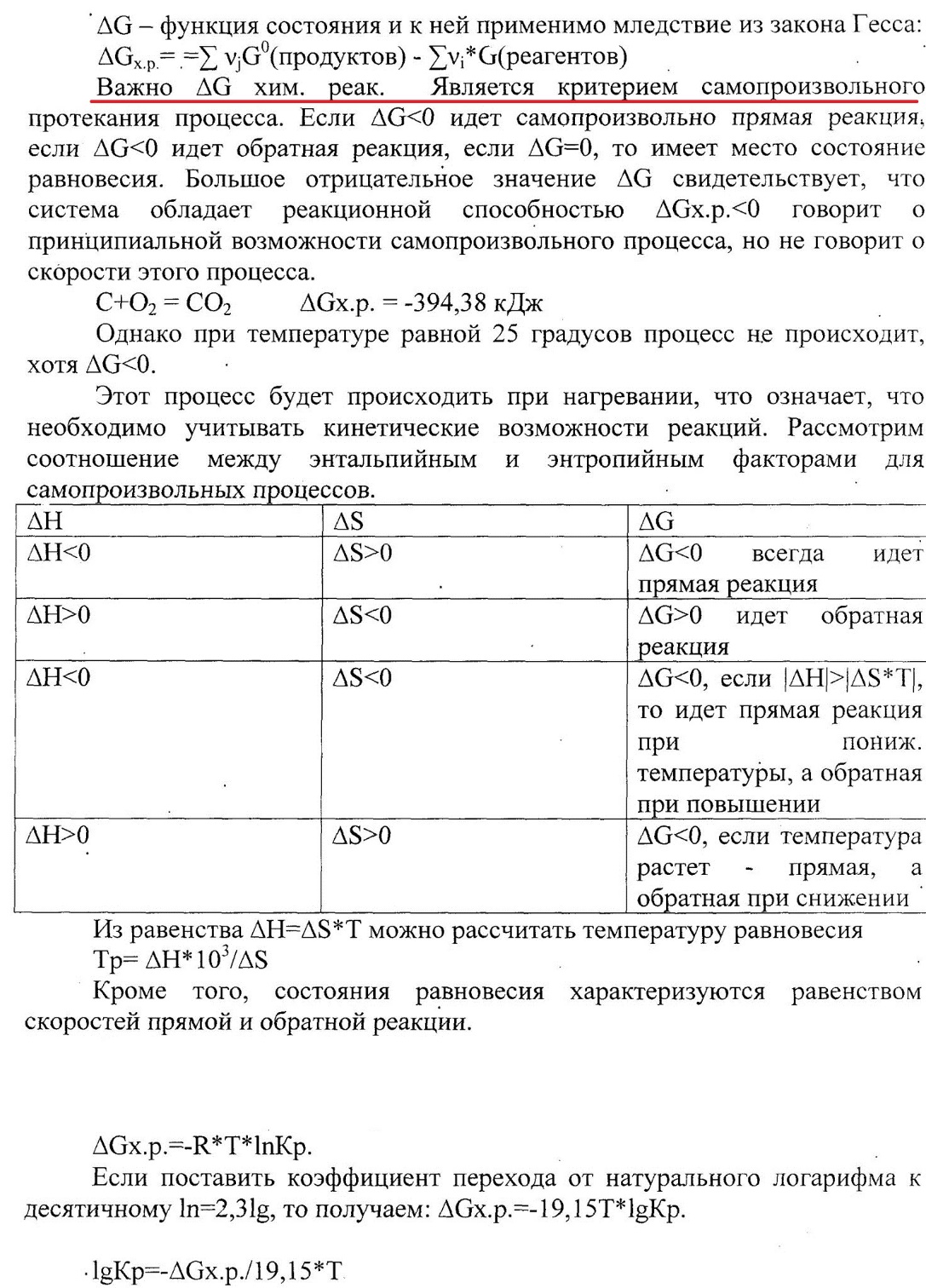 ВОПРОС 22 Скорость химической реакции. Закон действия масс для для гомо- и гетерогенных реакций (на примерах). Зависимость скорости реакции от концентраций веществ, давления и объема системы, площади поверхности раздела фаз. Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. Выявление механизма реакции — установление элементарных стадий процесса и последовательности их протекания (качественные изменения). Зависимость скорости гомогенных реакций от концентрации (закон действующих масс). Влияние концентрации реагирующих веществ может быть объяснено из представлений, согласно которым химическое взаимодействие является результатом столкновения частиц. Увеличение числа частиц в заданном объеме приводит к более частым их столкновениям, т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Влияние концентраций веществ на скорость химической реакции Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Очевидно, что вероятность столкновения молекул прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов. Закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами веществ в уравнении реакции: υ = k [A]а * [B] b, для реакции aA + bB = cC + dD, где υ – скорость химической реакции; [А] – концентрация вещества А; [В] – концентрация вещества В; k – константа скорости реакции (коэффициент пропорциональности); а и b – коэффициенты в уравнении реакции. Если [А]= [В]= 1 моль/л, то скорость химической реакции (υ) равна константе (k). Константа скорости реакции зависит от природы реагирующих веществ, температуры, но не зависит от концентрации вещества. Например, напишем кинетическое уравнение для реакции синтеза аммиака N2 (г) + 3 H2 (г) ↔ 2 NH3 (г): υ = k [N2] * [H2] 3. В закон действующих масс не входят концентрации твердых веществ, т. к. реакции с твердыми веществами протекают на их поверхности, где «концентрация» вещества постоянна. Влияние поверхности соприкосновения реагентов на скорость химической реакции. Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов. Но в этом определении есть нюансы. Твердые вещества, участвующие в гетерогенной реакции, для увеличения скорости взаимодействия измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление. ВОПРОС 23 Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Энергия активации. Энергетические диаграммы хода экзо- и эндотермической реакции. При повышении температуры скорость химических реакций обычно возрастает. Это объясняется теорией активации: энергия необходимая для активирования молекул, называется энергией активации (Е акт). С повышением температуры увеличивается число активных молекул, поэтому увеличивается скорость реакции. Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на 10оС скорость большинства химических реакций увеличивается в 2–4 раза. Это правило математически выражается следующей формулой: 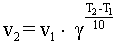 ,где γ – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС. ,где γ – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.Энергия, необходимая для перехода вещества в состояние активированного комплекса называется энергией активации. Возможность образования активированного комплекса, а соответственно и химического взаимодействия, определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. Доля их в системе зависит от температуры. Чем выше энергия активации, тем очевидно, меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации, или как иногда говорят, высокий энергетический барьер является причиной того, что многие химические реакции при невысоких темпер не протекают, хотя и принципиально возможны (del G<0).Так, в обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, хотя энергия Гиббса реакций окисления этих веществ ниже (delG<0). ВОПРОС 24 Катализ: виды, механизмы. Особенности каталитических процессов. Энергетические диаграммы каталитической и некаталитической реакции.  Первый рисунок без катализатора, а второй с катализатором 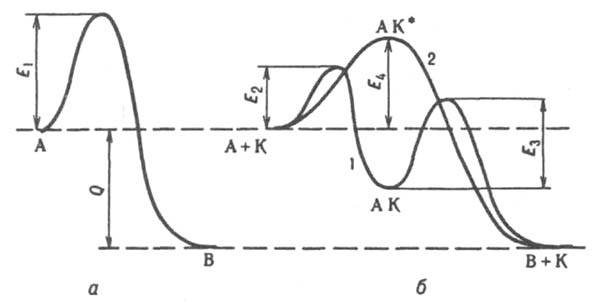 ВОПРОС 25 Химическое равновесие, его признаки. Константа равновесия для гомо- и гетерогенных реакций (па примерах). Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем. Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие. Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа): 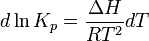 и изохоры химической реакции (изохоры Вант-Гоффа): 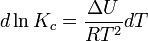 Здесь ΔH и ΔU — тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если ΔH > 0 (тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия 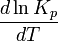 тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье). тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).Принцип Ле Шателье — Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. ВОПРОС 26 Влияние изменения концентрации веществ, температуры, давления и объема системы, катализаторов на химическое равновесие и константу равновесия. Принцип Ле-Шателье (на примерах). Положение хим.рав. зависит от следующих параметров реакции: температуры, давления, и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 г французским учёным Ле-Шателье. 1)температура: при увеличение темпер. Хим. Равн. Смещается в сторону эндотермической реакции, а при понижении в сторону экзотермической реакции. CaCO3=CaO+CO2 –Q t ↑ →, t↓ ← . N2+3H2-2NH3 +Q t↑ ←, t↓→ 2)давление: при увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. СaCO3=CaO+CO2 P↑←, P↓→ 1моль=1моль+1моль 3)концентрация исходных веществ и продуктов реакции. При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при уменьшении концентрации продуктов реакции в сторону исход веществ. S2+2O2=2SO2 [S],[O] ↑→,[SO2] ↑← Катализаторы не влияют на смещение химическое равновесие!!! Принцип Ле Шателье — Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Пример. FeCl3 + KCNS = Fe(CNS)3 +3KCl Увеличив концентрацию FeCl3 или KCNS, усилится окраска, т.е. равновесие сместится в сторону продуктов Увеличив концентрацию KCl, равновесие сместится в сторону исходных веществ. |
