|
|
Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
Гальванические элементы: условия работы. ЭДС и напряжение. Способы расчета ЭДС. Устройство гальванического элемента Даниеля-Якоби, схема его работы, электродные процессы, токообразующая реакция.
Условия работы гальванического элемента основаны на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
Способы расчёта ЭДС: Еэ=Ек-Еа=-dG/nF
Гальванический элемент Даниэля-Якоби - гальванический элемент составленный их стандартного медного и цинкового электродов, погруженные в растворы своих солей.
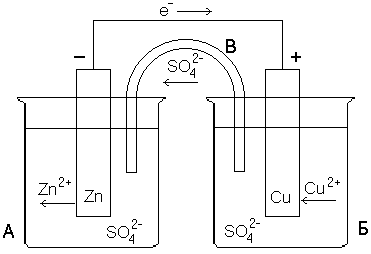
А: Zn0-2e=Zn2+
K: Cu2+ +2e=Cu0
ТОР: Zn0+Cu2+=Cu0+Zn2+
43.
Особенностью концентрационного гальванического элемента, является то, что оба электрода выполнены из одного и того же метала.
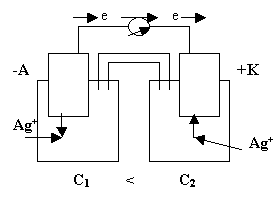 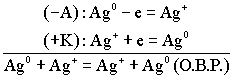
(По формуле Нерста) рассчитаем ЭДС концентрационного элемента.
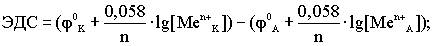
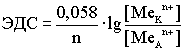
Недостатки концентрационных гальванических элементов:
разрушаемый анод,
малая ЭДС.
Концентрационные элементы используются в тех случаях, где необходима малая ЭДС.
44.
Поляризация электродов. Её виды и механизмы. Поляризационные кривые при работе гальванических элементов, коррозии, электролизе. Значение поляризации в электрохимических системах.
Прохождение тока вызывает изменение потенциала электрода. Это явление, а также величина изменения потенциала, называются поляризацией: ΔЕ = Еi - Ep ,
где ΔЕ – поляризация; Еi – неравновесный потенциал электрода, т.е. потенциал при прохождении электрического тока; Ep – равновесный потенциал.
Изменение потенциала электрода также называют перенапряжением.
Поляризация имеет место как на катоде, так и на аноде, поэтому различают катодную (ΔЕк) и анодную (ΔЕа) поляризацию. Катодная поляризация всегда отрицательна, а анодная всегда положительна.
Поляризация определяется из экспериментально получаемой зависимости потенциала электрода от плотности тока, т.е. отношения тока I к площади электрода S (i=I/S).
На поляризацию влияет также материал электрода, состояние его поверхности и целый ряд других факторов
Возникновение поляризации: Любой электродный процесс включает в себя не менее трех стадий:
1) подвод реагирующих веществ к электроду;
2) процесс электрохимического превращения на поверхности электрода, который может сопровождаться дополнительными химическими реакциями;
3) отвод продуктов реакции от электрода.
Эти процессы протекают последовательно и имеют, обычно, различные скорости. Скорость наиболее медленной (лимитирующей) стадии определяет общую скорость процесса. Ускорение лимитирующей стадии достигается повышением потенциала электрода, т.е. поляризацией. В зависимости от того, какая стадия является лимитирующей, различают концентрационную и электрохимическую поляризацию.
Так как поляризация может наблюдаться как на катоде, так и на аноде, то различают катодную и анодную поляризации Dj К, Dj А . Изменение потенциала при прохождении тока также называется «перенапряжением» Графическую зависимость потенциала от плотности тока называют поляризационной кривой.
ВОПРОС 45
Электролиз (на примере электролиза раствора соли с растворимым анодом). Последовательность электродных процессов.
Электролиз- Это электрохимический процесс превращения веществ на электродах, погруженных в раствор или расплав электролита при пропускании постоянного электрического тока от внешнего источника. При электролизе происходит превращение электрической энергии в химическую (т. е. в E хим. связей). Электролиз проводится в особых областях, которые называются электролизеры.
При электролизе анод имеет заряд «+», катод — «‑»
При пропускании тока в растворе или расплаве начинается направленное движение ионов: анионы к аноду, катионы к катоду. Там частицы вступают в электрохимическую реакцию (окисление – на аноде, восстановление – на катоде). Кроме электрических процессов, в приэлектрической зоне могут происходить ионообменные процессы – побочны.
Рассмотрим электролиз расплава NaCl с угольными электродами.
Схема электролиза:
A K А: 2Cl ‑ ‑2ē→ Cl20↑
(+) NaCl→Na++Cl ‑ (‑) К: Na++1ē → Na0
Cl ‑ Na+ эл.
Σ:2NaCl→2Na0+Cl2 ↑
C C
При прохождении тока потенциал электродов меняется, EA становится более «+», Eк — более отрицательным (как и в Г. Э.).
 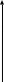 
E
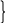
EА
EЭ U
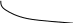
EК

Теоретически рассчитанная разность потенциалов, необходимая для осуществления электролиза EЭ оказывается из-за поляризации меньше, чем реально необходимое напряжение U: U>EЭ.
U=EЭ+∆EК+∆EА+JR
Следовательно, поляризация при электролизе — процесс вредный, обычно. Но иногда процесс поляризации позволяет проводить избирательные реакции получения определенного вещества.
Последовательность электродных процессов
Катодный процесс
На «‑» катоде в первую очередь восстанавливаются частицы с наибольшим потенциалом. Если разница потенциалов частиц, присутствующих на К., меньше 1В, то параллельно происходит несколько процессов.
Все ионы Ме, присутствующие в катодной зоне, можно условно разделить на 3 группы:
1. Катионы наиболее активных Ме, т. е. Ме, расположенных в ряду стандартных потенциалов между Li и Al включительно.
При электролизе растворов их солей восстановление Ме на катоде не происходит, т. к. E0Ме<РH+/H2. поэтому вместо них восстанавливается H2O (если среда нейтральная или щелочная).
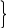
2H2O+2ē→H2↑+2OH ‑
один и тот же процесс
или 2H++2ē→H2↑
В результате этого процесса высвобождается избыток OH ‑ ионов, и среда в катодной зоне становится более щелочной. Металлы первой группы нельзя получить электролизом водных р-ров солей.
2. Катионы металлов средней активности — расположенных в ряду напряжений между Al и H. При электролизе растворов их солей на К возможно одновременно восстановление ионов Ме и H2O (H+).
Меn++nē→Ме0
2H2O+2ē→H2↑+2OH ‑
(2H++2ē→H2↑)
3. Катионы малоактивных Ме (расположенных в ряду напряжений после H). Как правило, при электролизе растворов их солей на К происходит восстановление ионов Ме:
Меn++nē→Ме0
Для точного установления количества и последовательности электродных процессов необходим расчет E по уравнению Нернста:
0,059 a2(H+)
Eр(H+/H2) = E0(H+/H2) + ‑‑‑‑‑‑‑‑‑ lg ‑‑‑‑‑‑‑‑‑‑ , где n=2, p(H2)=1 атм. ,a
pH
n p(H2)
или сокращенно Eр(H+/H2) = ‑0,059pH
Для ионов Ме используется стандартный потенциал.
Анодный процесс
На «+» аноде в первую очередь окисляются частицы с наименьшим потенциалом. Если ∆E<1, то может быть параллельно несколько процес-сов.
Кроме анионов, присутствующих в анодной зоне, в электродном процессе может принимать участие материал электрода (Ме), т. е. может происходить окисление (растворение) анода. В зависимости от природы Ме аноды могут быть растворимыми, полурастворимыми и нерастворимыми. К нерастворимым анодам относятся металлы малоактивные, устойчивые к окислению: Au, Pt, Pd, Ir. Они, как и угольные электроды, являются только проводниками ē. К полурастворимым относятся электроды из Ме, способных к пассивации. При пропускании тока эти Ме покрываются пассивной пленкой (чаще всего оксидной), вследствие чего их потенциал резко воз-растает и они становятся неспособными к дальнейшему окислению.
Al, Ni, Co, Mn, Cr, W, Cd, V и др.
Если электролизу подвергается соль кислородной кислоты, то кислотные остатки на аноде не окисляются (SO42 ‑, NO3‑, CO32 ‑…), т. к. имеют очень высокий «+» потенциал. Вместо них окисляется вода (в нейтральной и кислой среде) или OH‑ (в щелочной среде):
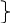
2H2O ‑ 4ē→O2+4H+
4OH ‑ ‑ 4ē →O2+2H2O
В результате этого происходит высвобождение ионов H+, и среда становится более кислой.
Если электролизуется соль бескислородной (pH↓) кислоты, то может происходить одновременно окисление H2O (OH ‑) и кислотных остатков, например,
2Br ‑ ‑ 2ē→Br2;S ‑2 ‑2ē→S0 и т. п.
Таким образом, на аноде может происходить окисление воды, кислот-ного остатка и металла анода.
Потенциал кислородного электрода (т. е. потенциал выделения O2) рассчитывается по уравнению Нернста:
0,059 p(O2)
Eр(O2/ OH‑)=E0(O2/ OH‑)+ ‑‑‑‑‑‑‑‑‑ lg ‑‑‑‑‑‑‑‑‑‑‑ , где n=4, p(O2)=1 атм., a(OH‑)
pH
n a4(OH‑)
Сокращенно Eр(O2/OH‑)=1,227‑0,059 pH
Вопрос 46
Количественные закономерности электролиза. Поляризация при электролизе. Применение электролиза.
Количественные закономерности электролиза.
1. Количество вещества, подвергающегося химическому превращению на электроде, прямо пропорционально количеству электричества, прошедшему через электрод Q=I∙t, где I — сила тока, t — продолжительность электролиза.
Мэ∙I∙t Vэ∙I∙t
m = ‑‑‑‑‑‑‑‑‑; V = ‑‑‑‑‑‑‑‑‑
F F
F — число Фарадея; F=96500 Кл/моль (А∙с/моль)
F=26,8 А∙ч/моль
2. Массы прореагировавших на электродах веществ относятся друг к другу как молярные массы их эквивалентов:
m(А) Мэ(А) m(А) m(к)
‑‑‑‑‑‑‑‑ = ‑‑‑‑‑‑‑; ‑‑‑‑‑‑‑ = ‑‑‑‑‑‑‑; нюэ(А)=нюэ(К)
m(к) Мэ(К) Мэ(А) Мэ(К)
Эти закономерности называют законами Фарадея.
Если через электролизер пропущено количество электричества Qэл., то столько же проходит через А и К: Qобщ.=QА=QК
Если на электроде протекает один процесс выделения одного вещества, то все электричество тратится на выделение только этого вещества: Qi=Qэл
Если процессов несколько, то часть электричества тратится на выделение одного вещества, часть на выделение другого:
Qобщ.=Q1+Q2
Доля от общего количества электричества, которая расходуется на выделение данного вещества, называется выходом по току этого вещества:
Qi mпрак. Vпрак.
BTi = ‑‑‑‑‑‑‑‑‑∙(100%); BTi = ‑‑‑‑‑‑‑‑∙(100%)= ‑‑‑‑‑‑‑‑
Qобщ. mтеор. Vтеор.
mтеор и Vтеор. рассчитывается по закону Фарадея без учета протекания других процессов.
 Задача. Электролиз ZnSO4 проводили с нерастворимыми электродами в течение 6,7 ч, при этом выделилось 5,6 л O2. рассчитать силу тока, вычислить массу выделившегося на катоде Zn, если его выход по току 70%. pHр-ра=7 Задача. Электролиз ZnSO4 проводили с нерастворимыми электродами в течение 6,7 ч, при этом выделилось 5,6 л O2. рассчитать силу тока, вычислить массу выделившегося на катоде Zn, если его выход по току 70%. pHр-ра=7
     Анод Анод
ZnSO4→Zn2++SO42‑ 2H2O‑4ē→O2+2OH‑ (100%)
A H2O→H++OH ‑ K Eр=0,932В
(+) (‑) Катод
SO42‑ Zn2+ E0(Zn2+/Zn)= ‑0,76В
  OH –(H2O) H+(H2O) Eр(H+/H2)= ‑0,295В OH –(H2O) H+(H2O) Eр(H+/H2)= ‑0,295В
C pH=5 C
1) 2H++2ē→H2↑ (30%)
2) Zn2++2ē→Zn0 (70%)

Так как ВТ(O2)=100%, можем рассчитать силу тока и количество электри-чества, прошедшего через электролизер; по закону Фарадея:
Vэ(O2)∙J∙t
V(O2)= ‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
F
V∙F 5,6 л∙26,8 А∙ч/моль
J= ‑‑‑‑‑‑‑‑‑ = ‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑ = 4 А
VЭ∙t 5,6 л/моль∙6,7 ч
Qобщ.=J∙t=4∙6,7=26,8 А∙ч
Q(Zn)
ВТ(Zn)= ‑‑‑‑‑‑‑‑; Q(Zn)=26,8 А∙ч∙0,7=18,76 А∙ч
Qобщ
Q(Zn)∙Мэ(Zn) 32,7∙18,76
По закону Фарадея m(Zn) = ‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑ = ‑‑‑‑‑‑‑‑‑‑‑‑‑‑ = 22,9 г
F 26,8
 E E
При повышении напряжения вероятность
EO2 выделения H2 уменьшается, , т. е. его ВТ ↓.
В точке i
ВТ(Zn) ≈BT(H2) ≈50%
EH2
 EZn EZn
  i i
   При повышении напряжения вероятность выделения H2 уменьшается, т. е. его ВТ ↓. В точке i При повышении напряжения вероятность выделения H2 уменьшается, т. е. его ВТ ↓. В точке i
ВТ(Zn) ≈BT(H2) ≈50%
Применение электролиза
1. Получение веществ.
Из водных растворов солей активных металлов и кислородных кислот, растворов щелочей получают O2, H2, кислоты и щелочи.
Например, при электролизе раствора K2SO4
A: 2H2O‑4ē→O2+4H+
2H++SO42-→H2SO4
K: 2H2O+2ē→H2+OH ‑
OH ‑+K+→KOH
Также получают различные окислители: KMnO4, H2O2, F2, Cl2. тяжелую воду получают из расплавов — щелочные и щелочнозаменимые металлы, Al.
Получают различные Ме из солей — Cu, Zn, Co, Ni и др.
2. Рафинированные Ме (очистка от примесей)
В раствор соли металла опускают анод из очищаемого Ме. Он растворяется, ионы Ме переходят в раствор, движутся к К и там восстанавливаются, образуя чистый Ме. Примеси оседают на дно электролизера.
3. Получение гальванических покрытий (гальваностегия, т. е. Ме покрытие методом электролиза).
Для защиты Ме от коррозии, увеличения твердости, электропроводности, отражательной способности, с декоративными целями и т. д.
Гальванопластика — получение рельефных Ме изображений.
4. Анодное оксидирование (анодирование) — см. анодную защиту от коррозии.
5. Электрохимическая обработка Ме (ЭХОМ), электрохимическое полирование.
Применяется для очень твердых Ме, для которых затруднена механическая обработка. Обрабатываемый Ме растворяется под действием Катода необходимого профиля. На катоде выделяется H2.
Вопрос 47
Коррозия металлов, ее виды. Условия протекания электрохимической коррозии. Схемы микрогальванических коррозионных элементов (МГЭ), уравнения анодных и катодных процессов.
Коррозия процесс разрушения металлов при их контакте с окружающей средой. При этом металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства. По имеющимся литературным данным, примерно 10% ежегодной добычи металлов расходуется на покрытие потерь от коррозии.
Виды коррозии: химическая и электрохимическая.
Электрохимическая коррозия - результат протекания сопряженных электродных процессов, возникает при контакте металлов с электролитами (на воздухе, в почве, в растворах электролитов и т.п.).
Причиной электрохимической коррозии является возникновение на поверхности металла короткозамкнутых гальванических элементов.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом. Разные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окр. среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро-, а макрогальванопара, и коррозия называется контактной. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Схема МГЭ на поверхности металла, подверженного коррозии в электролите.
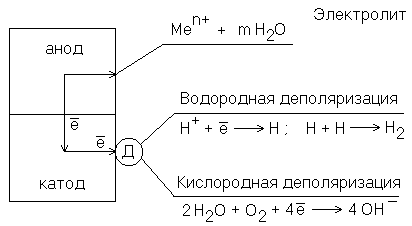
Схема электрохимической коррозии. Д – деполяризатор.
Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окисления ионы переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов, и работа коррозионного гальванического элемента прекратится.
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH– – восстановление
Схема короткозамкнутого гальванического элемента:
А (–) Fe | H2O, O2 | Cu (+) К
У поверхности металла в электролите протекают следующие реакции:
Fe2+ + 2 OH– → Fe(OH)2
4 Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3
Вопрос 48
Металлические и неметаллические покрытия как метод защиты от коррозии. Схемы коррозионных элементов, возникающих при нарушении металлических покрытий.
Защитные покрытия. а) неметаллические - выполняют функцию изоляции металла от внешней среды (краски, лаки, эмали, полимерные и резиновые покрытия). б) металлические. Пока они не нарушены, металлические покрытия также выполняют функцию изоляции. По характеру поведения металла покрытия при их нарушении металлические покрытия делят на анодные и катодные.
При анодном покрытии защищаемый металл покрывают другим металлом с более отрицательным потенциалом (т.е. более активным металлом). Если покрытие нарушается, возникает коррозионный микрогальванический элемент, в котором металл покрытия служит анодом и разрушается, а защищаемый металл является катодным участком и служит подкладкой для газовых электродов. Покрытие выполняет защитную функцию до тех пор, пока полностью не растворится. Например, анодным покрытием для железного изделия может служить цинк.
Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
А (–) Cr | H2O, O2 | Fe (+) К
на аноде: Cr – 2e → Cr2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Cr2+ + 2 OH– → Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3 Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
При катодном покрытии потенциал металла покрытия больше, чем потенциал защищаемого металла, т.о. при его нарушении основной металл становится анодом и корродирует, а на покрытии происходят процессы водородной и кислородной деполяризации. Например, катодным покрытием для железа может служить медь.
Таким образом, катодное покрытие выполняет защитную функцию, только если не нарушено.
В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
А (–) Fe | H2O, O2 |Sn (+) К
на аноде: Fe – 2e → Fe2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Fe2+ + 2 OH– → Fe(OH)2
Разрушается защищаемый металл.
Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
|
|
|
 Скачать 3.53 Mb.
Скачать 3.53 Mb.

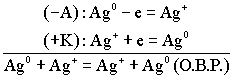










 Задача. Электролиз ZnSO4 проводили с нерастворимыми электродами в течение 6,7 ч, при этом выделилось 5,6 л O2. рассчитать силу тока, вычислить массу выделившегося на катоде Zn, если его выход по току 70%. pHр-ра=7
Задача. Электролиз ZnSO4 проводили с нерастворимыми электродами в течение 6,7 ч, при этом выделилось 5,6 л O2. рассчитать силу тока, вычислить массу выделившегося на катоде Zn, если его выход по току 70%. pHр-ра=7


 Анод
Анод
 OH –(H2O) H+(H2O) Eр(H+/H2)= ‑0,295В
OH –(H2O) H+(H2O) Eр(H+/H2)= ‑0,295В
 E
E
 При повышении напряжения вероятность выделения H2 уменьшается, т. е. его ВТ ↓. В точке i
При повышении напряжения вероятность выделения H2 уменьшается, т. е. его ВТ ↓. В точке i