Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
Карбамидные (мочевино-формальдегидные) смолы – получаются при реакции конденсации мочевины (NH2)2CO с формальдегидом CH2 = O в присутствии щелочей: Структурная формула смолы: 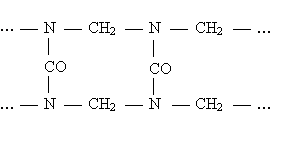 54. Способы получения полимеров Природные полимеры образуются в процессе биосинтеза в клетках живых организмов. С помощью экстракции, фракционного осаждения и других методов они могут быть выделены из растительного и животного сырья. Синтетические полимеры получают полимеризацией и поликонденсацией. Карбоцепные (моноцепные) полимеры обычно синтезируют полимеризацией мономеров. Гетероцепные полимеры получают поликонденсацией, а также полимеризацией мономеров, содержащих кратные связи углеродоэлемента (например, С=О, С=N, N=С=О) или непрочные гетероциклические группировки. В процессе полимеризации происходит разрыв кратных связей или раскрытие циклов у мономеров и возникновение химических связей между группами с образованием макромолекул:  По числу участвующих мономеров различают: гомополимеризацию(один вид мономера) и сополимеризацию(два и более видов мономеров). Поликонденсация– синтез полимера с несколькими функциональными группами, сопровождающийся образованием низкомолекулярных продуктов (H2O, NH3, HCl и др.). Элементные составы полимеров и исходных веществ не совпадают, за счет образования низкомолекулярных продуктов. Линейная поликонденсация: Конечный продукт -капрон (поли - ε -капроамид) [ - CO - NH - (CH2)5 -]n Поликонденсация идет по ступенчатому механизму, при этом промежуточные продукты являются стабильными, т.е. поликонденсация может остановиться на любой стадии. Образующиеся H2O, HCl, NH3 (низкомолекулярные) могут взаимодействовать с продуктами поликонденсации, вызывая их расщепление (гидролиз, аминолиз и др.), поэтому низкомолекулярные продукты приходится удалять из реакционной среды. Методом поликонденсации получают примерно четвертую часть выпускаемых полимеров (капрон - поликапроамид, найлон - полигексаметиленадипинамин, полиуретаны, фенолформальдегидные смолы и мочевиноформальдегидные). Материалы, получаемые на основе полимеров 1. На основе полимеров получают волокна путем продавливания растворов или расплавов через фильеры с последующим затвердеванием - это полиамиды, полиакрилонитрилы и др. 2. Полимерные пленки получают продавливанием через фильеры с щелевидными отверстиями или нанесением на движущую ленту. Их используют как электроизоляционный и упаковочный материал, основы магнитных лент. 3. Лаки - растворы пленкообразующих веществ в органических растворителях. 4. Клеи, композиции способные соединять различные материалы вследствие образования прочных связей между их поверхностями клеевой прослойкой. 5. Пластмассы 6. Композиты ( композиционные материалы ) - полимерная основа, армированная наполнителем. 55. Понятие о поверхностной энергии и поверхностном натяжении. Сорбционные процессы: классификация, термодинамические особенности, применение. В гетерогенных (неоднородных) системах существуют явления, возникающие на поверхности раздела фаз, обладающие свойствами, отличающимися от свойств системы внутри каждой фазы. Частицы, расположенные на поверхности, находятся в другом окружении по сравнению с частицами, находящимися в объеме фазы, т.е. взаимодействуют как с однородными частицами, так и с частицами другого рода. 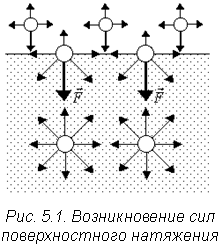 Следствием этого является то, что средняя энергия gs частицы, находящейся на поверхности раздела фаз, отличается от средней энергии такой же частицы в объеме фазы gv (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Поэтому важнейшей характеристикой поверхностной фазы является поверхностная энергия Gs– разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности N: Общая величина поверхностной энергии фазы будет определяться величиной её поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой, вводится понятие поверхностное натяжение σ – отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз. Как и поверхностная энергия фазы, поверхностное натяжение может иметь как положительное, так и отрицательное значение. Поверхностное натяжение положительно, если находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы (и, следовательно, gs > gv). Согласно принципу минимума свободной энергии, любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию; поэтому в случае положительного поверхностного натяжения (σ > 0) фаза стремится уменьшить свою поверхность. В случае если σ < 0, поверхностная энергия фазы будет уменьшаться при увеличении площади поверхности. На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Для этого необходимо: уменьшить площадь поверхности фазы (капля жидкости в невесомости принимает форму сферы), уменьшить поверхностное натяжение за счет появления на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс поглощения одного вещества поверхностью или объемом другого называется сорбцией или сорбционными процессами. Вещество, частицы которого поглощаются (газ, жидкость или растворенный компонент), называют сорбатом, а поглотитель (чаще твердое тело) – сорбентом. По характеру поглощения сорбата сорбционные явления делятся на два типа: адсорбцию — концентрирование сорбата на поверхности раздела фаз или его поглощение поверхностным слоем сорбента абсорбцию — объёмное поглощение, при котором сорбат распределяется по всему объёму сорбента. Термодинамика процесса адсорбции: Поскольку, как правило, межмолекулярное взаимодействие молекул адсорбата менее интенсивно, чем адсорбента, адсорбция протекает с уменьшением свободной энергии поверхности (ΔF < 0) и выделением тепла (уменьшением энтальпии ΔН < 0). При равновесии процессов адсорбции и десорбции ΔF = 0. При адсорбции уменьшается и энтропия системы (ΔS < 0), поскольку молекулы абсорбтива ограничивают подвижность молекул полимера, уменьшая возможное число конформаций: ΔS = kln (W2 / W1), где k - постоянная Больцмана, W2 и W1 - термодинамическая вероятность конечного и начального состояния системы. Сорбционные процессы играют большую роль в технике. Например, для поддержания высокого вакуума в действующем электровакуумном приборе применяют геттеры – специально изготовленные материалы, которые активно поглощают остаточные газы. В качестве геттеров используют компактные (Zr, Ta, Nb и др.) или распыленные (Ba, Ca, Sr ) металлы. Сорбционные процессы широко используют в металлургии при обогащении руд (флотация), в энергетике при водоподготовке (ионный обмен) и др. Сорбенты используют в медицине (при отравлениях), в быту (при фильтрации воды) и т.д. 56. Понятие адсобции. Адсорбция физическая и химическая, их особенности. Адсорбцию — процесс поглощения одного вещества поверхностью другого, т.е. концентрирование сорбата на поверхности раздела фаз или его поглощение поверхностным слоем сорбента. Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. Поглатители, т.е.твердые вещества, поглащающие газ или жидкость, а также жидкости, поглащающие газ называются адсорбентами. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколько угодно долго, если неизменны внешние условия (давление, температура и состав системы). Различают: физическую адсорбцию, при которой повышение концентрации сорбата на поверхности раздела фаз обусловлено неспецифическими (то есть не зависящими от природы вещества) силами Ван-дер-Ваальса. химическую адсорбцию (хемосорбцию), обусловленную протеканием химических реакций сорбата с веществом поверхности сорбента. Физическая адсорбция слабоспецифична, обратима и её тепловой эффект невелик (единицы кДж/моль). Условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S – P. Физическая адсорбция может протекать с образованием монослоя (я), поликонденсата (2), а также с определенной избирательностью (3). 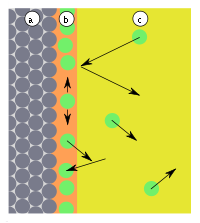 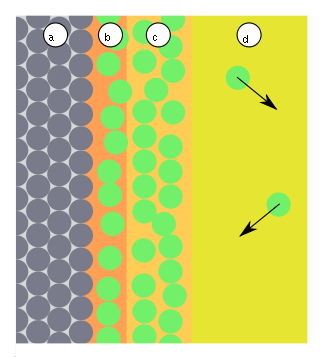 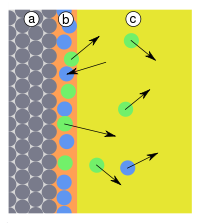 Хемосорбция избирательна, обычно необратима и её теплота составляет от десятков до сотен (хемосорбция кислорода на металлах) кДж/моль. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция. 57. Зависимость адсорбции от различных факторов. Изотерма адсорбции. Теория мономолекулярной адсорбции. Количественно адсорбцию можно выражать в молях адсорбата на единицу площади адсорбента, моль/м2. Адсорбция зависит от: природы адсорбента и адсорбата, температуры, концентрации или давления адсорбата. Кривую зависимости величины адсорбции (Г) от равновесных концентраций С или давлений р адсорбата при постоянной температуре Т называют изотермой адсорбции: Г = f(C) или Г = f(p) при Т = const. Изотерма адсорбции на однородной поверхности адсорбента была выведена американским ученым Дж.Лэнгмюром и получила название теории мономолекулярной адсорбции, которая основывается на следующих положениях. 1) Адсорбция является локализованной и вызывается силами, близкими к химическим. 2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными. 3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул. 4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие. В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 – х). Максимально возможная величина адсорбции Го достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Го. Подставив это в уравнение, получаем: Уравнение есть изотерма мономолекулярной адсорбции, связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рис., где константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0. 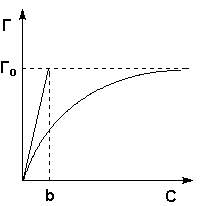 Рис. Изотерма мономолекулярной адсорбции При описании процесса адсорбции газов в уравнении концентрация может быть заменена пропорциональной величиной парциального давления газа: Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата. 58. Адсорбция из растворов: особенности, виды. Ионообменная адсорбция, ее применение. Изотермы адсорбции растворенных веществ из раствора по своему виду аналогичны изотермам адсорбции для газов; для разбавленных растворов эти изотермы хорошо описываются уравнениями Ленгмюра, если в них подставить равновесную концентрацию растворенного вещества в растворе. Однако адсорбция из растворов является значительно более сложным явлением по сравнению с газовой, поскольку одновременно с адсорбцией растворенного вещества часто происходит и адсорбция растворителя. Молекулярная адсорбция из растворов определяется зависимостью адсорбции от строения молекул адсорбата, поэтому вывести какие-либо закономерности довольно трудно. Адсорбция из растворов электролитов происходит, как правило, таким образом, что на твердом адсорбента из раствора адсорбируются преимущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют специфическую и ионообменную адсорбцию. При специфической адсорбции твердая фаза поглощает из раствора ионы какого-либо знака, при этом она приобретает электрический заряд. Это приводит к тому, что вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом, т.е. образуется двойной электрический слой. Взаимодействие концентрирующихся на поверхности зарядов приводит к понижению поверхностной энергии системы. Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило (правило Пескова – Фаянса): На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение. Ионообменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Ионообменная адсорбция имеет следующие особенности: 1) специфична, т. е. к обмену способны только определенные ионы; 2) протекает более медленно, чем молекулярная адсорбция; 3) может приводить к изменению рН среды. |
