Важнейшие химические понятия и законы Химический элемент это определенный вид атомов с одинаковым зарядом ядра Атом
 Скачать 3.53 Mb. Скачать 3.53 Mb.
|
|
Ионообменники (или иониты) – вещества, проявляющие способность к ионному обмену при контакте с раствором электролитов. В зависимости от того, какой вид ионов участвует в обмене, иониты подразделяются на катиониты и аниониты. Катиониты способны обменивать катионы, в т.ч. ион Н+, аниониты – анионы, в т.ч. ион ОН–. Существуют также амфолиты, которые в зависимости от условий (главным образом, рН) способны проявлять как катионообменные, так и анионообменные свойства. Различают природные и синтетические иониты. Природные: алюмосиликатные материалы – гидрослюда, цеолиты, монтмориллонит и т.д. Синтетические: ионообменные смолы, сульфитированные угли, ионообменные целлюлозы, синтетические волокнистые материалы. Применение ионного обмена: – очистка сточных вод, умягчение и обессоливание воды; – в пищевой промышленности – обесцвечивание сахарорафинадных сиропов, при получении ионитного молока (изменения его солевого состава), для предотвращения помутнения и понижения кислотности вина и др. – в хроматографии; – ионный обмен имеет место в почве, и ее ионообменная емкость является одной из характеристик, определяющих ценность почвы. 59. Смачивание и его виды. Гидрофильность и гидрофобность. Смачивание- физическое взаимодействие жидкости с поверхностью твёрдого тела или другой жидкости. Смачивание бывает двух видов: Иммерсионное (вся поверхность твёрдого тела контактирует с жидкостью) Контактное (состоит из трёх фаз — твердая, жидкая, газообразная) Смачивание зависит от соотношения между силами сцепления молекул жидкости с молекулами (или атомами) смачиваемого тела (адгезия) и силами взаимного сцепления молекул жидкости (когезия). Если жидкость контактирует с твёрдым телом, то существуют две возможности: молекулы жидкости притягиваются друг к другу сильнее, чем к молекулам твёрдого тела. В результате силы притяжения между молекулами жидкости собирают её в капельку. Так ведёт себя ртуть на стекле, вода на парафине или «жирной» поверхности. В этом случае говорят, что жидкость не смачивает поверхность; молекулы жидкости притягиваются друг к другу слабее, чем к молекулам твёрдого тела. В результате жидкость стремится прижаться к поверхности, расплывается по ней. Так ведёт себя ртуть на цинковой пластине, вода на чистом стекле или дереве. В этом случае говорят, что жидкость смачивает поверхность. Согласно второму началу термодинамики, смачивание как самопроизвольный процесс сопровождается уменьшением энергии системы, в частности свободной поверхностной энергии Gs. Гидрофильность (от др.-греч. ὕδωρ — вода и φιλία — любовь) — характеристика интенсивности молекулярного взаимодействия вещества с водой, способность хорошо впитывать воду, а также высокая смачиваемость поверхностей водой. Гидрофильность характеризуется величиной адсорбционной связи молекул вещества с молекулами воды, образованием с ними неопределённых соединений и распределением количества воды по величинам энергии связи. Гидрофильностью обладают вещества с ионными кристаллическими решётками оксиды, гидроксиды, силикаты, сульфаты, фосфаты, глины, стёкла и др.), вещества с полярными группами —ОН, —СООН, —NO2 и др. Гидрофобность (от др.-греч. ὕδωρ — вода и φόβος — боязнь, страх) — это физическое свойство молекулы, которая «стремится» избежать контакта с водой. Сама молекула в этом случае называется гидрофобной. Гидрофобные молекулы обычно неполярны и «предпочитают» находиться среди других нейтральных молекул и неполярных растворителей. Поэтому вода на гидрофобной поверхности собирается в капли. А при добавлении в воду гидрофобных жидкостей, в зависимости от плотности, они собираются в изолированные сгустки, либо распределяются по поверхности воды, как происходит с нефтью. Гидрофобными являются молекулы алканов, масел, жиров и других подобных материалов. Гидрофобные материалы используются для очистки воды от нефти, удаления разливов нефти и химических процессов разделения полярных и неполярных веществ. Таким образом, по отношению к воде практически все вещества можно разделить на две группы: 1. Гидрофильные (от греч. "филео" – любить, имеющие положительное сродство к воде). Эти вещества имеют полярную молекулу, в результате чего отдельные атомы таких молекул также обретают частичные заряды и образуют водородные связи с молекулами воды. Примеры: сахара, аминокислоты, органические кислоты. 2. Гидрофобные (от греч. "фобос" – страх, имеющие отрицательное сродство к воде). Молекулы таких веществ неполярны и не смешиваются с полярным растворителем, каковым является вода, но хорошо растворимы в органических растворителях, например, в эфире. Примером могут служить углеводороды (бензин, керосин, парафин), животный жир, растительное масло. Молекулы многих органических веществ состоят из полярной (гидрофильной) и неполярной (гидрофобной) группировок, т.е. являются поверхностно-активными веществами. Молекулы ПАВ при адсорбции на твердом адсорбенте ориентируются на его поверхности таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной. Так, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном адсорбенте – активированном угле – молекулы ориентируются углеводородными радикалами к адсорбенту; при адсорбции из бензола (неполярный растворитель) на полярном адсорбенте – силикагеле – ориентация молекул кислоты будет обратной. 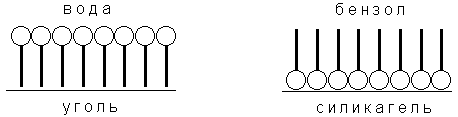 Рис. Ориентация молекул ПАВ на поверхности адсорбента 60. Поверхностно-активные вещества: строение, свойства, классификация, области применения. Роль ПАВ в стабилизации дисперсных систем. Поверхностно-активные вещества (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела термодинамических фаз, вызывают снижение поверхностного натяжения. Основной количественной характеристикой ПАВ является поверхностная активность — способность вещества снижать поверхностное натяжение на границе раздела фаз — это производная поверхностного натяжения по концентрации ПАВ при стремлении С к нулю. Однако, ПАВ имеет предел растворимости (так называемую критическую концентрацию мицеллообразования, или ККМ), с достижением которого при добавлении ПАВ в раствор концентрация на границе раздела фаз остаётся постоянной, но в то же время происходит самоорганизация молекул ПАВ в объёмном растворе (мицеллообразование или агрегация). В результате такой агрегации образуются так называемые мицеллы. Отличительным признаком мицеллообразования служит помутнение раствора ПАВ. Водные растворы ПАВ, при мицеллообразовании также приобретают голубоватый оттенок (студенистый оттенок) за счёт преломления света мицеллами. Как правило, ПАВ — органические соединения, имеющие амфифильное строение, то есть их молекулы имеют в своём составе полярную часть, гидрофильный компонент (функциональные группы -ОН, -СООН, -SOOOH, -O- и т. п., или, чаще, их соли -ОNa, -СООNa, -SOOONa и т. п.) и неполярную (углеводородную) часть, гидрофобный компонент. Примером ПАВ могут служить обычное мыло (смесь натриевых солей жирных карбоновых кислот — олеата, стеарата натрия и т. п.) и СМС (синтетические моющие средства), а также спирты, карбоновые кислоты, амины и т. п. Классификация ПАВ Ионогенные ПАВ Катионные ПАВ Анионные ПАВ Амфотерные ПАВ Неионогенные ПАВ Алкилполиглюкозиды Алкилполиэтоксилаты Области применения Моющие средства. Основное применение ПАВ — в качестве активного компонента моющих и чистящих средств (в том числе, применяемых для дезактивации), мыла, для ухода за помещениями, посудой, одеждой, вещами, автомобилями и пр. В настоящее время самым распространенным ПАВ в синтетических моющих средствах является алкилбензосульфонат. Наука. ПАВ широко применяются в исследованиях, например, в биологии для разрушения клеточных мембран в целях выделения компонентов клеток (белки, хроматин, РНК) для непосредственного их анализа или использования в других экспериментах). Косметика. Основное использование ПАВ в косметике — шампуни, где содержание ПАВ может достигать десятков процентов от общего объёма. Также ПАВ используются в небольших количествах в зубной пасте, лосьонах, тониках и других продуктах. Текстильная промышленность. ПАВ используются в основном для снятия статического электричества на волокнах синтетической ткани. Кожевенная промышленность. Защита кожаных изделий от лёгких повреждений и слипания. Лакокрасочная промышленность. ПАВ используются для снижения поверхностного натяжения, что обеспечивает лёгкое проникновение красочного материала в маленькие углубления на обрабатываемой поверхности и их заполнение с вытеснением при этом оттуда другого вещества (например, воды). Бумажная промышленность. ПАВ используются для разделения чернил и варёной целлюлозы при переработке использованной бумаги. Молекулы ПАВ адсорбируются на пигменте чернил. Пигмент становится гидрофобным. Далее воздух пропускается через раствор пигмента и целлюлозы. Пузырьки воздуха адсорбируются на гидрофобной части ПАВ и частички пигмента чернил всплывают на поверхность. См. флотация. Пищевая промышленность. ПАВ в виде эмульгаторов (например лецитина) добавляют для улучшения вкусовых качеств мороженого, шоколада, взбитых сливок, соусов, печенья и других блюд. В жидких растворах поверхностное натяжение σ является функцией от концентрации растворенного вещества. На рис. представлены три возможных зависимости поверхностного натяжения от концентрации раствора (т.н. изотермы поверхностного натяжения). Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ), вещества, добавление которых увеличивает или не изменяет поверхностное натяжение – поверхностно-инактивными (ПИАВ). 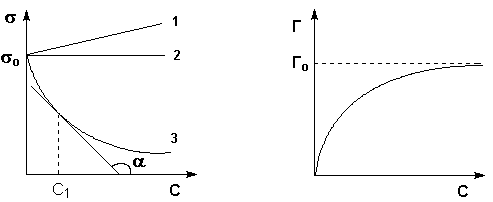 Рис. 4.1 Изотермы поверхностного натяжения Рис. 4.2 Изотерма адсорбции растворов ПИАВ (1, 2) и ПАВ (3) ПАВ на границе раствор – пар Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате адсорбции ПАВ на поверхности раздела жидкость – пар, т.е. того, что концентрация поверхностно-активного вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора. 61. Дисперсные системы: понятие, классификация. Дисперсной системой называется гетерогенная система, в которой мелкие частицы одной фазы равномерно распределены в объеме другой фазы. Дисперсная система состоит из однородной непрерывной фазы - дисперсионной среды, в которой равномерно распределены мелкие частицы дисперсной фазы. Природные дисперсные системы очень разнообразны. Их можно классифицировать по различным признакам. По размеру частиц дисперсной фазы:
По агрегатному состоянию дисперсной фазы и дисперсионной среды:
По характеру взаимодействия дисперсной фазы с дисперсионной средой:
По структурно-механическим свойствам:
Коллоидными системами являются многие биологические жидкости живого организма: кровь, плазма, лимфа, спинно-мозговая жидкость, моча и др. Переход свежеосажденного осадка в золь называется пептизацией. Коллоидные растворы (золи) образуются при распределении в дисперсионной среде малорастворимых веществ дисперсной фазы. Они состоят из частиц очень малых размеров, поэтому суммарная поверхность всех частиц S очень велика. В системе возникает огромная свободная поверхностная энергия GS= σS. В соответствии со вторым началом термодинамики такие системы термодинамически неустойчивы; в них самопроизвольно протекают процессы, направленные на снижение поверхностной энергии (GS 0) и проявляющиеся в стремлении коллоидных частиц объединяться в более крупные агрегаты. Тем не менее в природе лиофобные коллоидные растворы могут существовать длительное время без существенных изменений из-за присутствия в растворе молекул или ионов, выполняющих роль стабилизатора таких систем. Частицы стабилизатора адсорбируются на поверхности коллоидных частиц, увеличивают их сродство к дисперсионной среде и препятствуют слипанию частиц между собой. 62. Способы получения дисперсных систем Обязательным условием получения дисперсных систем является взаимная нерастворимость фазы и среды. для образования устойчивых лиофобных коллоидных растворов необходимо выполнение следующих условий: 1) малая растворимость дисперсной фазы в дисперсионной среде; 2) определенные размеры частиц дисперсной фазы (10-9 - 10-7 м); 3) наличие в системе стабилизатора. При выполнении этих условий в коллоидном состоянии можно получить любое вещество. Первое условие выполняется правильным выбором растворителя. Если вещество хорошо растворимо в данном растворителе, то самопроизвольно получается истинный раствор, однако при использовании растворителя, в котором оно плохо растворимо, можно получить коллоидный раствор. Например, при растворении в воде хлорида натрия всегда получается истинный раствор, однако введение хлорида натрия в бензол, где он плохо растворим, может привести к образованию коллоидного раствора. Невозможно получить коллоидный спиртовой раствор канифоли, поскольку она хорошо растворима в спирте, однако при определенных условиях образуется коллоидный раствор канифоли в воде, где она растворима плохо. Второе условие - получение частиц определенного размера - можно выполнить разными способами. Поскольку коллоидные растворы по размерам частиц дисперсной фазы занимают промежуточное положение между грубодисперсными системами и истинными растворами, коллоидные частицы можно получить двумя путями: 1) измельчением крупных частиц до размеров коллоидных - диспергационные методы; 2) объединением молекул и ионов в истинных растворах в более крупные коллоидные частицы - конденсационные методы. | ||||||||||||||||||||||||||||||||||||||||||||||||||
