Вопрос1 Статистическая обработка результатов эксперимента
 Скачать 6.64 Mb. Скачать 6.64 Mb.
|
|
Адиабатный процесс  Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид: du + pdv = 0 или Δu+ l = 0, следовательно Δu= —l. В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа. Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом: dq = cадdT = 0. Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0). Известно, что сp/cv = k и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид: pvk = const. В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона). Значения показателя адиабаты k для некоторых газов: kвоздуха = 1,4 kперегретого пара = 1,3 kвыхлопных газов ДВС = 1,33 kнасыщенного влажного пара = 1,135 Из предыдущих формул следует: l= — Δu = cv(T1 – T2); i1 – i2= cp(T1 – T2). Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2). Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией. Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом. Уравнение Менделеева-Клапейрона Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных. Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева): PV = nRT где n – число молей газа; P – давление газа (например, в атм; V – объем газа (в литрах); T – температура газа (в кельвинах); R – газовая постоянная (0,0821 л·атм/моль·K). Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атм и температуре 26 оС. Вопрос: сколько молей O2 содержится в колбе? Из газового закона найдем искомое число молей n:  Не следует забывать преобразовывать температуру из градусов Цельсия в кельвины: (273 оС + 26 оС) = 299 K. Вообще говоря, чтобы не ошибиться в подобных вычислениях, нужно внимательно следить за размерностью величин, подставляемых в уравнение Клапейрона-Менделеева. Если давление дается в мм ртутного столба, то нужно перевести его в атмосферы, исходя из соотношения: 1 атм = 760 мм рт. ст. Давление, заданное в паскалях (Па), также можно перевести в атмосферы, исходя из того, что 101325 Па = 1 атм. Билет 16 Вывод основного уравнения молекулярно-кинетической теории. Число степеней свободы молекулы. Закон распределения энергии по степеням свободы. Вывод основного уравнения МКТ. 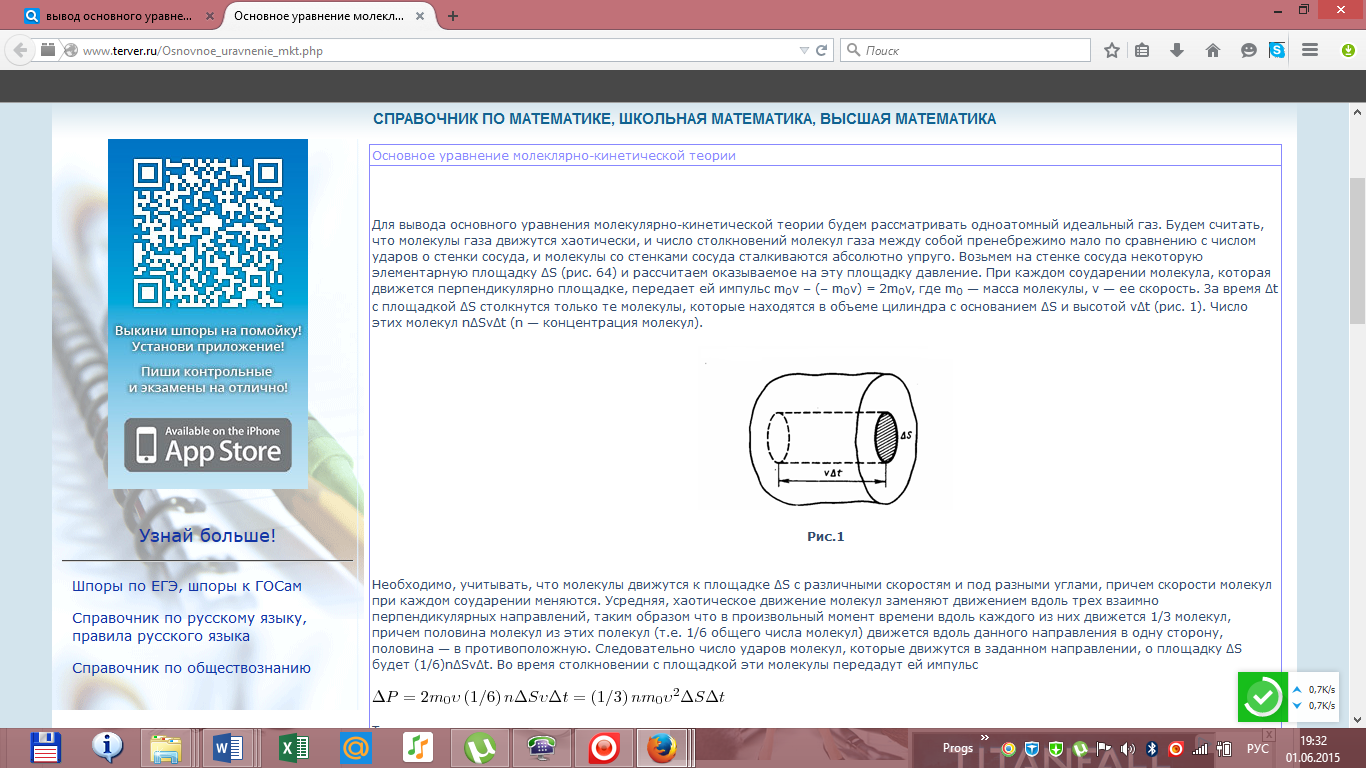 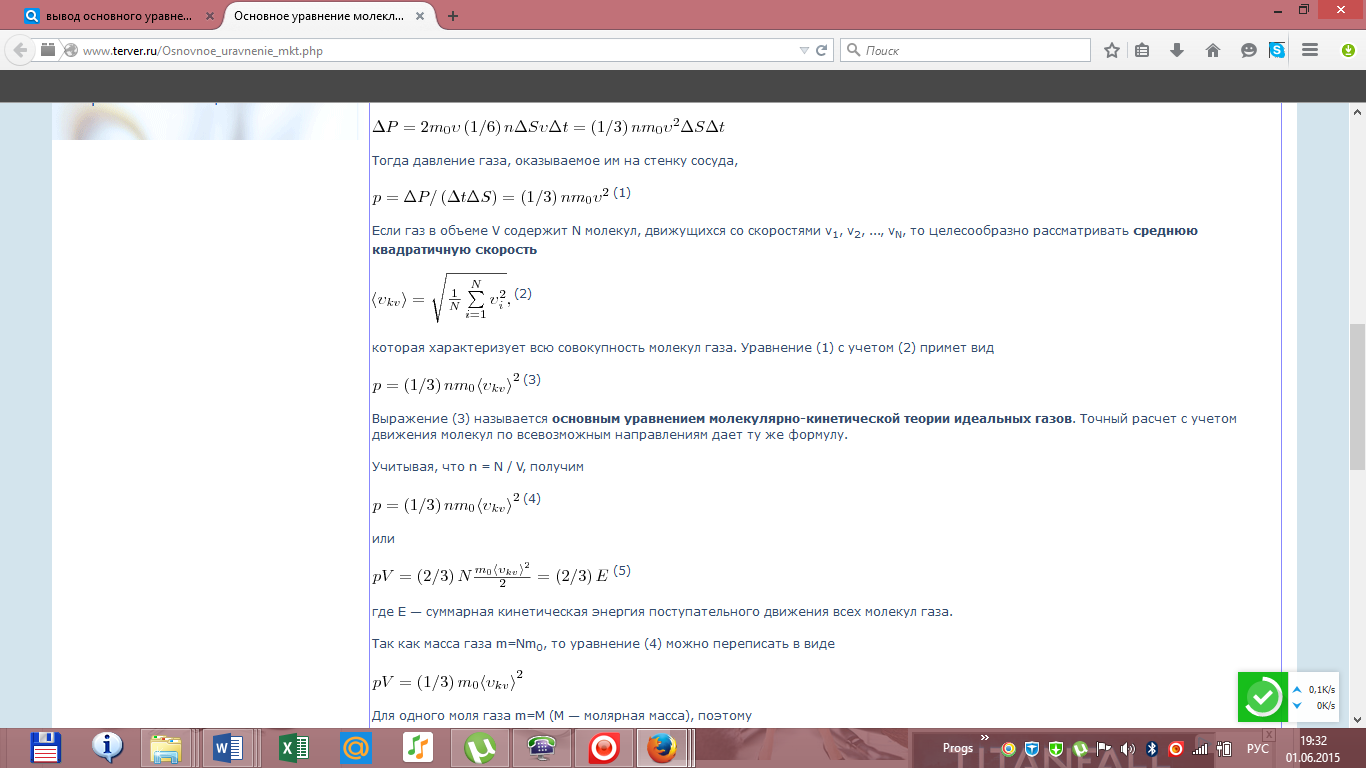 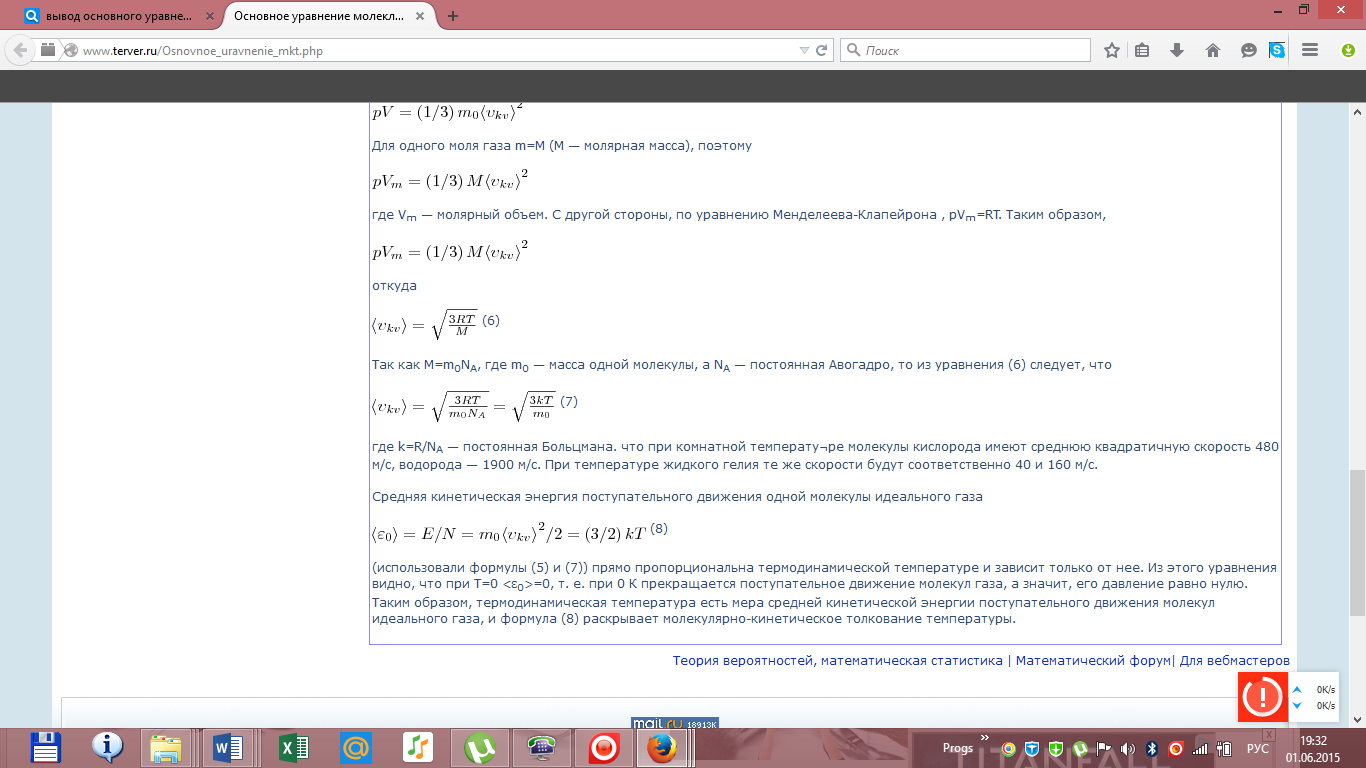 Число степеней свободы молекулы. Закон распределения энергии по степеням свободы.   Билет 17. Первое начало термодинамики. Работа газа при изменении объема. Вычислить работу изотермического расширения газа. Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. В циклическом процессе внутренняя энергия не изменяется.   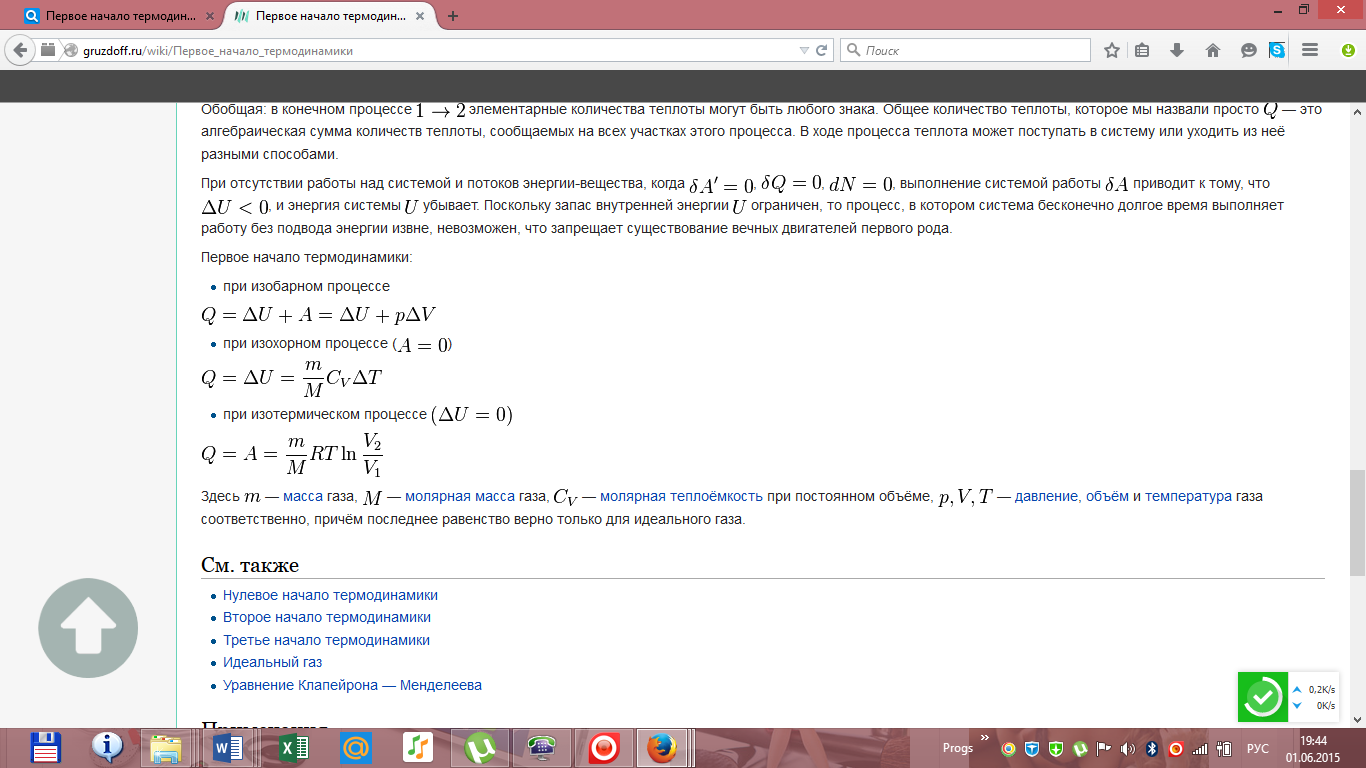 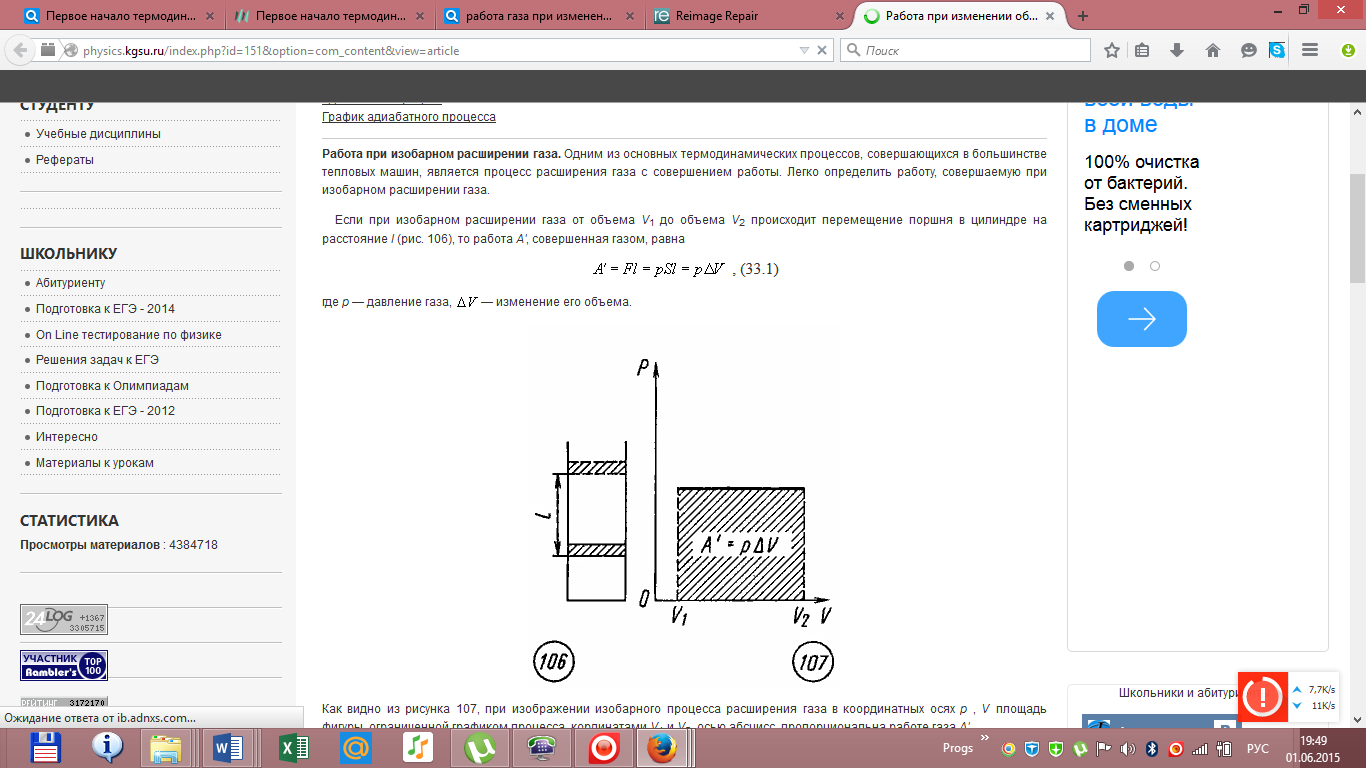  Работа при изотермическом расширении газа вычисляется как площадь фигуры под графиком процесса.  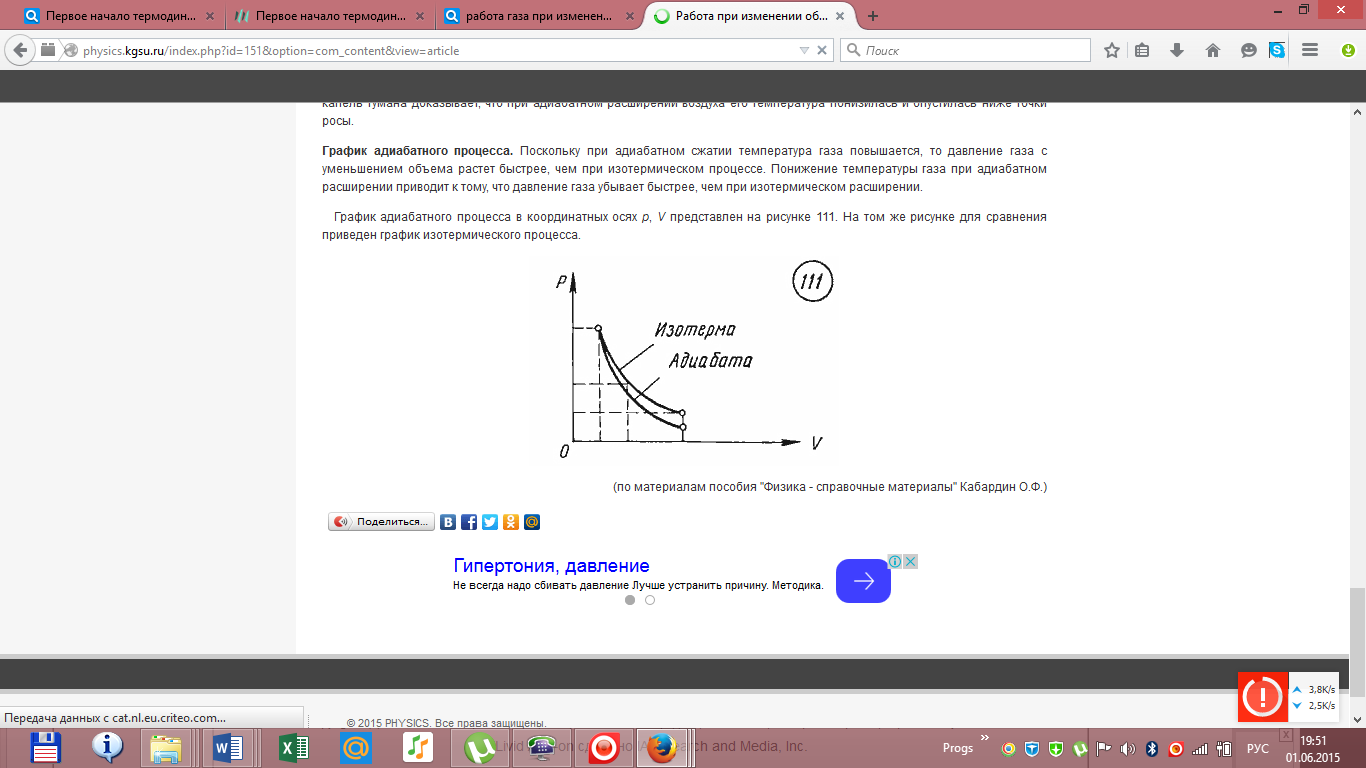 Билет 18. Теплоемкость идеального газа. Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C:
где M – молярная масса вещества. Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует CV ΔT = ΔU.
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. Для процесса при постоянном давлении первый закон термодинамики дает: p (V2 – V1) = CV ΔT + pΔV,
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
где R – универсальная газовая постоянная. При p = const
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
Молярная теплоемкость Cp газа в процессе с постоянным давлением всегда больше молярной теплоемкости CV в процессе с постоянным объемом Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ. Билет 19. Цикл Карно. Тепловая и холодильная машины. КПД цикла Карно. В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником. Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году. Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно . Пусть тепловая машина состоит из нагревателя с температурой Тн, холодильника с температурой Тх и рабочего тела. Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия). 1. Изотермическое расширение (на рис. 1 — процесс A→Б). В начале процесса рабочее тело имеет температуру Тн, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q. При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает. 2. Адиабатическое расширение (на рис. 1 — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника Тх, тело совершает механическую работу, а энтропия остаётся постоянной. 3. Изотермическое сжатие (на рис. 1 — процесс В→Г). Рабочее тело, имеющее температуру Тн, приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты Q. Над телом совершается работа, его энтропия уменьшается. 4. Адиабатическое сжатие (на рис. 1 — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной. Обратный цикл Карно В термодинамике холодильных установок и тепловых насосов рассматривают обратный цикл Карно, состоящий из следующих стадии: адиабатического сжатия за счёт совершения работы (на рис. 1 — процесс В→Б); изотермического сжатия с передачей теплоты более нагретому тепловому резервуару (на рис. 1 — процесс Б→А); адиабатического расширения (на рис. 1 — процесс А→Г); изотермического расширения с отводом теплоты от более холодного теплового резервуара (на рис. 1 — процесс Г→В). 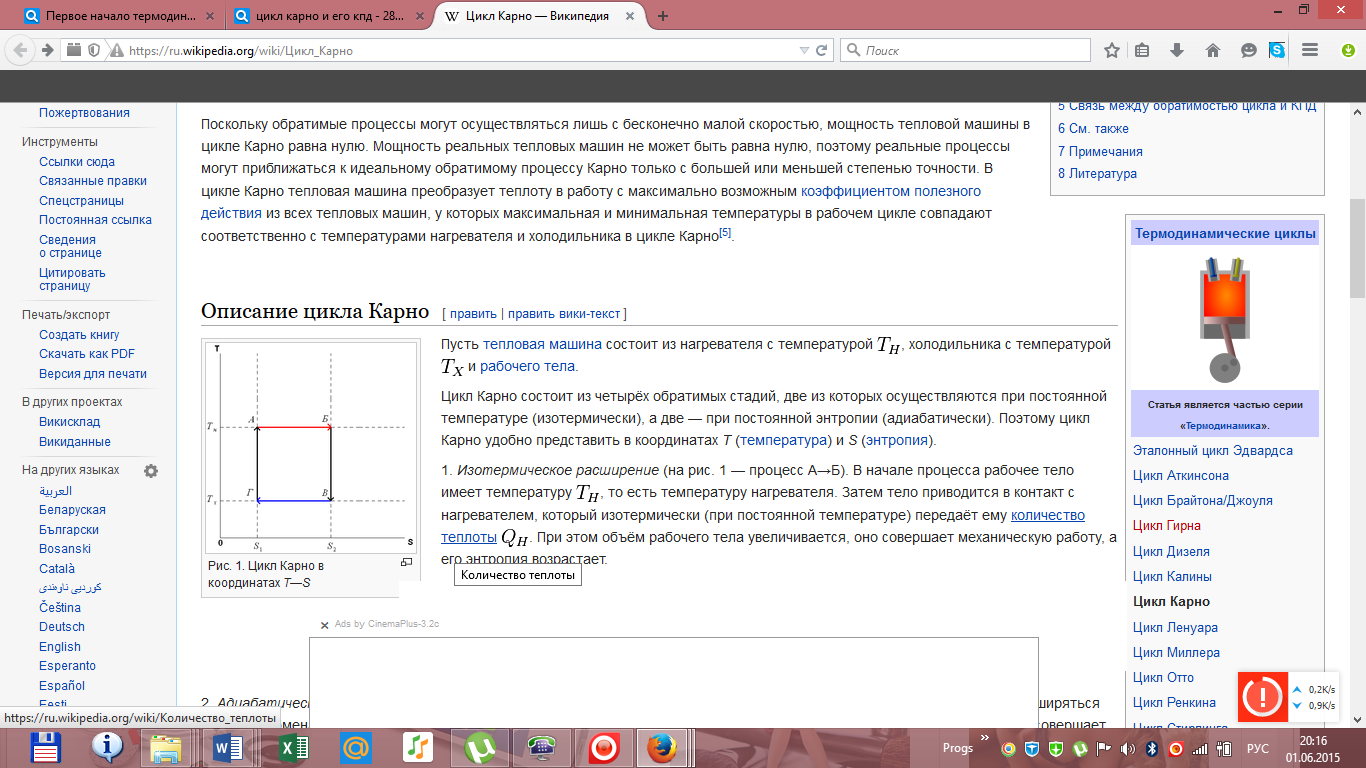  Билет 20. Второе начало термодинамики. Энтропия. Третье начало термодинамики. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов, которые могут происходить в термодинамических системах. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой). Второе начало термодинамики является постулатом, не доказываемым в рамках классической термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения. Постулат Клаузиуса: «Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому»(такой процесс называется процессом Клаузиуса). Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона). Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии). Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано. В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны. Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных. Третье начало термодинамики может быть сформулировано так: «Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система». Третье начало термодинамики относится только к равновесным состояниям. Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение). Третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю. Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). Термодинамическая энтропия S, часто просто именуемая энтропия, — физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин. Энтропия является функцией состояния и широко используется в термодинамике, в том числе химической. 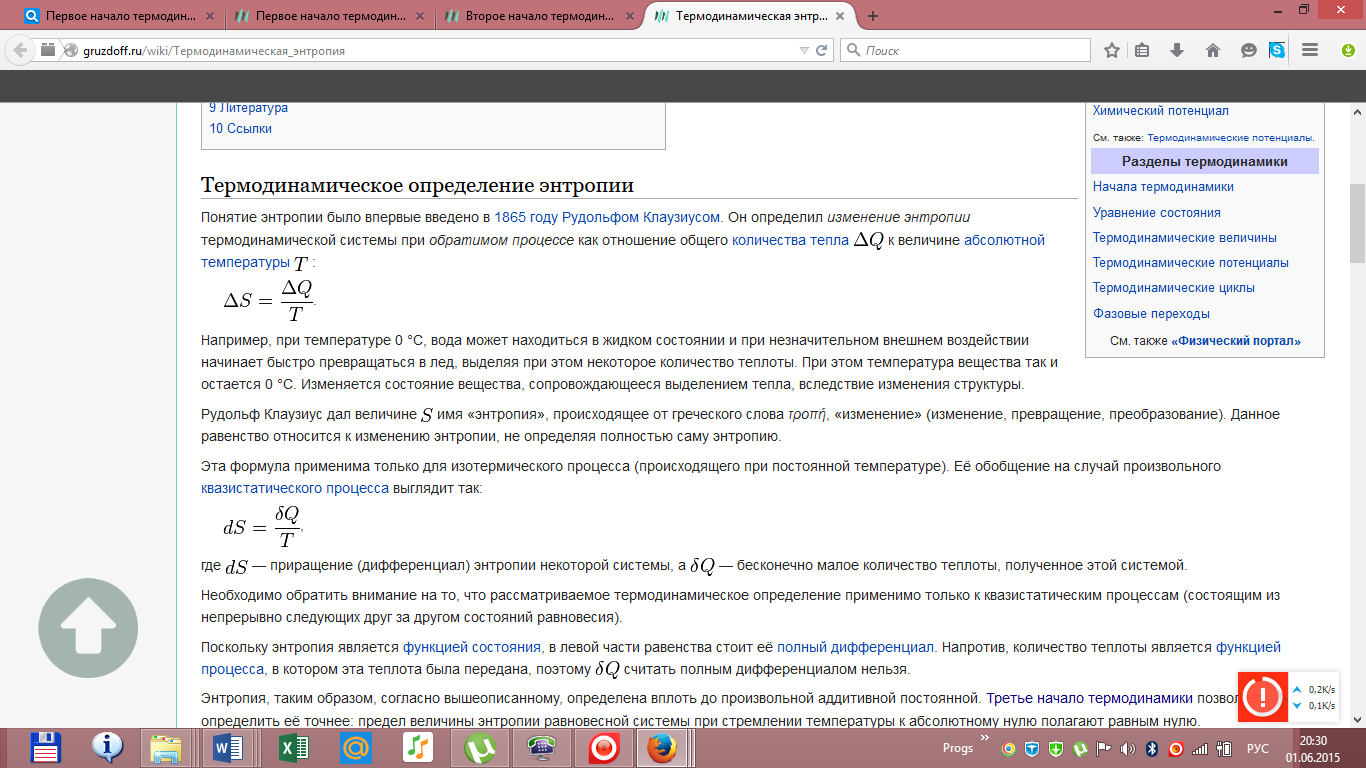 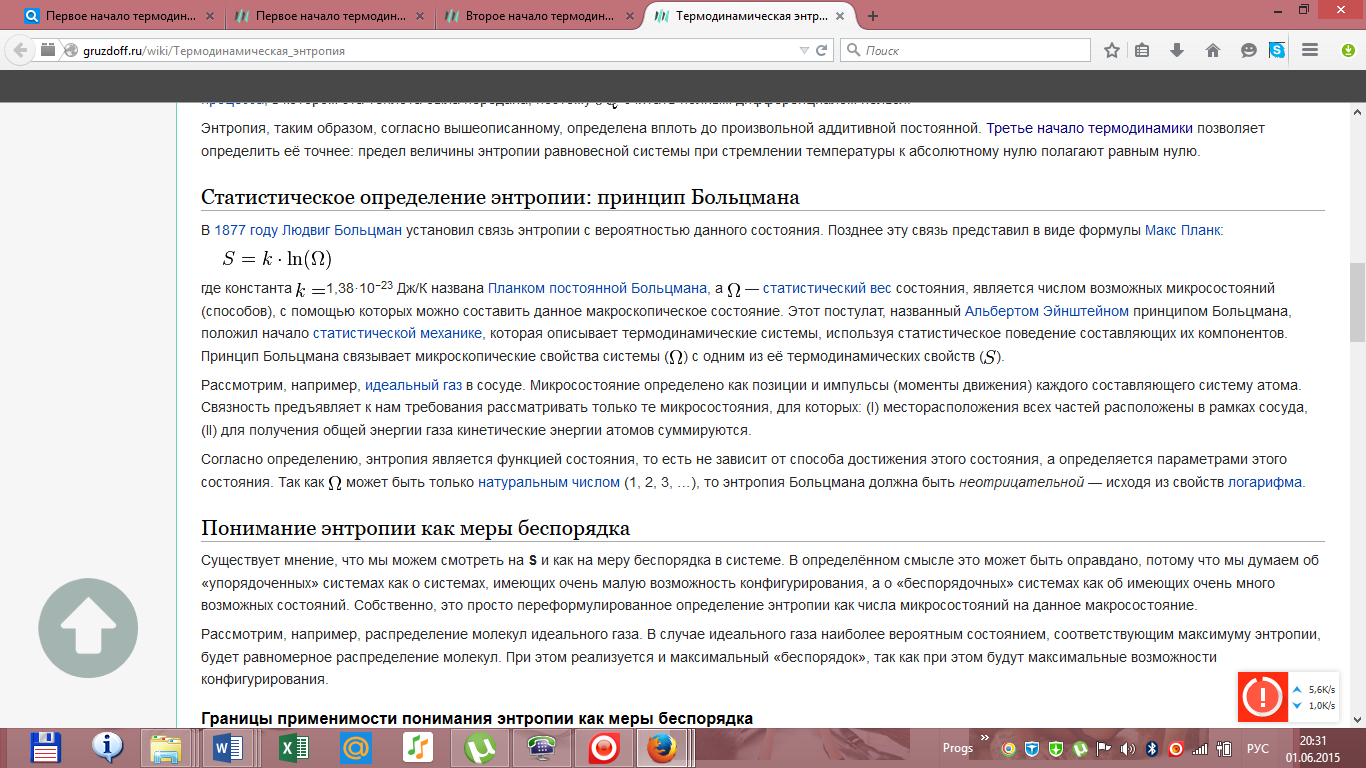 |
