Лекции по органической химии 1 курс. Введение органическая химия
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
Природные источники ароматических углеводородовВ промышленности ароматические углеводороды получают путем сухой перегонки каменного угля, а также из нефти. Получение из каменного угляКаменный уголь – один из наиболее ценных для народного хозяйства ископаемых продуктов, добываемых в огромных количествах. Используют каменный уголь как топливо и как сырье для получения многих важных продуктов. По составу каменный уголь – сложное органическое вещество; в процессе сухой перегонки, т.е. при нагревании в печах без доступа воздуха, при температуре 1000 оС и выше, он разлагается и образуются следующие основные продукты: а) кокс (75-80 %); б) коксовый газ (до 3,5 %) и г) аммиачная вода (содержащая в основном неорганические вещества, главным образом аммиак). Кокс – твердый продукт, представляющий собой углерод с некоторой примесью золы. Используется в металлургии как восстановитель, для выделения металлов, в основном железа, из руд (в доменном процессе). До начала второй половины XIX в. сухую перегонку каменного угля производили почти исключительно с целью получения кокса, поэтому этот процесс называют также процессом коксования угля. Коксовый газ – побочный продукт коксования углей. Иначе его называют светильным газом, т.к. первоначально его использовали лишь как горючее, преимущественно для освещения. Основные составные части коксового газа – метан (30-50 %) и водород (30-50 %); кроме того, он содержит значительное количество паров ароматических углеводородов. Путем поглощения маслом с последующей отгонкой из коксового газа выделяют сырой бензол (до 1,5 % от веса угля) – смесь ароматических углеводородов с температурой кипения до 160 оС. Из сырого бензола ректификацией получают чистый бензол, толуол, смесь ксилолов. Этим способом добывают основное количество бензола. Таким образом, в настоящее время коксовый газ – не только горючее, но и ценный источник ароматических соединений. Каменноугольная смола (или каменноугольный деготь) – темная вязкая жидкость с неприятным запахом. До середины XIX столетия была бросовым продуктом коксования углей и ее подвергали уничтожению. Оказалось же, что она содержит множество ценнейших в практическом отношении ароматических соединений. Поэтому в настоящее время каменноугольную смолу подвергают тщательной переработке. Путем перегонки ее разделяют на следующие фракции (в % от веса смолы): 1) легкое масло, Ткип. до 160 оС (до 2 %); 2) среднее масло, Ткип. 160-230 оС (до 12 %); 3) тяжелое, или креозотовое, масло, Ткип. 230-270 оС (до 10 %); 4) антраценовое, или зеленое масло, Ткип. 270-360 оС (до 23 %); 5) пек – остаток от перегонки (до 60 %). Из легкого масла получают бензол (но значительно меньше, чем из коксового газа), толуол, ксилолы; из среднего – нафталин, фенолы, пиридин; из тяжелого – в основном нафталин; из антраценового – антрацен, фенантрен и др. Пек – черная твердая масса, размягчающаяся при нагревании; применяется как строительный материал, для покрытия дорог и т.д. Получение из нефтиВ состав нефти входят преимущественно ациклические (жирные) и иногда алициклические углеводороды. Ароматические углеводороды содержатся в ней обычно в незначительных количествах. Только в некоторых месторождениях имеется нефть, относительно богатая ароматическими углеводородами, которые могут быть из нее выделены. Но в течение последних десятилетий были разработаны в промышленных масштабах различные способы ароматизации нефти. Они заключаются в повышении содержания ароматических углеводородов в нефти и в нефтепродуктах путем проведения крекинга и пиролиза (каталитический риформинг) при определенных температурах и особенно при помощи каталитических процессов – дегидроциклизации и дегидрирования, содержащихся в нефти жирных и алициклических углеводородов. Отдельные представители ароматических углеводородов ряда бензолаБензол C6H6: бесцветная легковоспламеняющаяся жидкость с характерным запахом. Ткип. 80,1 оС, Тпл. 5,53 оС; d204 =0,8790. Очень мало растворим в воде. Пары бензола при вдыхании оказывают вредное действие на организм. Бензол – один из наиболее ценных в промышленном отношении продуктов сухой перегонки каменного угля. Служат исходным продуктом в промышленности красящих и лекарственных веществ, в производстве синтетического волокна, многих пластмасс. Из бензола получают фенол, нитробензол, анилин и многие другие ароматические соединения. Бензол один из лучших растворителей органических веществ. Твсп. –11 оС; минимальная температура самовоспламенения 534 оС; стандартная темп. самовоспл. 562 оС; область воспл. 1,4-7,1 % объемн.; температурные пределы воспл.: нижн. - 1,4 оС , верх. – 13 оС; скорость выгорания 30 см/ч; макс. нормальная скорость горения 0,478 м/сек; температура горения 2100 оС. Толуол (метилбензол) C6H5—CH3. Бесцветная легковоспламеняющаяся жидкость, несколько отличающаяся по запаху от бензола. Ткип. 110,6 оС, Тпл. –95 оС; d204 =0,8669. Применяется главным образом для получения взрывчатого вещества тротила CH3C6H2(NO2)3, а также в производстве красителей, бензойного альдегида, сахарина. Твсп. 4 оС; станд. темп. самовоспл. 536 оС; область воспл. 1,3-6,7 % объемн., макс. норм. скорость горения 0,388 м/сек; скорость выгорания 20 см/ч, темп. пределн. воспл.: нижн. 0 оС, верхн. 30 оС. Тушить тонкораспыленной водой, пеной. СН3 Нитрование толуола проводят  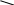 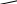  при комнатной температуре при комнатной температуре О2N NO2 (около 20 оС) – первая нитро- группа, вторая - при 60 оС,  третья - при 110 оС. третья - при 110 оС.NO2 тринитротолуол (тротил) Ксилолы (диметилбензолы) C6H4(CH3)2. Как известно, ксилолы существуют в виде орто-, мета- и пара- изомера. Это бесцветные жидкости, близкие по температурам кипения и более отличающиеся по температурам плавления о-ксилол м-ксилол п-ксилол Ткип., оС 144,4 139,1 138,4 Тпл., оС -25,2 -47,9 +13,3 d204 0,8802 0,8642 0,8611 Технический ксилол – смесь всех трех изомеров. Твсп. 29 оС; темп. самовоспл. 590 оС; темп. пределн. воспл.: нижний 24 оС, верх. 50 оС. Тушить распыленной водой, химической пеной. Кумол С2Н5-СН-(СН3)2 – легковоспламеняющаяся бесцветная жидкость; в воде нерастворим. Твсп. 34 оС; станд. темп. самовоспл. 424 оС; область воспламенения 0,88-6,5 % объем. при 100 оС; темп. пределы воспл.: нижн. 31 оС, верх. 71 оС; скорость выгорания 3,6-4,4 мм/мин. Фенол (карболовая кислота) – твердое кристаллическое вещество, с ОН характерным запахом, трудно растворяется в воде, Тпл. 42 оС,  Ткип. 181,1 оС. Применяется в огромных количествах для Ткип. 181,1 оС. Применяется в огромных количествах для производства синтетических фенолформальдегидных смол, производства синтетических фенолформальдегидных смол,красителей, синтетического волокна, (капрона и анида), а также для синтеза лекарственных веществ. Сильный анти- септик. Ядовит, при попадании на кожу вызывает ожоги. Большинство фенолов дает синюю или фиолетовую окраску с раствором FeCl3. У более сложных молекул производных фенола она бывает зеленой или красной. Крезолы СН3—С6Н4—ОН. Существуют в виде трех изомеров (о-, м-, п-). В технике обычно применяется их смесь, называемую трикрезолом. Это – темная маслообразная жидкость с характерным запахом, добываемая наряду с фенолом из каменноугольной смолы. Крезолы применяют для получения феноло-формальдегидных смол, красителей и др. Проявляют еще более сильное, чем фенол, антисептическое действие. Ароматические углеводороды с кратными связями в боковой цепи - первый и наиболее важный в этом ряду углеводород – стирол C6H5—CН=CH2 (фенилэтилен, или винилбензол). Это жидкость с приятным цветочным запахом; Ткип. 145,2 оС; Тпл. –30,6 оС; d204=0,9060. За счет двойной связи в боковой легко вступает в реакции присоединения (обесцвечивает растворы брома и KMnO4 и т.п.), т.е. проявляет свойства этиленовых соединений. С   тирол очень легко, особенно при нагревании и под действием света, полимеризуется, образуя высокомолекулярный прозрачный полимер – полистирол. тирол очень легко, особенно при нагревании и под действием света, полимеризуется, образуя высокомолекулярный прозрачный полимер – полистирол. Полистирол используется как органическое стекло. Применяется в качестве электроизоляционного материала в радиотехнике и телевидении. Хорошо окрашивается в различные цвета, поэтому идет на изготовление промышленных товаров (пуговиц, гребней и т.п.). Очень ценны пенопласты из полистирола – легкие полимерные материалы. Значительное количество полистирола потребляется в производстве бутадиен-стирольного синтетического каучука (СКС). Этилбензол и изопропилбензол (кумол) получают в промышленности алкилированием бензола этиленом и пропиленом. Изопропилбензол образуется также при разложении терпенов и камфоры. Этилбензол – легковоспламеняющаяся бесцветная жидкость; в воде труднорастворима. Твсп. 20 оС; темп. самовоспл. 420 оС; область воспл. 0,9-3,9 % объемн.; темп. пределн. воспл.: нижн. 18 оС, верхн. 45 оС. Тушить тонкораспыленной водой, пеной. Лекция: Одно и многоатомные спирты. Простые эфиры. Одноатомные спирты. Спиртами называются производные углеводородов, представляющие собой продукты замещения атома (атомов) водорода в углеводородной молекуле гидроксильной группой –ОН. В зависимости от того, какое количество атомов водорода замещено, спирты бывают одноатомными и многоатомными. Т.е. число групп –ОН в молекуле спирта характеризует атомность последнего. Наибольшее значение имеют предельные одноатомные спирты. Состав членов ряда предельных одноатомных спиртов может быть выражен общей формулой — СnH2n+1ОН или R-OH. Несколько первых членов гомологического ряда спиртов и их названия по радикально-функциональной, заместительной и рациональной номенклатурам соответственно приведены ниже: CH3OH метиловый метанол карбинол спирт C2H5OH этиловый этанол метилкарбинол спирт н-С3Н7ОН пропиловый пропанол этилкарбинол спирт н-С4Н9ОН бутиловый бутанол пропилкарбинол спирт н-С5Н11OН амиловый пентанол бутилкарбинол спирт По радикально-функциональной номенклатуре название спиртов образуется из названия радикалов и слова «спирт», выражающего функциональное название класса. Международная заместительная номенклатура: к заместительному названию углеводорода, производным которого является спирт, добавляют окончание –ол (алканолы). Локант указывает номер атома углерода, при котором расположен гидроксил. Главная углеродная цепь выбирается таким образом, чтобы она включала углерод, несущий гидроксильную группу. Начало нумерации цепи так же определяет гидроксил. Рациональная номенклатура: все спирты рассматриваются как производные метанола (СН3ОН), который в данном случае называется карбинолом: и в котором водородные атомы замещены на один или несколько радикалов. Название спирта составляют из названий этих радикалов и слова – карбинол. Таблица 1 Изомерия и номенклатура бутиловых спиртов (С4Н9ОН)
| |||||||||||||||||||||||
