6 ьема. Введение Понятие железодефицитной анемии
 Скачать 0.49 Mb. Скачать 0.49 Mb.
|
1.9 Клиническая картин железодефицитной анемииКлиническая картина ЖДА включает сочетание астеноневротического, эпителиального, сердечно-сосудистого, мышечного синдрома и синдрома вторичного иммунодефицита. Астеноневротический синдром: повышенные утомляемость, возбудимость, раздражительность, эмоциональная неустойчивость, потливость; отставание в психомоторном развитии; вялость, астения, сонливость, апатия; снижение аппетита и способности к концетрации внимания; негативизм; у более старших детей головные боли, головокружение, шум в ушах, мелькание «мушек» перед глазами, боли в сердце, а также извращенный аппетит с поеданием крахмала, сырого картофеля и мяса, геофагия, извращение обоняния; дизурические расстройства. Эпителиальный синдром – бледность кожи, слизистых оболочек и ушных раковин; сухость и шелушение кожи; дистрофические изменения кожи, ногтей, волос, слизистых оболочек рта, языка; кариес зубов, их крошение, дефекты эмали; Нарушение глотания твердой пищи, атрофический гастрит, дуоденит, мальдигестия с признаками нарушения утилизации пищевых веществ в копрограмме, неустойчивый стул; тошнота; голубые склеры. Сердечно-сосудистый синдром: тахикардия, тенденция к артериальной гипотонии, ослабление тонов сердца и расширение границ относительной сердечной тупости, функциональный сердечный шум на верхушке, иногда шумы над крупными сосудами. Мышечный синдром – мышечная гипотония, быстрая утомляемость, дизурия, ночное и дневное недержание мочи из-за слабости мышечного аппарата, нарушение работы сфинктеров при кашле и смехе, запоры. Синдром вторичного иммунодефицита: частые ОРВИ, пневмонии, кишечные инфекции и др. К редким симптомам дефицита железа относят: увеличение печени и селезенки, отечность. У девушек возможна дисменорея. Диагностика: диагноз ЖДА основывается на характерной клинико-гематологической картине заболевания и наличии лабораторных доказательств абсолютного дефицита железа. Для диагностики ЛДЖ ВОЗ были разработаны и предложены специальные критерии: Снижение уровня сывороточного железа ниже 12,5 мкмоль/л; Повышение ОЖСС более 69 мкмоль/л; Процент насыщения трансферрина железом менее 17%; Снижение сывороточного ферритина менее 30 нг/мл; Повышение уровня растворимых трансферриновых рецепторов более 2,9 мкг/мл. Расчётный коэффициент, вычисляется по формуле: Железо сыворотки (в мкмоль/л) НТЖ= -× 100% ОЖСС (в мкмоль/л) В норме содержание гемоглобина не ниже 110 г/л у детей до 6-ти лет и 120 г/л – старше 6-ти лет. Если имеется снижение уровня гемоглобина, то эти же критерии являются критериями диагностики ЖДА. 1.11 Лечение железодефицитной анемииЦелями лечения ЖДА являются устранение причины, лежащей в основе развития заболевания (коррекция питания, выявление и устранение источника кровопотери, выявление и устранение паразитарных инвазий), и возмещение дефицита железа в организме путем его введения в количестве, необходимом для нормализации уровня гемоглобина и восполнения тканевых запасов железа (ферритин сыворотки> 40-60 мкг/л). Задачи 1-го этапа лечения: устранение причин, лежащих в основе ЖДА; коррекция изменений, резвившихся при дефиците железа; нормализация гемоглобина и начало формирования депо железа; Задачи 2-го этапа – окончательное формирование депо железа. Для успешного лечения ЖДА важно соблюдение принципов терапии ЖДА: Назначение лекарственных железосодержащих препаратов, поскольку возместить дефицит железа в организме иными способами невозможно. Оральная терапия препаратами железа. Внутривенное введение препаратов железа показано только при тяжёлой форме ЖДА, составляющей около 3% от всех ЖДА. Трансфузии эритроцитарной массы в большинстве случаев не показаны, должны избегаться вследствие неоправданно высокого риска трансмиссии вирусов гепатита, цитомегаловирусов и ВИЧ-инфекции. Адекватность дозировки препаратов железа. Доза рассчитывается для конкретного больного с учётом: - степени анемического состояния; - массы тела больного. Ранее прекращение терапии препаратами железа создаёт предпосылки развития рецидива ЖДА. Длительность курса терапии препаратами железа: при легкой степени минимальный курс составляет 3 месяца при анемии средней степени тяжести – 4,5 месяца - при тяжелой – 6 месяцев. Преодоление тканевой сидеропении и пополнение запасов железа в депо, что определяется по нормализации концентрации сывороточного ферритина. Распространённой ошибкой является прекращение лечения препаратами железа после достижения нормального уровня гемоглобина. Основной задачей ферротерапии является восполнение депо железа и преодоление тканевой сидеропении. Ранее прекращение терапии препаратами железа создаёт предпосылки развития рецидива ЖДА. Контроль эффективности лечения ЖДА препаратами железа: ретикулоцитарная реакция на 10-12 день от начала лечения препаратами железа; начало подъёма уровня гемоглобина на 3-4 неделе; исчезновение клинических проявлений заболевания – 1-2 месяца; преодоление тканевой сидеропении – 3-6 месяцев (контролируется по ферритину сыворотки). После окончания курса лечения препаратами железа необходимо контролировать показатели гемоглобина ежемесячно в течение года для определения необходимости поддерживающей терапии препаратами железа. Если указанные выше критерии эффективности лечения препаратами железа не выполняются, то следует пересмотреть следующие позиции: правильность постановки диагноза ЖДА; адекватность дозировки препарата железа; длительность лечения ЖДА; выполняемость курса лечения ЖДА родителями пациента; • переносимость пациентом назначенного препарата железа; наличие заболеваний, приводящих к потере железа. Если все вышеуказанные моменты учтены, то при отсутствии эффекта от терапии препаратами железа следует думать о железорефрактерной ЖДА — это заболевание, наследуемое по аутосомно-рецессивному типу, его причиной является наличие различных мутаций в гене ТМРRSS6, обуславливающем повышение концентрации гепцидина, ингибирующего всасывание железа из кишечника и высвобождение железа из макрофагов. Для железорефрактерной ЖДА характерны отсутствие ответа на терапию пероральными препаратами железа, частичный ответ на лечение парентеральными препаратами железа, хроническое течение заболевания и наличие семейных случаев. Для правильного расчёта суточной дозы обязательно знание содержания элементарного железа в назначаемом препарате, которое может быть различны. Препараты железа для перорального приема могут быть условно разделены на ионные солевые (преимущественно двухвалентные) и несолевые препараты железа, например, на основе гидроксид полимальтозного комплекса (ГПК). Рандомизированные исследования последних лет доказали, что эффективность солевых препаратов железа и препаратов железа (III) на основе ГПК в лечении ЖДА одинакова. Количественный и качественный состав лекарственных препаратов железа сильно варьирует: высоко- и низкодозированные, односоставные и комбинированные. В настоящее время ряд исследований показало, что применение низкодозированных препаратов железа короткими курсами (2 недели в месяц) или альтернирующими режимами (через день в течение месяца) имеет более высокую эффективность и меньшую частоту побочных эффектов, чем применявшиеся ранее высокодозированные препараты, в том числе в виде повторных (2-3 раза в день) приемов. Терапия солевыми препаратами железа сопровождается многочисленными проблемами: имеют металлический привкус; стойко окрашивают эмаль зубов и слизистую оболочку дёсен; взаимодействуют с пищей и другими лекарствами; их всасывание является пассивным, неконтролируемым процессом вследствие чего возможна передозировка и отравления; возможны диспепсические явления; частый отказ пациентов от лечения (до 30—35% приступивших к лечению), т.е. низкая комплаентность. Несолевые препараты железа имеют следующие свойства и преимущества: высокую безопасность, отсутствие риска передозировки, интоксикации и отравлений; отсутствие потемнения десен и зубов; приятный вкус; отличную переносимость; высокую комплаентность лечения; отсутствие взаимодействия с другими лекарственными средствами и продуктами питания; наличие антиоксидантных свойств. Несолевые препараты железа: Железа протеинсукцинилат содержит связанное с белком железо, не оказывает повреждающего действия на слизистую ЖКТ. Гидроксид-полимальтозный комплекс представлен в виде полимальтозного комплекса гидроксида Fe3+ (является декстрином железа, в отличие от Fe3+ гидроксид полиизомальтозата — декстрана Fe, не содержит декстранов, обусловливающих большую вероятность развития анафилактических реакций). Сукросомальное железо проникает в клетку путем эндоцитоза в неизмененном виде, попадая в печень высвобождает железо имеет гепцидиннезависимый механизм всасывания. С точки зрения врача-педиатра, лечение ЖДА у детей имеет некоторые особенности, которые следует учитывать в лечебном протоколе. Прежде всего, применение у детей в возрасте до 3 лет солевых препаратов двухвалентного железа в дозе 5—8 мг/кг массы тела в сутки, как это рекомендовано Протоколе ведения больных «Железодефицитная анемия» от 22 октября 2004 года, вызывает проявления токсичности у многих больных и не оправдано с терапевтической точки зрения. В то время как применение высоких доз несолевых препаратов хорошо переносится и является эффективным. При анемии на фоне острой инфекции введение железа в остром периоде нецелесообразно; при сохранении низких показателей гемоглобина препараты следует вводить, начиная с 3-4 недели болезни. Параллельно с препаратами железа показано назначение поливитаминов с микроэлементами (кобальт, марганец, медь, никель и т.д.) курсом 2-3 недели. Парентеральное введение препаратов железа: Внутривенные инфузии препаратов железа сопряжены с опасностью анафилактического шока (1% пациентов), развитием перегрузки железом и токсических реакций, связанных с активацией ионами железа свободнорадикальных реакций биологического окисления (перекисное окисление липидов). Внутримышечное введение препаратов железа не используется из-за низкой эффективности, развития местного гемосидероза и опасности развития инфильтратов, абсцессов в месте введения. Показания для парентерально введения препаратов железа: пероральный путь введения не сопровождается эффектом плохая переносимость препаратов для перорального введения у больного имеется поражение кишечника массивная кровопотеря тяжелая течение анемии необходимость быстрого насыщения организма железом, например, когда больным железодефицитной анемией планируют оперативные вмешательства. Расчет дозы для парентерального введения препаратов железа: Общий дефицит железа (мг) = Масса тела больного (кг) х (НЬ норма (г/л) - НЬ больного(г/л)) х 0,24 + Депо железа (мг) Депо железа у пациентов с массой тела: ‒ менее 35 кг‒ 15 мг/кг, целевая концентрация Hb ‒ 130 г/л; ‒ более 35 кг‒ 500 мг, целевая концентрация Hb ‒ 150 г/л. Суммарную дозу для парентеральной терапии можно рассчитать по упрощенной формуле: Суммарная доза= (120-Нb больного в г/л)* масса тела в кг*0,4 Суточная доза 1-2 мг/кг Разовая доза 3-5 мг/кг (вводится через день). Зная общий дефицит железа в организме (мг) и количество железа в 1 ампуле препарата можно рассчитать необходимое количество ампул на курс лечения по формуле: количество ампул для введения = общий дефицит железа / кол-во железа в 1 ампуле (мг). 2. Лабораторной диагностики Для лабораторной диагностики ЖДА, используются: общий анализ крови, выполненный «ручным» методом; общий анализ крови, выполненный на автоматическом гематологическом анализаторе; биохимические исследования. В общем анализе крови, выполненном «ручным» методом, отмечаются: снижение гемоглобина (<110 г/л), снижение количества эритроцитов (<3,8 10 /л), снижение цветового показатели (<0,86); снижение диаметра эритроцитов (<7,2 мкм); нормальное количество ретикулоцитов (0,2-1,2%); увеличение СОЭ (>10- 12 мм/час). Ошибка при выполнении анализа крови «ручным» методом составляет более 5%. В общем анализе крови, выполненном на автоматическом гематологическом анализаторе, отмечается: снижение гемоглобина, количества эритроцитов, гематокрита (<32,0-39,9%, в зависимости от возраста), нормальное количество ретикулоцитов, снижение MCV (среднего объёма эритроцитов) <90 fL (фемптолитор) и МСНС (среднего содержание гемоглобина в эритроците) <33-34 г/дл; повышение RDW (степени анизоцитоза) >13%. Ошибка автоматических гематологических анализаторов менее 3%. В последние годы предложено несколько новых биохимических показателей для диагностики дефицита железа. Одним из них является цинкпротопорфирин — первый биохимический признак, отражающий изменения эритроцитов при снижении запаса железа в организме. Цинкпротопорфирин образуется в результате замещения цинком иона железа в протопорфирине на последнем этапе биосинтеза гема. Измерение проводят в капле цельной капиллярной крови с помощью портативного прибора — гематофлюорометра. Результат готов через 1 минуту. Нормальные значения находятся в переделах 30—80 мкмоль/моль гема. Повышение показателя выше этого уровня свидетельствует о дефиците железа. При выявлении ЖДА требуется проведение комплекса инструментальных исследований для выяснения причины развития анемии. Индивидуальный план обследования составляет врач на основании выявленных патологических изменений при первичном обследовании и может включать следующие исследования: рентгенография органов грудной клетки; Ультразвуковое исследование органов брюшной полости, забрюшинного пространства и малого таза; Фиброгастродуоденоскопия; Ультразвуковое исследование щитовидной железы; ЭКГ; исследования для выявления гельминтозов (кал на яйца глистов, соскоб на яйца глистов, определение антител методом ИФА к гельминтам (Opisthorchis, Toxocara, Trichinella, Echinococcus, Giardia lamblia, Ascaris lumbricoides), исследование кала методом обогащения); биохимический анализ крови (общий белок, альбумин, общий билирубин, прямой билирубин, АСТ, АЛТ, креатинин, мочевина, щелочная фосфатаза, гамма-глютаминтранспептидаза) с определением основных показателей функционального состояния печени, почек, поджелудочной железы; проведение скрининга на наличие вирусных гепатитов В и С, ВИЧинфекции; ОАМ; иммунограмма с целью исключения первичных иммунодефицитов; с целью исключения целиакии определение антител к тканевой трансглютаминазе. Лабораторными признаками являются: выраженное снижение гемоглобина; снижение количества эритроцитов и их макроцитоз; снижение гематокрита; панцитопения в периферической крови; гиперсегментация ядер нейтрофилов (пятидольчатые и шестидольчатые ядра); мегалобласты в костном мозге; гиперклеточность костного мозга. Правомочна дифференциальная диагностика ЖДА с анемией при хронических болезнях (АХБ), являющейся самостоятельной нозологической формой (код по МКБ-10 – D63.8). Встречается при инфекциях, системных заболеваниях соединительной ткани, хронических заболеваниях печени, злокачественных новообразованиях. Патогенез АХБ связан с четырьмя основными механизмами: нарушением метаболизма железа – при достаточном количестве железа в организме затруднено его использование и реутилизация из макрофагов; гемолиз эритроцитов; супрессия эритропоэза ингибиторами (средние молекулы, продукты перекисного окисления липидов, цитокины, фактор некроза опухоли, интерлейкин-1, замещение опухолевыми клетками); неадекватная продукция эритропоэтина, т.е. повышение выработки при отставании темпов его роста от развития анемии. Лабораторными признаками АХБ являются: нерезкое снижение гемоглобина и эритроцитов, микроцитарный, норморегенераторный характер анемии, снижение сывороточного железа и ОЖСС, увеличение ферритина и СОЭ. 3. Материалы и методы исследования Определение уровня железа сыворотки крови, общей железосвязывающей способности и степени насыщения трансферрина, уровня ферритина сыворотки крови и растворимого sTfR рецептора к трасферрину. Из многочисленных методов количественной оценки содержания железа в сыворотке крови наибольшее распространение получили методы определения железа по цветной реакции с батофенантролином. В основе этих методов лежит свойство двухвалентного восстановленного железа (Fe2+) образовывать яркоокрашенный комплекс с батофенантролином. Интенсивность окраски комплекса, соответствующую концентрации Fe2+ в сыворотке, определяют фотометрически. Предварительно белки сыворотки крови осаждают трихлоруксусной кислотой и восстанавливают сывороточное железо в двухвалентную его форму (Fe3+ в Fe 2+) с помощью гидразина или тиогликолевой кислоты. В норме у мужчин в сыворотке крови содержится 13-30 мкмоль/л негеминового железа, у женщин - примерно на 10-15% меньше. Общая железосвязывающая способность сыворотки (ОЖСС) отражает резервную «незаполненную» железом емкость транспортного белка - трансферрина. При ЖДА всегда наблюдается повышение ОЖСС в отличие других типов гипохромных анемий. Рецептор sTfR трансферрина - альтернативный параметр, указывающий на функциональный недостаток железа. Транспорт железа в клетку происходит при взаимодействии комплекса железо-Tf со специфичным для Tf рецептором плазматической мембраны. Структура рецептора: две одинаковые пептидные цепи, проходящие сквозь мембрану клетки, связаны несколькими дисульфидными мостиками. Молекула Tf, несущая два атома железа, «причаливает» на внешний конец рецептора, после чего поглощается клеткой путем эндоцитоза. Белковая часть Tf, освободившись от железа, вместе с рецептором выходит на поверхность клетки, где апо-трансферрин отделяется и весь цикл повторяется. При повышенной потребности в железе, цикл рецептора Tf ускоряется и все больше рецепторов располагается на поверхности клетки. При этом все чаще внеклеточная часть рецептора подвергается воздействию протеаз, в результате чего от рецептора отделяется и попадает в кровь довольно стабильный фрагмент - пептид с молекулярным весом 95 кД, называемый «растворимым» рецептором трансферрина (sTfR), концентрацию которого в сыворотке крови можно определить при помощи иммунологических методов. Таким образом, уровень sTfR в крови отражает «железное голодание» клетки. Рассматривая диагностическое значение sTfR, следует помнить, что 80% рецептора ТФ находится на мембране эритропоэтических клеток, присутствует он в клетках плаценты, лимфоцитах, некоторых раковых клетках. Чем ниже содержание Fe в клетке, тем выше экспрессия рецепторов трансферрина. При высокой скорости синтеза рецепторов трансферрина происходит угнетение синтеза молекул ферритина. При проведении исследования особые требования предъявляются к технике взятия крови, поскольку неизбежное при этом разрушение эритроцитов и увеличение содержания в сыворотке свободного гемоглобина может оказать существенное влияние на результаты. Мазок крови: для правильной интерпретации СОЭ необходимо исследование мазка периферической крови (рис. 4; 5) поскольку:(1) одновременное наличие клеток малого и большого объема создает представление о нормальном размере эритроцитов; (2) включение в подсчет ретикулоцитов, имеющих большие размеры, чем зрелые эритроциты, ведет к завышению СОЭ; (3) эритроидные клетки аномальных размеров могут присутствовать в столь малом количестве, что не влияют на вычисляемый СОЭ. Эритроцитометрическая кривая используется для оценки анизоцитоза (вариабельности размеров эритроцитов) и полезна в дифференциальной диагностике анемий с близкими значениями СОЭ. Для железодефицитной анемии характерен низкий СОЭ. Исследование мазка периферической крови имеет решающее значение в диагностике анемий. При приготовлении мазков не должно возникать артефактов. Морфологию эритроцитов лучше изучать в той части мазка, где они расположены в один слой и лишь соприкасаются друг с другом. Важно выявить специфические нарушения морфологии эритроцитов (обсуждаемые при рассмотрении отдельных типов анемии), а также изменения структуры и количества лейкоцитов и тромбоцитов. Исследование мазка периферической крови нередко позволяет установить окончательный диагноз или значительно сузить выбор из возможных нозологических форм, для разграничения которых используют дополнительные исследования. Дополнительные исследования, по возможности, проводят до гемотрансфузии.  Эритроцит - безъядерная клетка, имеющая форму двояковогнутого диска с кольцеобразным утолщением по краям (Рис.4) 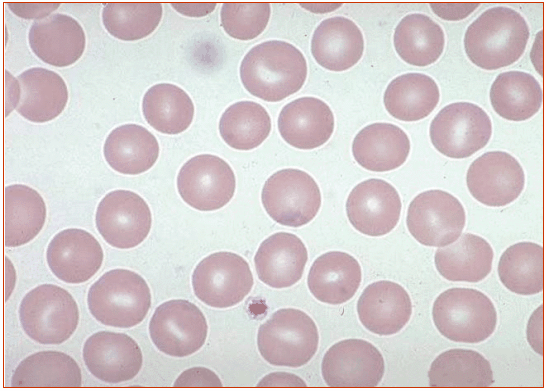 Морфология эритроцитов в мазке крови (Рис.5) Гематологический анализатор: это прибор (комплекс оборудования), предназначенный для проведения количественных и качественных исследований крови в клинико-диагностических лабораториях. Бывают автоматические, полуавтоматические. Число определяемых показателей. Этот параметр в зависимости от модели анализатора варьируется от 8 до 40. Кроме этого анализатор позволяет получать распределения клеток по объему - до 3 гистограмм и до 6 двумерных скэтограмм. Число определяемых показателей является очень важным параметром. Чем больше число определяемых показателей, тем больше диагностической информации получает врач и, следовательно, выше эффективность лечебно-диагностического процесса. При работе в исследовании был использован автоматический гематологический анализатор CELLTAK F. Специально разработанный для клинических лабораторий и представляет собой полностью автоматизированный прибор. Гематологический анализатор способен обрабатывать десятки образцов в час, с соответствующей спецификации точностью и воспроизводимостью, а также хранить результаты тестов во встроенной памяти и, при необходимости, распечатывать их на встроенном термопринтере. Прибор имеет 22 определяемых показателя (некоторые из них представлены в Табл. 4) Таблица 4 Гемограмма с гематологического анализатора
Биохимический анализатор: биохимический анализатор -прибор, использующийся для клинических и химических исследований различные механические и компьютерные технологии. С их помощью возможно определение наличия и концентрации электролитов, субстратов, ферментов, липидов, специфических белков, гормонов, лекарственных препаратов и наркотических веществ в практически любых видах биологического материала: сыворотка, плазма, спинномозговая жидкость, моча. Биохимические анализаторы обеспечивают выполнение срочных и плановых, специальных и традиционных клинико-биохимических тестов и анализов. Различают полностью автоматические и полуавтоматические биохимические анализаторы. Первые выполняют большинство операций: отбор материала и необходимых реагентов, их смешивание и нагрев, анализ и обработка полученных данных, их распечатка и промывание оборудования после завершение всех процедур с исследуемыми образцами автоматически. Полуавтоматические биохимические анализаторы требуют подготовки анализируемых реакционных смесей вручную и их использование больше подходит для небольших лабораторий с малым количеством исследуемых материалов. Использование биохимических анализаторов в биохимических и клинико-диагностических лабораториях обеспечивает точность измерений, экономию реактивов, простоту управления, легкое документирование результатов и длительную безотказную работу. Лазерный нефелометр: определяемые параметры: IgG (сыворотка, моча, ликвор), IgA (сыворотка), IgM (сыворотка), C3c (сыворотка), C4 (сыворотка), трансферрин (сыворотка, моча), альбумин (сыворотка, моча, ликвор), Ig/L Kappa (сыворотка, моча), Ig/L Lambda (сыворотка, моча), церулоплазмин (сыворотка), альфа-1-антитрипсин (сыворотка), СРБ (сыворотка), ревматоидный фактор (сыворотка), альфа-1-кислый липопротеин (сыворотка), APO A-1(сыворотка), APO-B (сыворотка), альфа-2-макроглобулин (сыворотка), гаптоглобин (сыворотка), фибриноген (плазма), человеческий IgG субкласс(I) (сыворотка), преальбумин (сыворотка), антитромбин (плазма), LP (a) (сыворотка), IgE (сыворотка). Метод измерения: Нефелометрия - это измерение специфических белков крови, основанное на реакции преципитации комплекса «белок - высоко специфичная сыворотка». Для этого производятся измерения бокового рассеяния лазерного излучения на длине волны 840 нм. Многочисленные исследования по всему миру доказали точность результатов получаемых нефелометрическим методом. Эта точность основана на высокой чувствительности этого метода и на качестве реагентов, которое обуславливает высокую специфичность при определении концентраций белков. Измерения проводятся в одноразовых кюветах, которые в процессе работы легко заменяются на новые сегменты. Анализатор автоматически готовит разведения образцов (в пределах 1:1 - 1:32000) в специальных многоразовых пробирках для разведения (2 штатива по 75 пробирок в каждой). 3.1. Результаты и обсуждение Было проведено исследование - отобрано 43 человека с интересующими нас параметрами, по которым можно определить скрытый дефицит железа, а именно: RBC (эритроциты), MCH (среднее содержание гемоглобина в одном эритроците), гемоглобин, гематокрит, сывороточное железо, трансферрин, ферритин и чувствительный к трансферрину sTfR-рецептор. Для удобства оценки результатов были построены диаграммы по каждому из параметров, а так же общее процентное соотношение больных и здоровых людей, соотношение по полу и возрасту. Результаты, полученные по диаграмме процентного соотношения больных и здоровых ЖДА, оказались такими, что приблизительно 75% исследуемых пациентов оказались здоровыми, а у 25% наблюдаются симптомы ЖДА, что совпадает с литературными данными. 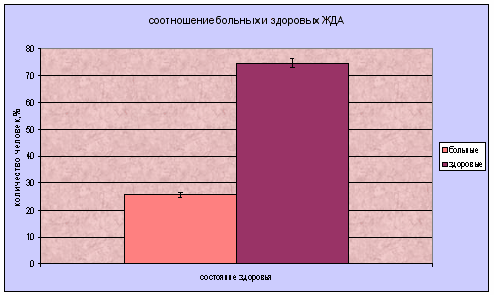 По такому параметру как содержание эритроцитов в крови сравнивались мужчины и женщины, как по норме, так и по отклонению. Хоть они у мужчин (4,3-5,7мкл) и женщин (3,8-5,1мкл) по этому параметру немного и различаются, но сама разница по отклонению от нормы разных полов невелика. Мы выявили, что мужчин с отклонением здесь больше чем женщин. Но это еще не говорит о наличии ЖДА, т.к. это всего лишь один из нескольких показателей, по которым можно диагностировать анемию. Возможно, такое распределение объясняется малым объемом выборки, или случайным стечением обстоятельств, что чаще обращались мужчины престарелого возраста, а этот контингент пациентов, как известно более подвержен заболеванию. Так же может быть причиной и недостаточное поступление железа с пищей, неправильный обмен веществ, снижение всасывания железа в кишечнике, избыточное поступление в организм фосфатов, оксалатов, кальция, цинка, витамина Е. 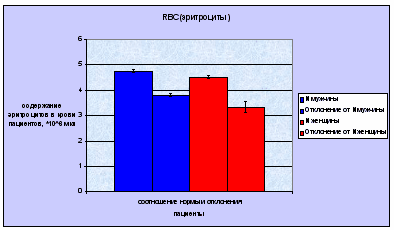 Величина MCH отражает среднее содержание гемоглобина в эритроците, и по ней можно судить о характере анемии, но все же учитывая и другие показатели. Нормы этого показателя являются одинаковыми, как для мужчин, так и для женщин и составляют 27-34 пг. По диаграмме видно, что норма преобладает над отклонением, но эти 17% по отклонению и есть пациенты с патологией, т.е. больные ЖДА. 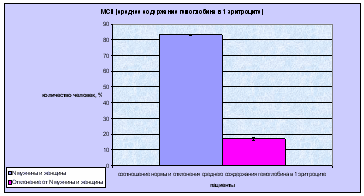 Гемоглобин при ЖДА имеет тенденцию к снижению. В норме он содержится у мужчин (132-173 г/л), у женщин (117-155 г/л). По показателям диаграммы заметно, что большее снижение гемоглобина наблюдается у женщин. Это можно объяснить тем, что в группу риска попадают женщины в фертильном возрасте, а это основная масса женского населения. Нарушение синтеза гемоглобина возможно в результате нарушения - включения в его молекулу железа при нормальном или даже повышенном уровне железа в сыворотке крови. Еще одной причиной дефицита железа, приводящего к развитию ЖДА, может быть нарушение транспорта железа, обусловленное снижением в крови уровня трансферрина. 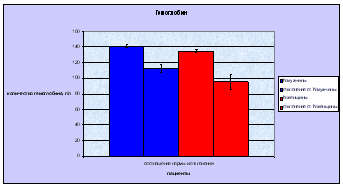 Так же диагностика ЖДА проводится и по таким показателям как железо, ферритин и трансферрин. На диаграмме выявлено снижение уровня железа в сыворотке крови, что однозначно указывает на необходимость определения других показателей обмена железа (ОЖСС и уровень ферритина). Причинами недостатка железа могут быть уже выше перечисленные факторы. Общая железосвязывающая способность сыворотки (ОЖСС) отражает резервную «незаполненную» железом емкость транспортного белка - трансферрина. При ЖДА всегда наблюдается повышение ОЖСС. Увеличение уровня трасферрина при ЖДА связано с повышенным его синтезом в качестве компенсаторной реакции организма человека в ответ на тканевой дефицит железа. Но на нашей диаграмме четко видно, что синтез трансферрина резко уменьшается. Как правило, это обусловлено нарушением белковосинтетической функцией печени, нефротическом синдроме с выраженной протеинурией, а так же может носить диетический характер. Информативным показателем оценки метаболизма железа является коэффициент насыщения трансферрина железом, который рассчитывается по формуле: Железо (мкг/дл) . Насыщение трансферрина железом (%) = -х 100 %, Трансферрин (мг/дл) х 1,41 При ЖДА этот показатель снижается (менее 15%), а при перегрузке железом значительно повышается (более 50%). Еще одним высоко специфичным диагностическим признаком ЖДА является концентрация ферритина в сыворотке крови. Уровень ферритина отражает величину запасов железа в организме. Снижение содержания ферртина свидетельствует о ЖДА, а так же и о латентном дефиците железа, т.к. истощение запасов железа является обязательным этапом формирования ЖДА. 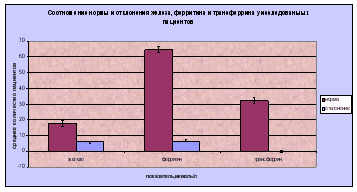 Гематокрит - отношение объема эритроцитов крови к объему плазмы, выражается в процентах. В норме величина гематокрита для мужчин составляет 39-49% , для женщин 35-45%. На диаграмме отражено опять же, что в основном женщины подвержены отклонением от нормы данного показателя, чем мужчины. Причина этого может крыться в недостатке потребления железа с пищей, острые или хронические кровопотери, беременность, снижение всасывания железа в кишечнике. 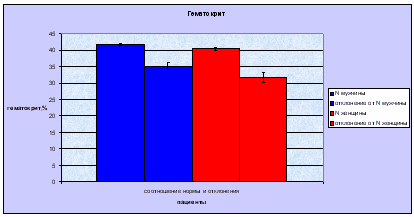 Результаты, полученные по оценке возрастного соотношения здоровых и больных ЖДА пациентов, говорят о том, что пациенты, входящие в группу риска - это люди находящиеся в возрастном интервале от 40 до 50 лет. До и после этих границ заболеваемость не так высока. Это только средние показатели, взятые по мужчинам и женщинам. В принципе они схожи при сопоставлении с литературой. Чаще всего ЖДА встречается у женщин в фертильном возрасте, у мужчин в той же возрастной категории, но довольно-таки небольшой процент, а так же у мужчин в возрасте 70-80 лет. 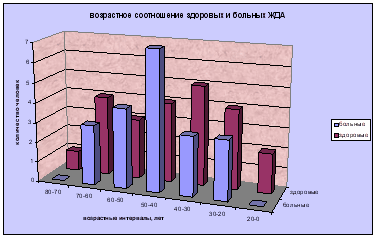 Ну и, наконец, сопоставление здоровых и больных ЖДА по полу, т.е. мужчин и женщин - дало следующие результаты. Из больных ЖДА больше всего было женщин, в силу того, что причинами пониженного содержания железа в организме могут быть его недостаточное поступление с пищей, расстройства метаболизма, нарушения всасывания в желудочно-кишечном тракте. Ситуации, связанные с относительным или абсолютным дефицитом железа, могут возникать при увеличенной потребности организма в этом биоэлементе. К таким ситуациям следует отнести беременность, лактацию, периоды роста и развития. Наконец, причиной дефицита железа могут быть острые или хронические кровопотери. В свою очередь, недостаток железа является одной из самых распространенных причин возникновения анемий, обильных кровотечений, ослабления организма, нарушения нервно-психических функций. 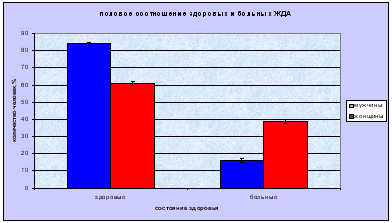 Таким образом, как вы видите, существует множество факторов риска, которые необходимо иметь в виду при выяснении возможных причин развития дефицита железа в организме человека. Кроме того, достаточно распространенной является ситуация, когда женщина средних лет, у которой бывает очень сильная кровопотеря во время менструаций, на протяжении нескольких лет потребляет очень мало мяса, являющегося хорошим источником железа для человеческого организма, а питается лишь отрубями с чаем. Такие изменения в питании приводят к уменьшению содержания железа в ее организме вследствие недостаточной усвояемости железа из потребляемой пищи. Конечно, у женщин имеется не один, а несколько факторов риска развития дефицита железа, вероятность существования которых еще более возрастает, если у них периодически во рту появляются ранки, они чувствуют припухлость и болезненность языка или у них имеются трещины в углах рта наряду с чувством повышенной утомляемости. Выводы Анемия стала насущной проблемой для большого числа людей по всему миру. Она поражает особенно уязвимые слои населения - детей младшего возраста, беременных женщин, пожилых людей и лиц, страдающих серьезными хроническими заболеваниями. Однако с этим аномальным состоянием можно и нужно бороться. Правильная диагностика, включающая выполнение различных лабораторных исследований, позволяет своевременно выявить эту болезнь и выбрать подходящий метод лечения. В результате проделанной работы, можно сделать следующие выводы: 1. Была изучена литература по теме: ЖДА и современная лабораторная диагностика скрытого дефицита железа. Выявлена классификация анемий, способы диагностики ЖДА и скрытого дефицита железа, выделены причины снижения содержания железа и предложены варианты профилактики заболевания. 2. Изучены методы современной диагностики и работы, включающие в себя исследования на геманализаторе, биохимическом анализаторе и лазерном нефелометре. Это новое оборудование позволяет вести более точное и расширенное обследование, что даёт ряд преимуществ. К дополнительным методам исследования можно отнести и мазок крови, что также является не мало важным в диагностике заболевания. 3. Следующим шагом к цели было освоение гематологического анализатора, на котором можно вести исследования по 22 параметрам. Анализатор полностью автоматический, что сводит к минимуму человеческий фактор. А также позволяет экономить время, т.к. можно обрабатывать десятки образцов в час, а также хранить результаты в памяти. 4. Ещё одной задачей являлось освоение лабораторных методов выявления скрытого дефицита железа. Это выяснялось с помощью таких показателей, как определение уровня железа в крови, общей железосвёртывающей способности (ОЖСС), степени насыщения трансферрина, уровню ферритина сыворотки крови, уровню количества эритроцитов (RBC), среднему содержанию гемоглобина в одном эритроците (MCH), по гемоглобину и гематокриту. Реализуя все вышеперечисленные задачи, мы добились достижения поставленной цели - изучили возможности лабораторной диагностики железодефицитной анемии. И проверив это опытным путём на небольшой группе пациентов (43 человека), мы выявили закономерность, которая отражает, что ЖДА чаще всего болеют женщины в фертильном возрасте, и лишь небольшой процент мужчин, особенно в престарелом возрасте. Заключение ЖДА до настоящего времени остаётся одной из актуальных проблем медицинской науки и практического здравоохранения вследствие широкого распространения и неблагоприятного воздействия на организм человека. Увеличивающийся рост врождённых анемий вероятно обусловлен неблагоприятными социально-биологическими, экономическими, экологическими факторами, которые влияют на здоровье будущих мам, патологию беременности и родов, что прогнозирует дальнейшее ухудшение показателей здоровья младенцев и, что особенно важно для их дальнейшего психофизического развития. Поэтому необходимо создать единую комплексную систему раннего выявления, лечения и профилактики ЖДА у детей и беременных женщин, а также как можно более ранняя психопедагогическая коррекция, которая должна стать частью системы социального образования. Список литературы 1. Антонов В.С., Богомолова Н.В., Волков А.С. Автоматизация гематологического анализа. Интерпретация показателей гемограммы. Издательство Саратовского Медицинского Института, 2008. 2. Дворецкий Л.И. Анемии: стратегия и тактика диагностического поиска. Справочник поликлинического врача, т.2, №6, 2002. 3. Долгов В.В., Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная диагностика анемий (пособие для врачей). Изд-во «Губернская медицина», 2001. 4. Клиническое руководство по лабораторным тестам под ред. проф. Н Тица. М.: Юнимед-пресс, 2003. 5. Луговская С.А., Морозова В.Т., Почтарь М.Е., Долгов В.В. Лабораторная гематология. М.: Юнимед-пресс, 2002. 6. Методики клинических лабораторных исследований под ред. В.В. Меньшикова, том 1, Лабора, 2008. 7. Назаренко Г.И., Кишкун А.А. «Клиническая оценка результатов лабораторных исследований. М.: Медицина, 2002. 8. Шиффман Ф.Д. Патофизиология крови. М.-С-пб.: «Издательство БИНОМ» -«Невский Диалект», 2000. 9. Е.Д. Гольдберг «Справочник по гематологии» 10. «Справочник по гемматологии» под рад. А.Ф. Романова. 11. Воробьёва А.И. Руководство по гематологии. Москва Медицина. 1985 г. 12. Митеров Ю.Г. Воронина Л.Н. ЖДА и состояния (диагностика, лечение, профилактика). Клиническая медицина 1992 г. №7-8. 13. Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, том 1, "Мир", Москва 1993г. 14. Зюбина Л.Ю. Патогенез, клиника, диагностика и лечение висцеральных поражений при железодефицитных состояниях: автореф. Дис. … д-ра мед. наук. Новосибирск; 2000. 15. Дворецкий Л.И. Алгоритмы диагностики и лечения анемий. Рус. Мед. журнал 2003; 11 (8): 427-33. 16. Подзолкова Н.М., Нестерова А.А., Назарова С.В., Шевелева Т.В. Железодефицитная анемия беременных. Рус. Мед. Журнал 2003; 11(5): 326-31. 17. В.И. Никуличевой. Уфа, 1993г. / Железодефицитная анемия 18. Коровина Н.А. Железодефицитные анемии у детей / Н.А. Коровина, А.Л. Заплатников, И.Н. Захарова. - М., 1998. 19. Аркадьева Г.В. Диагностика и лечение железодефицитных анемий. М., 1999. 59 с. 20. Дворецкий Л.И., Воробьев П.А. Дифференциальный диагноз и лечение при анемическом синдроме. М.: Ньюдиамед, 1994. 24 с. 21. Идельсон Л.И. Гипохромные анемии. М.: Медицина, 1981. 190 с. 22. Малаховский Ю.Е., Манеров Ф.К., Сарычева Е.Г. Легкая форма железодефицитной анемии и латентный дефицит железа - пограничные состояния у детей первых двух лет жизни//Педиатрия. 1988. № 3. С. 27-34. |
