Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
Cl (хлор) | | | |||
| | Степень окисления хрома в дихромате калия +6 | | | ||
| | Уравнение Нернста для электродов I рода 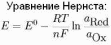 | | | ||
| | При растворении в щелочах свинец проявляет степень окисления, равную +2 | | | ||
| | Царская водка – это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl) | | | ||
| | Малахит – это CuCO3·Cu(ОН)2 | | | ||
| | Горная порода доломит, химический состав которого соответствует формуле CaMg(CO3)2, относится к классу: карбонаты | | | ||
| | Эквивалент химического элемента зависит от валентности (степени окисления) | | | ||
| | Эквивалентный объем водорода составляет 11,2 л/моль | | | ||
| | Эквивалентная масса металла составляет 9. Чему равна эквивалентная масса его оксида? mэ(MeO) = mэ(Me) + mэ(O) = 9 + 8 = 17 гэкв. | | | ||
| | Эквивалентная масса азота в его оксиде составляет 7. Какова формула оксида? N2O | | | ||
| | Нормальная концентрация есть отношение количества эквивалентов растворенного вещества к объему раствора | | | ||
| | Моляльная концентрация есть отношение отношение количества растворенного вещества в молях к массе растворителя | | | ||
| | Мольная доля есть отношение количества молей данного компонента к общему количеству молей всех компонентов | | | ||
| | Молярная концентрация есть отношение количества растворенного вещества к объему раствора | | | ||
| | Процентная концентрация есть отношение процентное отношение массы растворенного вещества к общей массе раствора | | | ||
| | Присутствие сульфатов в водном растворе можно определить по образованию белого осадка с Ba2+(Ca2+) | | | ||
| | Осмотическое давление есть такое давление, которое надо приложить к концентрированному раствору, чтобы в него не поступал растворитель из менее концентрированного раствора | | | ||
| | Процесс осмоса характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности перегородки | | | ||
| | Кинетическое уравнение химической реакции записывается в следующем виде: v = k[A]a[B]b[C]c | | | ||
| | Закон Рауля формулируется следующим образом относительное понижение парциального давления пара растворителя над разбавленным бинарным раствором неэлектролита равно молярной доле растворенного вещества | | | ||
| | Эбуллиоскопическая константа необходима для расчета температуры кипения | | | ||
| | Криоскопическая константа необходима для расчета температуры замерзания | | | ||
| | Термодинамика – наука, изучающая превращение различных видов энергии друг в друга | | | ||
| | Размерность энтальпии: Дж/моль | | | ||
| | Энергия Гиббса – это термодинамический потенциал G=U+PV-TS | | | ||
| | В результате изотермического процесса вся теплота переходит в работу | | | ||
| | Согласно постулата Планка для идеального кристалла при 0 К равна нулю энтропия | | | ||
| | Математическое выражение первого начала термодинамики имеет следующий вид U=Q-A | | | ||
| | Закон Гесса необходим для нахождения теплоты химической реакции | | | ||
| | Абсолютный нуль (-273,15 С) – это температура, при которой происходит абсолютная остановка молекул и атомов | | | ||
| | В результате изотермического процесса вся теплота переходит в работу | | | ||
| | Энтропия возрастает в процессе необратимом | | | ||
| | Энергия химической связи тем больше, чем меньше длина связи | | | ||
| | Физический смысл орбитального квантового числа АО – атомная орбиталь характеризует форму АО | | | ||
| | Число неспаренных электронов в атоме золота равно 1 (один) | | | ||
| | Максимально возможное число электронов на 3 энергетическом уровне 2*n2 = 2*32=18 | | | ||
| | Невозможна следующая конфигурация в атоме | | | ||
| | Молекула NaCl образована следующей химической связью ионная | | | ||
| | Соль, гидролизующаяся только по аниону соль, образованная катионом сильного основания и анионом слабой кислоты | | | ||
| | Соль, гидролизующаяся только по катиону соль, образованная катионом слабого основания и анионом сильной кислоты | | | ||
| | Соль, гидролизующаяся по катиону и аниону соль, образованная катионом слабого основания и анионом слабой кислоты | | | ||
| | Растворимость – это концентрация раствора показывающая содержание растворяемого вещества в определенном количестве растворителя. | | | ||
| | Какой продукт образуется из Cr2(SO4)3 в реакции Cr2(SO4)3+Br2+KOH 16KOH + 3Br2 + Cr2(SO4)3 = 8H2O + 3K2SO4 + 6NaBr + 2K2CrO4(хроматкалия) | | | ||
| | В результате реакции KMnO4+Na2SO3(в кислой среде) образуется 5Na2SO3 + 3H2SO4 + 2KMnO4 = 5Na2SO4 + 2MnSO4 + 3H2O + K2SO4(сульфатмарганца (II)) | | | ||
| | Из KMnO4 в результате реакции KMnO4+FeSO4+H2SO4 образуется следующее вещество 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O (сульфатмарганца (II) | | | ||
| | Из K2Cr2O7 в результате реакции K2Cr2O7+Na2SO3+H2SO4 образуется следующее вещество 3Na2SO3 + 4H2SO4 + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + K2SO4+ 4H2O (сульфатхрома (III)) | | | ||
| | Из KBr в результате реакции KBr+Cl2 образуется следующее вещество | ||||
