Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
порядковому (атомному номеру Z) элемента (или числу протонов) | | ||||
| | Порядок заполнения электронами орбиталей атома определяется принципами Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей. Принцип Паули - на одной орбитали не может быть больше двух электронов. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары. | | |||
| | "Запрет" Паули заключается в том, что в атоме не может быть даже двух электронов с одинаковыми значениями четырех квантовых чисел | | |||
| | Максимальное число электронов на одной орбитали равно 2n2, n – номер орбитали | | |||
| | Правило Хунда гласит: в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары. | | |||
| | К d-элементам относятся Cu (медь), Ag (серебро), Au (золото), Zn (цинк), Cd (кадмий), Hg (ртуть), Sc (скандий), Y (иттрий), Ti (титан), Zr (цирконий), Hf (гафний), V (ванадий), Nb (ниобий), Ta (тантал), Cr (хром), Mo (молибден), W (вольфрам), Mn (марганец), Tc (технеций), Re (рений), Fe (железо), Ru (рутений), Os (осмий), Co (кобальт), Rh (родий), Ir (ирридий), Ni (никель), Pd (палладий), Pt (платина) | | |||
| | К f- элементам относятся все остальные | | |||
| | В атоме азота число неспаренных электронов равно 1 | | |||
| | В ряду элементов Li, Be, B, C, N, O, F электроотрицательность возрастает | | |||
| | Степень окисления хрома в бихромате калия равна +6 | | |||
| | Метасиликат натрия Na2SiO3 | | |||
| | СаС2+Н2О=С2Н2+Са(ОН)2 Сколько литров ацетилена (н.у.) выделилось, если гидроксида кальция образовалось 7,4 г? 2,24 л | | |||
| | Какую максимальную степень окисления может проявлять атом рения? +7 | | |||
| | Сколько фосфорной кислоты (М=98 г/моль) вступило в реакцию H3PO4+Ca(OH)2→ CaHPO4+2H2O, если в результате образовалось 36 г воды? 98 г | | |||
| | В каких единицах выражена универсальная газовая постоянная R, если ее значение равно 8,31 м3*Па/моль*К | | |||
| | Основная соль алюминия имеет вид Al(OH)… | | |||
| | 0,5 моль гидроксида натрия. Этому количеству вещества соответствует его масса, равная 20 г | | |||
| | Одновременно в растворе могут находиться: буферные растворы | | |||
| | Для вычисления количества вещества газа уравнением Авогадро можно воспользоваться, если: известен его объём | | |||
| | Хлорная кислота - это HClO4 | | |||
| | Какой объем кислорода (н.у.) пойдет на полное сжигание 24 г антрацита? 44,8 л | | |||
| | Присутствие хлоридов в водном растворе можно определить по образованию белого осадка с: серебром | | |||
| | Эквивалент азота в аммиаке равен 14/3 = 4.6 г/моль | | |||
| | Вычислить эквивалентную массу металла, если при взаимодействии 25 г его с соляной кислотой образовалось 2 г водорода 12,5 | | |||
| | Эквивалентная масса гидроксида кальция 37 | | |||
| | Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl) | | |||
| | В 98 г серной кислоты содержится водорода: 2 г | | |||
| | Сусальное золото химические соединения наподобие сульфида олова (SnS2), который применяется в составе красок, имитирующих позолоту | | |||
| | Определить карбонатную породу можно действием соляной кислоты | | |||
| | Массовую долю железа в Fe2(SO4)3 можно вычислить по формуле: ω(Fe) = M(Fe)/M(Fe2(SO4)3*100% | | |||
| | Первым доказательством сложного строения атома явилось открытие и изучение самопроизвольного распада атомов некоторых элементов, названное радиоактивностью | | |||
| | Бор использовал в своей модели атома квантовые числа | | |||
| | Символ f соответствует значению орбитального квантового числа 3 | | |||
| | Первым доказательством сложного строения атома явилось открытие и изучение самопроизвольного распада атомов некоторых элементов, названное радиоактивностью | | |||
| | Бор использовал в своей модели атома квантовые числа | | |||
| | Символ f соответствует значению орбитального квантового числа 3 | | |||
| | Главное квантовое число может принимать значения [1;+∞) | | |||
| | У атома никеля число электронов на внешнем уровне составляет: 2 | | |||
| | Состояние электрона в атоме описывается при помощи функции, которая называется: зависящей от координат x, y, z, названной волновой или пси-функцией, Ψ(x, y, z) | | |||
| | На электронном энергетическом подуровне 6d могут разместиться 10 электронов | | |||
| | В ряду Mg – Al – Ca металлические свойства: возрастают | | |||
| | В ряду элементов Na, Mg, Al, Si, P, S, Cl окислительная увеличивается | | |||
| | Координационное число железа в комплексе K[Fe(H2O)2(SO4)2] равно 4 | | |||
| | Сколько протонов находится в ядре атома вольфрама? 74 | | |||
| | Какое максимальное количество электронов может находиться на четвертом уровне? 2*n2 = 2*42=32 | | |||
| | Согласно квантовой теории, орбиталь – это: составляющая подуровня (s,p,d,f) | | |||
| | Удаленность электрона от ядра атома определяется главным квантовым числом | | |||
| | В ряду гидроксидов Ва(OH)2 – Al(OH)3 – Si(OH)4 основные свойства: усиливаются | | |||
| | Какая электронная конфигурация возможна? | | |||
| | Согласно теории Бора, энергия электрона в атоме определяется главным квантовым числом | | |||
| | Набор значений магнитного квантового числа показывает ориентацию в пространстве (возможные значения проекции полного момента атома на ось z) | | |||
| | Размерность энтропии Дж/(моль*К) | | |||
| | Электролитом является вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы | | |||
| | Тепловой эффект изотермического процесса равен: работе | | |||
| | Белый осадок при добавлении раствора нитрата серебра образует следующий комплекс [Ag(NO2)2]Cl | | |||
| | В водном растворе комплексные соединения диссоциируют на на комплексный ион и ионы, составляющие внешнюю сферу | | |||
| | Моляльная концентрация показывает: сколько находится кол-ва растворённого вещ-ва в объёме р-ра | | |||
| | Раствор отличается от химического соединения что состав раствора может изменяться непрерывно | | |||
| | Нормальная концентрация это отношение количества эквивалентов растворенного вещества к объему раствора | | |||
| | В одном килограмме 2 % раствора соляной кислоты масса растворенного вещества равна 20 г | | |||
| | Величина осмотического давления рассчитывается по формуле: 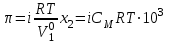 | | |||
| | К понятию «сильный электролит» не относится высказывание: то, что относится к слабому электролиту | | |||
| | Для какого из растворов концентрацией 0,1 моль/кг содержание ОН– будет наибольшим? | | |||
| | Выбрать способ расчета рН раствора сероводородной кислоты (H2S) | ||||
