Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
2KBr + Cl2 = 2KCl + Br2↑ (бром) | | | |||
| | Степень окисления марганца в перманганате калия+7 | | | ||
| | Степень окисления хлора в перхлорате калия +7 | | | ||
| | Степень окисления серы в сульфите калия +4 | | | ||
| | Бор использовал в своей модели атома квантовые числа | | | ||
| | Главное квантовое число может принимать значения [1;+∞) | | | ||
| | Орбитальное квантовое число может принимать значения от 0 до (n-1) | | | ||
| | Магнитное квантовое число может принимать значения -L;…;0;…+L | | | ||
| | Спиновое квантовое число может принимать значения +1/2; -1/2 | | | ||
| | Максимальная степень окисления железа равна +6 | | | ||
| | Степень окисления хрома в бихромате калия равна: +6 | | | ||
| | Заряд комплексного иона равен в следующем комплексе: | | | ||
| | Амминокомплексом является например, [Cu(NH3)4]SO4, т.е. в комплекс-ионе есть (NH3)n | | | ||
| | Аквакомплексом является например, К[Cr(Н2О)2(ОН)4] или [Со(Н2О)6]Сl2, т.е. в комплекс-ионе есть (Н2О)n | | | ||
| | Гидроксокомплексом является например, [Аl(Н2О)4(ОН)2]Сl, т.е. в комплекс-ионе есть (OH)n | | | ||
| | Следующие электролиты при диссоциации в водном растворе образуют ионы водорода: | | | ||
| | Растворитель-это компонент раствора агрегатное состояние которого не изменилось при образовании раствора | | | ||
| | Белый осадок AgCl растворяется с образованием комплекса [Ag(NH3)2]Cl | | | ||
| | Химическая кинетика – это наука которая изучает скорость химической реакции | | | ||
| | Константа равновесия равна Kc = [C]c[D]d/[A]a[B]b | | | ||
| | . Равновесие процесса N2 + 3H2 2NH3 при повышении давления сместится в сторону образования NH3 | | | ||
| | Константа скорости реакции зависит от температуры и не зависит от pH среды | | | ||
| | Для реакции Zn + 2HCl (г) ZnCl2 + H2 при понижении давления равновесие сместится в сторону в левую сторону | | | ||
| | Сильной кислотой является | | | ||
| | Для слабых бинарных электролитов выражение 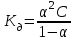 носит название константа диссоциации | | | ||
| | При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна корень из 1,8*10-5 = 0.134 | | | ||
| | Из приведенных электролитов выберите самый слабый | | | ||
| | Слабым основанием являетсяNH4OH, Pb(OH)2… | | | ||
| | Ионное произведение воды равно КH2O = 1.10-14 | | | ||
| | Размерность энтропии Дж/(моль*К) | | | ||
| | В изобарно-изотермических условиях реакции протекают самопроизвольно в направлении продуктов реакции | | | ||
| | Изменение энергии Гиббса в изобарно-изотермическом процессе вычисляется по формуле 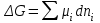 | | | ||
| | Для определения влияния давления на температуру фазовых превращений в однокомпонентных системах постоянного состава применяют уравнение Клаузиуса-Клапейрона 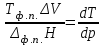 | | | ||
| | Фенолфталеин в щелочной среде имеет цвет малиновый (рубиново-красный, пурпурный) | | | ||
| | Лакмус в кислой среде имеет цвет красный | | | ||
| | Значение рН щелочного раствора рассчитывают по формуле рН=14+lg[OH-] | | | ||
| | Среда водного раствора, водородный показатель которого рН = 13,0 щелочная | | | ||
| | Электролиты - это вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы | | | ||
| | Степень диссоциации – это отношение числа молекул, распавшихся при диссоциации, к их общему числу | | | ||
| | Сильные электролиты – это вещества электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как:HCl, HBr, HI, HNO3) | | | ||
| | Слабые электролиты – это вещества степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов | | | ||
| | Реакции Fe(OH)3 + 3HCl FeCl3 + 3H2O отвечает следующее ионное уравнение Fe(OH)3 + 3H+ = Fe3+ + 3H2O | | | ||
| | В каком из этих соединений больше массовая доля водорода | | | ||
| | Электролиз - это физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита. | | | ||
| | Коррозия - это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой | | | ||
| | Уравнение Нернста для электродов I рода 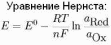 | | | ||
| | Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl) | | | ||
| | Горная порода доломит, химический состав которого соответствует формуле CaMg(CO3)2, относится к классу: карбонаты | | | ||
| | Сусальное золото – это химические соединения наподобие сульфида олова (SnS2), который применяется в составе красок, имитирующих позолоту | | | ||
| | Метасиликат натрия Na2 | ||||
