Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
Для реакцииH2 + I2 = 2HI скорость обратного процесса определяется уравнением 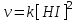 | | ||||
| | Константа скорости химической реакции зависит от температуры | | |||
| | По правилу Вант-Гоффа при повышении температуры на 100 скорость реакции увеличится в 2 раза | | |||
| | Уравнение Аррениуса имеет вид: k = k0е(-Е/RT) | | |||
| | Для реакции: aA+bBcC+dD закон действующих масс выражается уравнением: v = k[A]a[B]b | | |||
| | Величина К в выражении закона действующих масс называется константой скорости | | |||
| | Принцип Ле Шателье заключается в следующем: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие в системе ослабляет это воздействие | | |||
| | При повышении температуры равновесие смещается в сторону: эндотермической реакции | | |||
| | Для реакции CaCO3 = CaO + CO2 при понижении давления равновесие сместится в сторону: продуктов | | |||
| | Константа равновесия не зависит от концентрации | | |||
| | Константа равновесия реакции Fe3O4 + CO 3FeO + CO2 равна: K = [CO2]/[CO] | | |||
| | Раствором называется гомогенные системы, состоящие из двух или более компонентов, состав к-рых в определенных пределах может непрерывно изменяться. | | |||
| | Растворимостью вещества называется способность вещества растворяться в том или ином растворителе | | |||
| | К безразмерным способам выражения концентрации растворов относятся: массовая доля (ω), мольная доля (xi) | | |||
| | Молярность раствора – это число молей растворенного вещества, приходящееся на объём р-ра | | |||
| | Единицы измерения нормальной концентрации (СN)? г экв./л | | |||
| | Единицы измерения моляльной концентрации (Сm): моль р.в./кг растворителя | | |||
| | Мольная доля растворенного вещества показывает количества растворенного вещества в общем количестве веществ в растворе | | |||
| | Температура замерзания раствора температура начала кристаллизации твёрдой фазы из раствора | | |||
| | Изменение температуры кипения раствора рассчитывается по формуле: 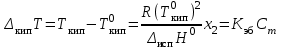 | | |||
| | Окислителями называются вещества, в состав которых входят атомы, присоединяющие во время химической реакции электроны | | |||
| | Восстановителем является вещество, отдающее электроны в ходе ОВР | | |||
| | Марганец восстанавливается по схеме Mn+7+5e=Mn+2 в какой среде? кислой | | |||
| | Укажите, какие из приведенных процессов представляют собой окисление | | |||
| | В нейтральной среде взаимодействие KMnO4 с Na2SO3 приводит к образованию: 3Na2SO3 + H2O + 2KMnO4 = 3Na2SO4 + 2MnO2↓ + 2KOH(оксид марганца) | | |||
| | Найдите формулу комплексного соединения с химическим названием: нитрат акватетрааммин-цианокобальта (III) что-то вида [Co(CN)2(H2O)(NH3)4]NO3 | | |||
| | Чему равен заряд комплексного иона в соединении – гексацианоферрат калия (III)? +3 | | |||
| | Молярная концентрация 0,06 N раствора ортофосфорной кислоты равна 0.02 моль/л | | |||
| | 40 г гидроксида натрия содержится в следующем количестве 5 % раствора масса раствора 800г | | |||
| | В растворе содержится 2 кг воды и 400 г NaOH. Моляльная концентрация раствора равна 5 моль/кг | | |||
| | В 2 литрах децимолярного раствора серной кислоты содержится растворенного вещества 19.6 г | | |||
| | В соответствии с законом Вант - Гоффа осмотическое давление разбавленных растворов равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре | | |||
| | Электролиты - это вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы | | |||
| | Степень диссоциации электролита - это Количественная мера силы (слабости) электролитов, не зависящей от их концентрации | | |||
| | В растворах слабых электролитов присутствуют недиссоциированные молекулы и ионы | | |||
| | Из приведенных электролитов выберите самый слабый | | |||
| | Сильным основанием является | | |||
| | Какое из приведенных уравнений соответствует первой стадии диссоциации угольной кислоты? H2CO3 HCO3- + H+ | | |||
| | Ионное произведение воды равно КH2O = 1.10-14 | | |||
| | Индикаторы – это органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно-основные (напр., фенолфталеин, лакмус),окислительно-восстановительные (напр., метиленовый синий) и др. | | |||
| | Фенолфталеин в щелочной среде имеет цвет малиновый (рубиново-красный, пурпурный) | | |||
| | Сильную кислоту можно отличить от слабой по: константе диссоциации большей 1×10−3 | | |||
| | Какой из электролитов при диссоциации образует ионы Н+ в водном растворе? | | |||
| | В растворе 0,005 М серной кислоты рН равен 4,6 | | |||
| | рН рассчитывают по формуле: pH = -lg[H+] | | |||
| | Среда водного раствора, водородный показатель которого рН = 13,2 сильно щелочная | | |||
| | В растворе Ba(OH)2 концентрацией 0,0005 М водородный показатель равен pH = 14 – 2p[OH-] = 14-6,6 = 7,4 | | |||
| | При написании молекулярно-ионных уравнений реакций обмена следует писать в виде ионов … сильные электролиты | | |||
| | Реакции обмена CaCO3 + 2HCl = CaCl2 + CO2 + H2O отвечает молекулярно-ионное уравнение CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O | | |||
| | Гидролизом называется реакция | | |||
| | Гидролизу практически не подвергаются соли, образованные сильным основанием и сильной кислотой | | |||
| | В водном растворе гидрокарбоната калия лакмус приобретает окраску: синюю | | |||
| | В результате гидролиза AlCl3 в водном растворе преимущественно образуется: кислая среда | | |||
| | Растворимость соли всегда понижается при повышении концентрации в растворе одного из его ионов | | |||
| | Произведение растворимости это произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении | | |||
| | Произведение растворимости AgSCN равно 1,1610-12. Растворимость соли в воде (моль/л) равна корень квадратный из 1,1610-12 | | |||
| | Значение электродного потенциала рассчитывается по уравнению: 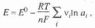 Нернста Нернста | | |||
| | Масса образовавшегося в ходе электролиза вещества рассчитывается по уравнению: m = ЭQ/f | | |||
| | Тепловой эффект изотермического процесса равен: работе | | |||
| | При р, Т = const изменение энергии Гиббса вычисляется по формуле: 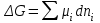 | | |||
| | Энтропия имеет размерность Дж/моль*К | | |||
| | Самопроизвольные процессы при данных р, Т | | |||
| | Какую воду называют жесткой? обладающую повышенным содержанием солей магния и кальция | | |||
| | Какая жесткость воды называется временной? жесткость, обусловленная наличием в воде гидрокарбонатов кальция и магния | | |||
| | При нормальных условиях объем, занимаемый 32 г кислорода равен 22.4 л | | |||
| | Оксид мышьяка содержит 75,76% по массе мышьяка. Химический эквивалент мышьяка в этом оксиде равен 37,5 г/моль | | |||
| | Относятся к основаниям: …(даны формулы веществ) | | |||
| | Гидроксосульфат меди (II) - это Cu2(OH)2SO4 | | |||
| | Химические реакции – это превращения одних веществ в другие, отличные по химическому составу и (или) строению | | |||
| | Относятся к кислым солям например, NaHSO4, содержат H | | |||
| | Степенью окисления элемента в химическом соединении называется формальный заряд атома в молекуле, вычисленный исходя из предположения, что все связи атомов в молекуле ионные | | |||
| | Количество вещества рассчитывают по формуле – n = m/M | | |||
| | Восстановлением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. | | |||
| | Окислителями в химии называются вещества, в состав которых входят атомы, присоединяющие во время химической реакции электроны | | |||
| | Сернистая кислота – это H2SO3 | | |||
| | Восстановление марганца в реакциях перманганата с восстановителями происходит по схеме Mn+7+3e=Mn+4 в нейтральной среде | | |||
| | Укажите, какие из приведенных процессов представляют собой восстановление прибавление электронов | | |||
| | В сильнощелочной среде взаимодействие KMnO4 с Na2SO3 приводит к образованию: K2MnO4 | | |||
| | Горная порода доломит, химический состав которого соответствует формуле CaMg(CO3)2, относится к классу: карбонаты | | |||
| | Степень окисления азота в соединениях NH3, N2H4, NH2OH, N2, N2O, NO, HNO2, NO2, HNO3 соответственно равна: -3, -2, -1, 0, +1, +2, +3, +4, +5 | | |||
| | К галогенам относятся: F (фтор), Cl (хлор), I (иод), Br (бром), At (астат) | | |||
| | Относятся к щелочноземельным элементам: Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий), Ra (радий) | | |||
| | Число молей в 36 граммах жидкой воды равно 2 | | |||
| | Самым распространенным химическим элементом в земной коре является кислород | | |||
| | Эквивалентная масса серной кислоты равна в г/моль 49 | | |||
| | Гидридом является соединение водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами | | |||
| | Номер элемента – 52. Элемент называется теллур | | |||
| | Силикатом является соль кремниевой кислоты (Н2SiO3) | | |||
| | Число электронов в атомах элементов равно номеру элементов в периодической таблице | | |||
| | Число квантовых чисел, характеризующих состояние электронов в атомах элементов, равно порядковому (атомному номеру Z) элемента (или числу протонов) | | |||
| | Число значений главного квантового числа электронов атома n равно [1;+∞) | | |||
| | Главное квантовое число может принимать значения [1;+∞) | | |||
| | Какую максимальную степень окисления может проявлять атом ниобия? +5 | | |||
| | Число значений спина электрона равно 2 | | |||
| | Порядок заполнения электронами орбиталей атома определяется принципами Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей. Принцип Паули - на одной орбитали не может быть больше двух электронов. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары. | | |||
| | "Запрет" Паули заключается в том, что в атоме не может быть даже двух электронов с одинаковыми значениями четырех квантовых чисел | | |||
| | В атоме кремния число неспаренных электронов равно 4 | | |||
| | Максимальное число электронов на одной орбитали равно 2n2, n – номер орбитали | | |||
| | Валентности атома углерода (IV) соответствует электронная конфигурация 1s22s12p3 | | |||
| | У атома никеля число электронов на внешнем уровне составляет 2 | | |||
| | Какова формула оксида циркония (IV) ZrO2 | | |||
| | Правило Хунда гласит: в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары. | | |||
| | К s-элементам относятся Li (литий), Na (натрий), K (калий), Rb (рубидий), Cs (цезий), Fr (франций), Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий), Ra (радий) | | |||
| | К p-элементам относятсяB (бор), Al (алюминий), Ga (галлий), In (индий), Tl (таллий), C (углерод), Si (кремний), Ge (германий), Sn (олово), Pb (свинец), N (азот), P (фосфор), As (мышьяк), Sb (сурьма), Bi (висмут), O (кислород), S (сера), Se (селен), Te (теллур), Po (полоний), F (фтор), Cl (хлор), Br (бром), I (иод), At (астат), Ne (неон), Ar (аргон), Kr (криптон), Xe (ксенон), Rn (радон) | | |||
| | К d-элементам относятсяCu (медь), Ag (серебро), Au (золото), Zn (цинк), Cd (кадмий), Hg (ртуть), Sc (скандий), Y (иттрий), Ti (титан), Zr (цирконий), Hf (гафний), V (ванадий), Nb (ниобий), Ta (тантал), Cr (хром), Mo (молибден), W (вольфрам), Mn (марганец), Tc (технеций), Re (рений), Fe (железо), Ru (рутений), Os (осмий), Co (кобальт), Rh (родий), Ir (ирридий), Ni (никель), Pd (палладий), Pt (платина) | | |||
| | К f-элементам относятся все остальные | | |||
| | Орбитальное квантовое число может принимать значения от 0 до (n-1) | | |||
| | Основными типами химической связи атомов в молекулах веществ являются ковалентная, ионная, металлическая | | |||
| | В ряду элементов Na, Mg, Al, Si, P, S, Cl окислительная способность увеличивается | | |||
| | В молекуле водорода число неспаренных электронов равно 1 | | |||
| | Химический элемент с электронным паспортом 1s22s22p63s23p63d64s2 называется Fe (железо) | | |||
| | Химическая кинетика – это наука которая изучает скорость химической реакции | | |||
| | Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс | | |||
| | Катализаторы - это химические вещества, ускоряющие реакции, но не входящие в состав продуктов реакции | | |||
| | Кинетическое уравнение химической реакции записывается в следующем виде: v = k[A]a[B]b[C]c | | |||
| | Температурный коэффициент скорости реакции равен 2. При повышении температуры на 400 скорость реакции увеличится В240 раза | | |||
| | Энергия активации реакции это минимальное количество энергии, которое требуется сообщить системе чтобы произошла реакция | | |||
| | Химическое равновесие в обратимых химических реакциях наступает когда обратимо протекает одна или несколько химических реакций, причем скорости в каждой паре прямая-обратная реакция равны между собой | | |||
| | Из 20 молей SO2 и 20 молей O2, смешанных в сосуде, объемом 10 л, при равновесии образовалось по реакции 2SO2 + O 2 = 2SO3 16 молей SO3. Константа равновесия этой реакции равна 0,32 | | |||
| | Раствором в химии называется гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия | | |||
| | В зависимости от концентрации растворы бывают: насыщенными и перенасыщенными | | |||
| | Растворимостью вещества называется способность вещества растворяться в том или ином растворителе | | |||
| | К безразмерным способам выражения концентрации растворов относятся: массовая доля (ω), мольная доля (xi) | | |||
| | К имеющим размерность способам выражения концентрации растворов относятся: молярная концентрация (CM), нормальная концентрация (CN), концентрация г/л (Cг/л), моляльная концентрация (Cm) | | |||
| | Моляльность раствора – это число молей растворенного вещества, приходящееся на | | |||
| | Сумма мольных долей всех компонентов раствора равна 1 (единице) | | |||
| | Молярность 10%-го водного раствора NH4NO3 (плотностью = 1,08 г/мл) равна: 80/108=0,74 моль/л | | |||
| | Масса растворенного вещества в одном литре 0,1 н раствора серной кислоты равна 4,9 г | | |||
| | Если в 2 кг раствора содержится 100 г серной кислоты, то массовая доля кислоты в этом растворе равна 5% | | |||
| | Раствор приготовлен из 1,6 кг воды и 400 г NaOH. Концентрация этого раствора в % по массе равна (0,4/2)*100%=20% | | |||
| | В 1 литре миллимолярного раствора серной кислоты содержится растворенного вещества 0,098 г | | |||
| | Температура кипения растворов нелетучих компонентов, растворенных в летучем растворителе, 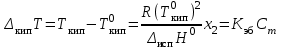 | | |||
| | Криоскопическая постоянная воды равна 1,86 К·молькг. Раствор, содержащий 1 моль NaCl (=1) в 1 кг воды кристаллизуется при температуре -1,86 К | | |||
| | Электролитами называются вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток | | |||
| | Электролиты относятся к проводникам второго рода | | |||
| | Процесс диссоциации молекул слабых электролитов на ионы частичен | | |||
| | По величине степени диссоциации электролиты делятся на полностью продиссоциировавшие и частично | | |||
| | К сильным электролитам из перечисленных относятся образованные сильным основанием и слабой кислотой или наоборот | | |||
| | К сильным кислотам из перечисленных относятся | | |||
| | Количественной мерой силы (слабости) электролитов, не зависящей от их концентрации, служит величина степень диссоциации | | |||
| | При изменении концентрации раствора слабого электролита (уксусная кислота) степень его диссоциации увеличивается | | |||
| | При 250С константа диссоциации синильной кислоты равна 4,9310-10. Степень диссоциации HCN в 1 М водном растворе равна корень из 4,93*10-10 | | |||
| | Лакмус в щелочной среде имеет цвет синий | | |||
| | Из приведенных электролитов выберите самый слабый | | |||
| | Слабым основанием являетсяNH4OH, Pb(OH)2… | | |||
| | Какое из приведенных уравнений соответствует второй стадии диссоциации угольной кислоты? HCO3- H+ + CO3 | | |||
| | Ионное произведение воды равно КH2O = 1.10-14 | | |||
| | Для количественной оценки кислотности и щелочности разбавленных водных растворов обычно используют величину рН от 0 до 14 | | |||
| | Сумма водородного и гидроксильного показателей в водном растворе при 250С равна 14 | | |||
| | При 250С среда водного раствора, водородный показатель которого рН = 8,0 щелочная | | |||
| | В 10-4 н водном растворе серной кислоты водородный показатель равен 2 | | |||
| | Значение электродного потенциала рассчитывается по уравнению 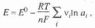 Нернста Нернста | | |||
| | Размерность энтальпии Дж/моль | | |||
| | Экзотермической называется реакция, протекающая с выделением теплоты | | |||
| | Гидролизом называется реакция присоединения воды | | |||
| | Гидролизу практически не подвергаются соли, образованные сильными кислотами и основаниями | | |||
| | Из перечисленных солей не подвергаются гидролизу образованная сильным основанием и сильной кислотой | | |||
| | При смешивании водных растворов Na2CO3 и FeCl3 образуются: соответствующие основания и кислоты | | |||
| | Жесткость воды обусловлена присутствием ионов Ca+2 и Mg+2 | | |||
| | Произведение растворимости CaCO3 равно 4,410-9. Растворимость кальцита в воде (моль/л) равна корень квадратный из 4,410-9 | | |||
| | Количество электричества, обуславливающее электрохимическое превращение одного эквивалента вещества, называется константой Фарадея | | |||
| | К простым веществам относятся все, кроме галогеновF (фтор), Cl (хлор), I (иод), Br (бром), At (астат) | | |||
| | Химический элемент - это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке | | |||
| | Хлорная кислота - это HClO4 | | |||
| | Сколько моль вещества содержится в 16 г кислорода? 0,5 | | |||
| | Одним из минералов, входящих в состав вольфрамовых руд, является шеелит. Его формула – CaWO4, а химическое название: вольфрамат кальция | | |||
| | Относятся к основаниям: | | |||
| | Химическая формула - это обозначение качественного и количественного состава вещества при помощи символов химических элементов | | |||
| | К минералам не относятся: | | |||
| | Реакциями соединения называются химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество | | |||
| | Количество вещества рассчитывают по формуле – n=m/M | | |||
| | Карбонатами называются соли: угольной кислоты | | |||
| | К благородным газам относятся: элементы 8 группы таблицы Менделеева | | |||
| | К щелочным элементам относятся: эл-ты 1ой группы главной подгруппы | | |||
| | К группе галогенов не относится | | |||
| | Эквивалентная масса хлора(г/моль) 17,75 | | |||
| | Эквивалентный объем брома составляет (л/моль) 11,2 | | |||
| | Эквивалентная масса металла составляет 12. Чему равна эквивалентная масса его оксида? 28 | | |||
| | Эквивалентная масса азота в его оксиде составляет 7. Какой это оксид? N2O | | |||
| | Химическая кинетика – это наука которая изучает скорость химической реакции | | |||
| | Кинетическое уравнение химической реакции записывается в следующем виде: v = k[A]a[B]b[C]c | | |||
| | |||||
