Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
Для реакцииH2 + I2 = 2HI скорость обратного процесса определяется уравнением: v = k[HI]2 | | ||||
| | Константа скорости химической реакции зависит от температуры | | |||
| | По правилу Вант-Гоффа при повышении температуры на 100 скорость реакции увеличится в 2 раза | | |||
| | Уравнение Аррениуса имеет вид: k = k0е(-Е/RT) | | |||
| | Величина К в выражении закона действующих масс называется константой скорости | | |||
| | При повышении температуры равновесие смещается в сторону: эндотермической реакции | | |||
| | Для реакции CaCO3 = CaO + CO2 при понижении давления равновесие сместится в сторону: вправо | | |||
| | Константа равновесия не зависит от концентрации | | |||
| | Константа равновесия реакции Fe3O4 + CO 3FeO + CO2 равна: K = [CO2]/[CO] | | |||
| | Раствором называется | | |||
| | Растворимостью вещества называется способность вещества растворяться в том или ином растворителе | | |||
| | Произведение растворимости это произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении | | |||
| | Произведение растворимости AgSCN равно 1,1610-12. Растворимость соли в воде (моль/л) равна корень квадратный из 1,1610-12 | | |||
| | К безразмерным способам выражения концентрации растворов относятся: массовая доля (ω), мольная доля (xi) | | |||
| | Молярность раствора – это число молей растворенного вещества, приходящееся на объём раствора | | |||
| | Единицы измерения нормальной концентрации (СN)? г экв/л | | |||
| | Единицы измерения моляльной концентрации (Сm): моль/кг | | |||
| | Мольная доля растворенного вещества показывает количества растворенного вещества в общем количестве веществ в растворе | | |||
| | Температура замерзания раствора температура начала кристаллизации твёрдой фазы из раствора | | |||
| | Изменение температуры кипения раствора рассчитывается по формуле: 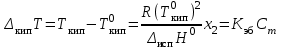 | | |||
| | В соответствии с законом Вант - Гоффа осмотическое давление разбавленных растворов равно 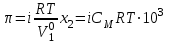 | | |||
| | Окислителями называются вещества, в состав которых входят атомы, присоединяющие во время химической реакции электроны | | |||
| | Восстановителем является вещество, отдающее электроны в ходе ОВР | | |||
| | Марганец восстанавливается по схеме Mn+7+5e=Mn+2 в кислой среде | | |||
| | Укажите, какие из приведенных процессов представляют собой окисление | | |||
| | В нейтральной среде взаимодействие KMnO4 с Na2SO3 приводит к образованию: 3Na2SO3 + H2O + 2KMnO4 = 3Na2SO4 + 2MnO2↓ + 2KOH (оксидмарганца) | | |||
| | Найдите формулу комплексного соединения с химическим названием: нитрат акватетрааммин-цианокобальта (III) что-то вида [Co(CN)2(H2O)(NH3)4]NO3 | | |||
| | Чему равен заряд комплексного иона в соединении – гексацианоферрат калия (III)? +3 | | |||
| | Молярная концентрация 0,09 N раствора ортофосфорной кислоты равна 0,27 | | |||
| | 80 г гидроксида натрия содержится в следующем количестве 5 % раствора 1,6 кг | | |||
| | В растворе содержится 2 кг воды и 400 г NaOH. Моляльная концентрация раствора равна 400/40/2=5 | | |||
| | В 2 литрах децимолярного раствора серной кислоты содержится растворенного вещества 0, 2 моль | | |||
| | Электролиты - это вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы | | |||
| | Степень диссоциации электролита - это Количественная мера силы (слабости) электролитов, не зависящей от их концентрации | | |||
| | В растворах слабых электролитов присутствуют недиссоциированные молекулы и ионы | | |||
| | При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна корень из 1,8*10-5 = 0.134 | | |||
| | Из приведенных электролитов выберите самый слабый | | |||
| | Сильным основанием является | | |||
| | Какое из приведенных уравнений соответствует первой стадии диссоциации угольной кислоты? H2CO3 HCO3- + H+ | | |||
| | Ионное произведение воды равно КH2O = 1.10-14 | | |||
| | Индикаторы – это органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно-основные (напр., фенолфталеин, лакмус),окислительно-восстановительные (напр., метиленовый синий) и др. | | |||
| | Фенолфталеин в щелочной среде имеет цвет малиновый (рубиново-красный, пурпурный) | | |||
| | Сильную кислоту можно отличить от слабой по: константе диссоциации большей 1×10−3 | | |||
| | Какой из электролитов при диссоциации образует ионы Н+ в водном растворе? | | |||
| | В растворе 0,001 М серной кислоты рН равен 3 | | |||
| | рН рассчитывают по формуле: pH=-lg[H+] | | |||
| | Среда водного раствора, водородный показатель которого рН = 13,2 сильнощелочная | | |||
| | В растворе Ba(OH)2 концентрацией 0,0005 М водородный показатель равен 10,7 | | |||
| | При написании молекулярно-ионных уравнений реакций обмена следует писать в виде ионов сильные электролиты | | |||
| | Реакции обмена CaCO3 + 2HCl = CaCl2 + CO2 + H2O отвечает молекулярно-ионное уравнение CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O | | |||
| | Гидролизу практически не подвергаются соли, образованные сильным основанием и сильной кислотой | | |||
| | В водном растворе гидрокарбоната калия лакмус приобретает окраску: синюю | | |||
| | В результате гидролиза хлорида железа в водном растворе преимущественно образуется: кислая среда | | |||
| | Значение электродного потенциала рассчитывается по уравнению: 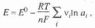 Нернста Нернста | | |||
| | Масса образовавшегося в ходе электролиза вещества рассчитывается по уравнению: m = ЭQ/f | | |||
| | Тепловой эффект изотермического процесса равен: работе | | |||
| | При р, Т = const изменение энергии Гиббса вычисляется по формуле: 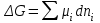 | | |||
| | Энтропия имеет размерность Дж/моль*К | | |||
| | Самопроизвольные процессы при данных р, Т | | |||
| | Какую воду называют жесткой? обладающую повышенным содержанием солей магния и кальция | | |||
| | Какая жесткость воды называется временной? жесткость, обусловленная наличием в воде гидрокарбонатов кальция и магния | | |||
| | Бор использовал в своей модели атома квантовые числа | | |||
| | Главное квантовое число может принимать значения [1;+∞) | | |||
| | Какую максимальную степень окисления может проявлять атом фтора? -1 | | |||
| | Число квантовых чисел, характеризующих состояние электронов в атомах элементов, равно | ||||
