|
Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
Среди перечисленных реакцией нейтрализации является
Окислительно-восстановительной
реакцией является
|
Cо щелочами реагирует оксид
|
При взаимодействии
Са + Н2О образуется Ca + 2H2O = Ca(OH)2↓ + H2↑
|
Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl)
|
Химические процессы, протекающие с поглощением теплоты, называются эндотермическим
|
Энтальпия – это энергия расширенной системы
|
Формулировка «энтропия идеального кристалла чистого вещества при 0 К равна нулю» относится к постулату Планка (3-е начало термодинамики)
|
Энергия Гиббса – это термодинамический потенциал в необратимых процессах
|
Формулировка «тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от пути реакции и ее промежуточных стадий» относится к функции состояния
|
Изобарическим
называется процесс, протекающий в системе при постоянном давлении
|
Уравнение Q=dU+W является математическим выражением 1-го начала термодинамики
|
Изменение энтропии для реакции:
NH3 (газ.) + HCl(газ.) = NH4Cl (тв.)
S=S(NH4Cl)-S(HCl)-S(NH3)
|
Неэлектролитами
являются
|
Свойство растворов, являющееся
коллигативным зависят от природы растворителя и концентрации раствора
|
Нормальная концентрация есть отношение экв. вещ-ва к объёму р-ра
|
50% раствор H2SO4 содержит
|
1 М раствор едкого
натра содержит (объем 1 л) 1 моль
|
1 N раствор соляной кислоты содержит 1 моль
| Осмосом называют Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану |
Раствор содержит 10 г Na2SO3 и 90 г воды. Какова процентная концентрация раствора? 10%
|
Возможные степени окисления Сl 7, 6, 5, 4, 3, 1, −1
|
Элемент, имеющий степень окисления,
равной ( -2 )
|
К группе благородных газов не относится
|
Повышение температуры кипения раствора
можно найти как 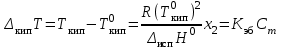
|
Закон Рауля формулируется следующим
образом относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе
|
Жесткость воды обусловлена присутствием ионов: Ca2+, Mg2+
|
Возможные степени окисления Fe 6, 3, 2, 0
|
Один из
продуктов реакции KMnO4+MnSO4+ +H2O= MnO2
|
Ионное произведение чистой воды при
250 С равно 10-14
|
Водородный показатель (рН) - это величина, характеризующая активность или концентрацию ионов водорода в растворах
|
При взаимодействии концентрированной
H2SO4 c Cu образуется 2H2SO4+Cu=CuSO4+SO2+2H2O
|
На титрование 10 мл кислоты израсходовали 20 мл 0,5 N раствора щелочи. Какова концентрация кислоты? 1 N
|
Роданид аммония – это NH4CNS
|
рН раствора серной кислоты: -lg[H+]
|
Лакмус в кислой среде красным
|
Фенолфталеин в щелочной среде малиновый
|
Сусальное золото- это химические соединения наподобие сульфида олова (SnS2), который применяется в составе красок, имитирующих позолоту
|
Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса исходных вещ-в и продуктов
|
В первой половине XVIII века увеличение массы металла после прокаливания на воздухе объясняли присоединением огненной материи
|
Гашеная известь – это Ca(OH)2
|
Эквивалентная масса карбоната натрия в реакции:
Na2CO3 + HCl = NaHCO3 + NaCl равна 106 /(2·1) = 53 г/моль
|
В каком из этих соединений больше доля водорода
|
Максимальная степень окисления железа равна +6
|
Бор использовал в своей модели
атома квантовые числа
|
Главное квантовое число может принимать значения [1;+∞)
|
Орбитальное квантовое число может принимать значения от 0 до (n-1)
|
Магнитное квантовое число может принимать значения
-L;…;0;…+L
|
Спиновое квантовое число может принимать значения +1/2; -1/2
|
Порядок заполнения
электронами орбиталей атома определяется принципами Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей. Принцип Паули - на одной орбитали не может быть больше двух электронов. Правило Хунда -в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
|
I правило Клечковского Порядок заполнения энергетических уровней определяется возрастанием n+L, а при одинаковом её значении первым заполняется подуровень с меньшим значением n в этой сумме
|
Атом поглощает или излучает энергию при переходе электрона из состояния с низкой энергией в состояние с высокой энергией. Наоборот, атом излучает энергию при переходе электрона из состояния с высокой энергией в состояние с низкой энергией.
|
Физический смысл
орбитального квантового числа
(АО – атомная орбиталь) характеризует форму АО
|
Правило Хунда в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
|
Символы только
d – элементов расположены в ряду в побочной группе (все металлы)
|
Для какого металла в основном состоянии имеет место «провал» электрона типа:
1e
4s → 3d Cu (медь)
|
Число неспаренных электронов в атоме золота равно
|
Амминокомплексом является например, [Cu(NH3)4]SO4, т.е. в комплекс-ионе есть (NH3)n
|
Элементом с конфигурацией внешнего слоя 3d104s1 являетсяCu (медь)
|
Невозможна следующая конфигурация в атоме
|
Молекула HF образована следующей химической связью ковалентная полярная
|
В ряду элементов Li, Be, B, C, N, O, F
электроотрицательность возрастает
|
Химическая кинетика – это наука которая изучает скорость химической реакции
|
Кинетическое уравнение химической реакции записывается в следующем виде: v = k[A]a[B]b[C]c
|
Термодинамика есть наука, изучающая взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию
|
Закон Гесса необходим для нахождения теплового эффекта хим. р-ции
|
При р, Т = const изменение энергии Гиббса вычисляется по формуле: 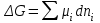
|
С увеличением температуры энтропия: возрастает
|
Пара следующих ионов может находиться совместно в растворе
|
Соль, гидролизующаяся только по катиону соль, образованная катионом слабого основания и анионом сильной кислоты
|
Растворимость – это концентрация раствора показывающая содержание растворяемого вещества в определенном количестве растворителя.
|
Нормальность – это, содержащееся в 1 л раствора количество грамм-эквивалентов
|
10 мл 0,2 N H2SO4 реагирует с 5 мл гидроксида натрия.
Какова нормальная
концентрация щелочи? 0,4 н
|
Моляльная концентрация измеряется в моль р.в./кг р-ля
|
Если смешать 35 г калийной селитры и 65 г воды, какова массовая доля KNO3 в растворе: 35%
|
Константа равновесия равнаKc = [C]c[D]d/[A]a[B]b
|
Константа скорости реакции зависит от температуры и не зависит от pH среды
|
Осмос – это проникновение через полупронецаемую
перегородку в раствор с большей концентрацией растворенного вещества
|
Следующие электролиты при диссоциации в водном растворе образуют ионы водорода:
|
Равновесие процесса
N2 + 3H2 2NH3 при повышении давления сместится в сторону образования NH3
|
Раствор отличается от химического соединения что состав раствора может изменяться непрерывно
|
Растворитель-это компонент раствора агрегатное состояние которого не изменилось при образовании раствора
|
Электролиты - это вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы
|
По величине степени диссоциации электролиты делятся на сильные, средние и слабые
|
Сильной кислотой является
|
Для слабых бинарных электролитов выражение 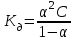
носит название константа диссоциации
|
При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна корень из 1,8*10-5 = 0.134
|
Из приведенных электролитов выберите самый слабый
|
Ионное произведение воды равно КH2O = 1.10-14
|
Индикаторы – это органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно-основные (напр., фенолфталеин, лакмус),окислительно-восстановительные (напр., метиленовый синий) и др.
|
Фенолфталеин в щелочной среде имеет цвет малиновый (рубиново-красный, пурпурный)
|
Окраска лакмуса в щелочной среде синяя
|
Значение рН щелочного раствора рассчитывают по формуле рН=14+lg[OH-]
|
рН в 0,0001 N растворе гидроксида калия равен: 4
|
Среда водного раствора, водородный показатель
которого рН = 13,0 сильнощелочная
|
Диссоциация ортофосфорной кислоты по второй ступени описывается уравнениемH2PO4-H+ + HPO4-
|
В растворе хлорида цинка среда кислая
|
Электролиз - это физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
|
Коррозия - это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой
|
Восстановителем является
|
Марганец восстанавливается по схеме Mn+7+5e=Mn+2 в кислой
|
Укажите, какие из приведенных процессов представляют собой окисление
|
В нейтральной среде взаимодействие KMnO4 с Na2SO3 приводит к образованию: 3Na2SO3 + H2O + 2KMnO4 = 3Na2SO4 + 2MnO2↓ + 2KOH(оксид марганца)
|
Из KMnO4 в результате реакции KMnO4+FeSO4+H2SO4 образуется следующее вещество MnSO4+Fe2(SO4)3
|
В результате реакции K2Cr2O7+Na2SO3+H2SO4 образуется следующее вещество 3Na2SO3 + 4H2SO4 + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + K2SO4+ 4H2O(сульфат хрома (III))
|
В результате реакции Cu+HNO3(k) образуется следующее вещество(нитрат меди или оксид азота (IV ))
|
Наиболее характерные степени окисления для железа +3
|
Уравнение Нернста для электродов I рода
|
Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl)
|
Малахит - это CuCO3·Cu(ОН)2
|
Горная порода доломит, химический состав которого соответствует формуле
CaMg(CO3)2, относится к классу: карбонаты
|
Гидроксосульфат свинца – это (PbOH)2SO4
|
Сульфидом Na является соединение Na2S
|
Перманганатом калия является соединение KMnO4
|
Цианидом калия является соединение KCN
|
Ангидридом какой кислоты является Cl2O7 ? дихромовой
|
Карбонатом Mg является MgCO3
|
Из перечисленных соединений кристаллогидратом является
|
Эквивалентная масса едкого натра равна 40
|
Кислотным оксидом является
|
Из перечисленных соединений к кислотам относятся
|
Из перечисленных соединений к солям относятся
|
Гидроксохлорид меди (II) – это CuOHCl
|
Эквивалентная масса кислоты зависит от числа атомов водорода
|
Эквивалентная масса водорода (г/моль) 1
|
Амфотерным не является оксид
|
Жесткость воды обусловлена наличием солей Сa, Mg
|
Параметр, характеризующий собственный магнитный момент электрона спиновое число
|
Формулировка «электрон может вращаться вокруг ядра только по определенным орбитам» относится к
|
Какая из перечисленных электронных конфигураций возможна?
|
Среди перечисленных реакцией гидролиза
является
|
Кислую реакцию имеет раствор
|
В присутствии основания лакмус становится синим
|
Щелочную реакцию имеет раствор
|
Среди перечисленных реакцией нейтрализации является
|
Окислительно-восстановительной реакцией является
|
Cо щелочами реагирует оксид
|
При взаимодействии Са + Н2О→ образуется Ca + 2H2O = Ca(OH)2↓ + H2↑
|
Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl)
|
Формулировка «энтропия идеального кристалла чистого вещества при 0 К равна нулю» относится к постулату Планка
|
Энергия Гиббса – это термодинамический потенциал в необратимых процессах
|
Изобарическим называется процесс, протекающий в
системе при постоянном давлении
|
Размерность энтропии Дж/(моль*К)
|
Неэлектролитами являются
|
Нормальная концентрация есть отношение
количества эквивалентов растворенного вещества к объему раствора
|
Раствор содержит 10 г Na2SO3 и 90 г воды.
Какова процентная концентрация раствора? 10%
|
Элемент, имеющий степень окисления, равной -2:
|
Один из продуктов реакции FeCl3+KJ= KCl+FeI3
|
Ионное произведение чистой воды при 250 С равно 10-14
|
Эквивалентный объем кислорода составляет 11.2
|
При взаимодействии оксида кальция с водой образуется Ca(OH)2
|
К группе галогенов относится I, Br, Cl, F, At
|
Какой из указанных гидроксидов может образовать основную соль
|
Какая из данных кислот может образовать кислую соль
|
Ангидридом какой кислоты является Cr2O5 дихромовой
|
Сильной кислотой является
|
Хлорат кальция есть следующая соль Ca(ClO4)2
|
Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl)
|
В теории Бора электрон может вращаться вокруг ядра только по устойчивым, или стационарным, орбитам
|
Побочное (орбитальное) число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1.
|
Главное квантовое число определяет номер энергетического уровня
|
Главное квантовое число может принимать значения [1;+∞)
|
Правило Хунда гласит: в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
|
Магнитное квантовое число
характеризует
|
Спиновое квантовое число определяет величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т. е. еёсобств. (внутр.) момента кол-ва движения (момента импульса).
|
К p-элементам относятся
|
Спиновое квантовое число может принимать значения +1/2; -1/2
|
Cтепень окисления хрома в бихромате аммония равна +6
|
Максимальная степень окисления марганца равна +7
|
Химическая кинетика – это наука которая изучает скорость химической реакции
|
Константа скорости химической реакции зависит оттемпературы
|
По правилу Вант-Гоффа при повышении температуры
на 100 скорость реакции увеличивается в 2 раза
|
константой скорости
|
В молекуле Н2 связь: ковалнтная
|
Для реакции: aA+bBcC+dD
закон действующих масс выражается уравнением:v = k[A]a[B]b
|
Принцип Ле Шателье заключается в следующем: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие в системе сместится в сторону препятствующею этом воздействию
|
В молекуле хлорида калия связь
|
Для реакции: CaCO3 = CaO + CO2 при
понижении давления равновесие сместится в сторону: вправо
|
Константа ионизации воды равна: 10-14
|
Электролиз - это физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
|
Чему равен заряд комплексного
иона в соединении – гексацианоферрат калия (III)? +3
|
Процентная концентрация
нитрата натрия в растворе, содержащем 25 г нитрата
натрия и 75 г воды: 25%
|
В растворе содержится 1 кг воды и 56 г KOH. Моляльная
концентрация раствора равна 1 моль/кг
|
Присутствие сульфатов в водном растворе можно
определить по образованию белого осадка в присутствии Ba2+, Ca2+
|
Для слабых бинарных электролитов выражение
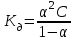 носит название константа диссоциации носит название константа диссоциации
|
В присутствии кислоты лакмус становится красным
|
Сильную кислоту можно отличить от слабой по: константе диссоциации большей 1×10−3
|
Аммиаком является NH3
|
Степень окисления S в ряду соединений H2S, S, SO2, H2SO4
равна-2, 0, +4, +6
|
Из перечисленных соединений к оксидам относятся
|
Главное квантовое число определяет номер энергетического уровня
|
Магнитное квантовое число характеризует ориентацию в пространстве орбитального момента количества движения электрона или пространственное расположение атомной орбитали
|
Спиновое квантовое число определяет величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т. е. еёсобств. (внутр.) момента кол-ва движения (момента импульса).
|
Принцип Паули: на одной орбитали не может быть больше двух электронов
|
Какая из перечисленных электронных конфигураций
возможна?
|
В молекуле Н2 связь ковалентная
|
Гидролизом называется процесс присоединения молекулы воды
|
Соль,
гидролизующаяся только по аниону (образована слабой кислотой)
|
В присутствии
кислоты лакмус становится красным
|
Термодинамика - это наука, изучающая превращение одних видов энергии в другие
|
Тепловой эффект реакции больше 0,
реакция называется: эндотермической
|
Изохорическим
называется процесс, протекающий в
системе при
постоянном объёме
|
Химический процесс называют
эндотермическим, если он протекает с поглощением теплоты
|
Закон Гесса необходим для нахождения теплового эффекта хим. р-ции
|
Стандартная энтальпия (теплота) образования – это теплота, при которой способно образоваться вещество
|
Электролиты - это вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы
|
Слабые электролиты – это, те у которых степень диссоциации меньше единицы
|
Растворами называются
|
Криоскопическая константа необходима для расчета температуры замерзания
|
Размерность нормальной
концентрации г экв/л
|
Размерность молярной
концентрации моль/л
|
Размерность моляльной
концентрации моль/кг
|
Размерность мольной доли
Растворенного вещества нет (моль %)
|
20% раствор Na2SO4 содержит
|
2 М раствор H2SO4
содержит (объём 1 л) 2*1=2 моль
|
1 N раствор H2SO4
содержит (объём 1 л) 2*1*1=2 моль
|
Какая масса ( г ) LiBr содержится в
2 л 1 N раствора? 2*1*(7+80)=174 г
|
Объемы растворов реагирующих веществ
|
На нейтрализацию 50 мл 0,2 N раствора
HCl потребовалось 10 мл раствора NaOH. Какова CN NaOH?
50*0,2/10=1 N
|
Данные соединения не могут находиться
совместно в растворе
|
Химическая
кинетика – это наука которая изучает скорость химической реакции
|
Для реакции
aA+bBcC+dD закон действующих масс выражается
уравнением: v = k[A]a[B]b
|
Окислителями называются вещества, в состав которых входят атомы, присоединяющие во время химической реакции электроны
|
Восстановителем является вещество, отдающее электроны в ходе ОВР
|
Один из продуктов
реакции: KMnO4+FeSO4 +H2O=
|
Максимальная степень окисления селена +6
|
Ионное произведение воды КH2O = 1.10-14
|
|
|
|
 Скачать 0.54 Mb.
Скачать 0.54 Mb.