Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
pH=-lg[H+] | | ||||
| | Гидролиз – это химическое взаимодействие с водой: солей образованных (или) слабым основанием и (или) слабой кислотой | | |||
| | Буферный раствор образуется при реакции: | | |||
| | Растворимость соли всегда возрастает понижении концентрации в растворе одного из его ионов | | |||
| | Раствор отличается от механической смеси своей однородностью и возрастанием энтропии системы при смешении компонентов | | |||
| | Массовая доля это отношение массы i-го компонента к массе смеси, выраженное в процентах | | |||
| | Если в 2 кг раствора содержится 100 г серной кислоты, то массовая доля кислоты в растворе равна 5% | | |||
| | Если в 2 литрах раствора содержится 0,8 г NaOH, то молярная концентрация раствора равна 0,01 м | | |||
| | В уравнении осмотического давления СМ – это молярная концентрация | | |||
| | Фенолфталеин в щелочной среде имеет цвет малиновый (рубиново-красный, пурпурный) | | |||
| | Реакции Al(OH)3+3HCl→AlCl3+3H2O отвечает следующее ионное уравнение Al(OH)3 + 3H+ = Al3+ + 3H2O | | |||
| | Сильную кислоту можно отличить от слабой по: константе диссоциации большей 1×10−3 | | |||
| | В растворе какой соли рН будет меньше 7? кислой | | |||
| | Буферные растворы не используют | | |||
| | Произведение растворимости это произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении | | |||
| | В растворе содержится 1,6 кг воды и 400 г NaOH. Процентная концентрация раствора равна 20% | | |||
| | Растворитель – это компонент раствора агрегатное состояние которого не изменилось при образовании раствора | | |||
| | Молярная доля это концентрация, выраженная отношением числа молей вещества к общему числу молей всех веществ, имеющихся в растворе | | |||
| | Выбрать способ расчета рН раствора серной кислоты pH=-lg[H+] | | |||
| | Сильным основанием является | | |||
| | рН раствора (NH4)2SO4 рассчитывается следующим образом:pH=-lg[H+] | | |||
| | Растворимость BaSO4 можно понизить за счет: добавления одноименных ионов | | |||
| | Произведение растворимости гидроксида алюминия выражается формулойK = [Al3+][OH-]3 | | |||
| | Гидролиз нитрата аммония описывается уравнением NH4NO3 + H2O HNO3 + NH4OH | | |||
| | В окислительно-восстановительных реакциях K2Cr2O7 является: окислителем | | |||
| | На рисунке Е – это: энергия активации 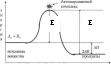 | | |||
| | Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 200,если температурный коэффициент равен 2?V2 = V1*220 = 1048576V1; в 1048576 раз | | |||
| | Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 100,если температурный коэффициент равен 2? 210 = 1024; в 1024 раза | | |||
| | Для реакции: Ba(NO3)2 + H2SO4 BaSO4 + 2HNO3 константа равновесия равна Kc = 0 | | |||
| | Скорость реакции пропорциональна произведению концентраций реагентов в степенях, равных их стехеометрическим коэффициентам | | |||
| | Согласно правилу Вант-Гоффа, при повышении температуры на 100 скорость химической реакции: возрастает в 2-4 раза | | |||
| | Константа равновесия зависит | | |||
| | Для реакции: СаСО3 СаО + СО2 при понижении давления равновесие сместится в сторону образования продуктов | | |||
| | Для реакции (считая ее элементарной) H2+I2=2HI скорость прямого процесса определяется уравнением: 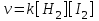 | | |||
| | Действие катализатора основано на: том, что они уменьшают энергию активации реакции | | |||
| | Малахит – это CuCO3·Cu(ОН)2 | | |||
| | Горная порода доломит, химический состав которого соответствует формуле CaMg(CO3)2, относится к классу: карбонаты | | |||
| | Негашеная известь – это СaO | | |||
| | Гидроксофосфат бария – это Ва2(ОН)РО4 | | |||
| | Кислой солью является | | |||
| | Дисперсную систему жидкость – жидкость называют: эмульсией | | |||
| | Константа равновесия равнаKc = [C]c[D]d/[A]a[B]b | | |||
| | Константа скорости реакции зависит от температуры и не зависит от pH среды | | |||
| | Тепловой эффект изобарного процесса равен: 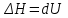 | | |||
| | Первый закон термодинамики выражается формулой:  | | |||
| | Энтропия возрастает при: увеличении температуры | | |||
| | В изобарно-изотермических условиях реакции протекают самопроизвольно в направлении: продуктов реакции | | |||
| | Равновесие устанавливается в процессах релаксационных | | |||
| | Для реакции: Na2CO3 + H2O NaHCO3 + NaOH константа равновесия равна K=[ HCO3-][ OH-]/[ CO32-] | | |||
| | Для реакции: 3Н2 (г) + N2 (г) = 2NH3 (г) увеличение давления приведет к смещению равновесия в сторону: вправо | | |||
| | Кинетическое уравнение химической реакции записывается в следующем виде: v = k[A]a[B]b[C]c | | |||
| | Для реакции aA+bBcC+dD закон действующих масс выражается уравнением:v = k[A]a[B]b | | |||
| | Уравнение Аррениуса имеет вид: k = k0е(-Е/RT) | | |||
| | Для реакции (считая ее элементарной) H2+I2=2HI скорость обратного процесса определяется уравнением: 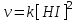 | | |||
| | Как изменится скорость реакции CO(Г)+Н2О(Г)→СО2(Г)+Н2(Г) при увеличении концентрации Н2О в 5 раз? увеличится в 5 раз | | |||
| | Согласно правилу Вант-Гоффа, при повышении температуры на 100 скорость химической реакции: возрастает в 2-4 раза | | |||
| | Действие катализатора заключается в: том, что они уменьшают энергию активации реакции | | |||
| | Коррозия - это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой | | |||
| | На рисунке Е – это: энергия активации 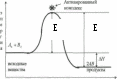 | | |||
| | Присутствием каких ионов обусловлена жесткость воды? Са2+ и Mg2+ | | |||
| | Морская вода - это вода морей и океанов. В среднем солёность Мирового океана составляет около 34,72‰, с колебаниями от 34 до 36 %. Это значит, что в каждом литре морской воды растворено 35 граммов солей (в основном это хлорид натрия) | | |||
| | Двуокись кремния – это SiO2 | | |||
| | Сусальное золото - это химические соединения наподобие сульфида олова (SnS2), который применяется в составе красок, имитирующих позолоту | | |||
| | Малахит - это CuCO3·Cu(ОН)2 | | |||
| | Царская водка - это смесь одного объема азотной кислоты (HNO3) и трёх объёмов соляной кислоты (HCl) | | |||
| | Сульфатом натрия является соединение Na2SO4 | | |||
| | Хлоридом калия является соединение CaCl2 | | |||
| | В атомах какого элемента заполняется подуровень 2р | | |||
| | Строению атома какого элемента отвечает электронная конфигурация 1s22s22p63s23p64s1 K | | |||
| | Какое число электронов находится на подуровне 3d у атома V 3 | | |||
| | Нашатырный спирт – это водный раствор аммиака | | |||
| | Карбонатом калия является K2CO3 | | |||
| | Из перечисленных соединений аммиачным комплексом является | | |||
| | Эквивалентная масса ортофосфата калия равна (г/моль) 70,7 | | |||
| | Ионом аммония является NH4+ | | |||
| | Степень окисления S в ряду соединений H2S, S, SO2, H2SO4 равна -2, 0, +4, +6 | | |||
| | Степень окисления N в ряду соединений N2O, NO, NO2, HNO3 равна +1, +2, +4,+5 | | |||
| | Из перечисленных соединений к кислотам относятся | | |||
| | Метаалюминат кальция - это Ca(AlO2)2 | | |||
| | Из перечисленных соединений к солям относятся | | |||
| | Гидросульфит калия – это KHSO3 | | |||
| | Дихроматом калия является K2Cr2O7 | | |||
| | Основной солью является | | |||
| | Эквивалент химического элемента зависит от валентности (степени окисления) | | |||
| | Эквивалентная масса кислорода (г/моль) 16 | | |||
| | Эквивалентный объем Cl2 составляет (л/моль) 11,2 | | |||
| | Главное квантовое число определяет номер энергетического уровня | | |||
| | Магнитное квантовое число характеризует ориентацию в пространстве орбитального момента количества движения электрона или пространственное расположение атомной орбитали. | | |||
| | Спиновое квантовое число определяет величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т. е. еёсобств. (внутр.) момента кол-ва движения (момента импульса). | | |||
| | Основное следствие запрета Паули Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. | | |||
| | Формулировка «электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным)» относится к | | |||
| | Заполнение электронных оболочек атомов происходит таким образом, чтобы суммарный спин был максимальным – это относится к Правило Хунда | | |||
| | Какая из перечисленных электронных конфигураций возможна? | | |||
| | В молекуле Н2 связь ковалентная | | |||
| | В молекуле хлорида натрия связь ионная | | |||
| | Гидролизом называется присоединение воды | | |||
| | Соль, не подвергающаяся гидролизу | | |||
| | Что является одним из продуктов гидролиза карбоната калия? KHCO3 + KOH | | |||
| | В присутствии основания фенолфталеин становится малиновый (рубиново-красный, пурпурный) | | |||
| | Гидролиз усиливается от совместного присутствия следующих соединений | | |||
| | В присутствии основания лакмус становится синим | | |||
| | В присутствии кислоты фенолфталеин становится бесцветен | | |||
| | Термодинамика - это наука, изучающая превращение одних видов энергии в другие | | |||
| | Под первым началом термодинамики понимают Закон сохранения энергии для тепловых процессов | | |||
| | Под вторым началом термодинамики понимают объединенный принцип существования и возрастания энтропии | | |||
| | Под третьим началом термодинамики (постулатом Планка) понимают следующую формулировку: энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю: S0 = 0. | | |||
| | Изохорическим называется процесс, протекающий в системе при постоянном объёме | | |||
| | Закон Гесса необходим для нахождения теплового эффекта хим. р-ции | | |||
| | Энтальпия (теплота) образования - это количество энергии, которое выделяется или поглощается при образовании сложного вещества из простых веществ. | | |||
| | Энтропия измеряется в Дж/моль*К | | |||
| | Электролиты - это вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы | | |||
| | Слабые электролиты – это те у которых степень диссоциации меньше единицы | | |||
| | Эбуллиоскопическая константа необходима при расчете температуры кипения | | |||
| | Криоскопическая константа необходима для расчета температуры замерзания | | |||
| | Процесс осмоса характеризуется односторонней диффузией растворителя | | |||
| | 20% раствор Na2SO4 содержит | | |||
| | 1 N раствор H2SO4 содержит (объём 1 л) 2 моль | | |||
| | Раствор HCl c моляльной концентрацией (Cm ), равной 1, содержит 1 моль | | |||
| | На нейтрализацию 50 мл 0,2 N раствора HCl потребовалось 10 мл раствора NaOH. Какова CN NaOH? 50*0,2/10=1 N | | |||
| | Данные соединения не могут находиться совместно в растворе | | |||
| | Химическая кинетика – это наука которая изучает скорость химической реакции | | |||
| | Для реакции aA+bBcC+dD закон действующих масс выражается уравнением:v = k[A]a[B]b | | |||
| | Окислителями называются вещества, в состав которых входят атомы, присоединяющие во время химической реакции электроны | | |||
| | Элемент, имеющий в соединениях степень окисления, равную (2-) | | |||
| | Один из продуктов реакции: KMnO4+Na2SO3+H2SO4(р)=MnSO4+K2SO4+Na2SO4 | | |||
| | Один из продуктов реакции: KMnO4+FeSO4+ KOH =K2MnO4+Fe(OH)3 | | |||
| | Ионное произведение воды КH2O = 1.10-14 | | |||
| | Значение рН раствора, содержащего [Н+]=10-7 моль/л 7 | | |||
| | Если рН раствора равен 8.2, то реакция среды щелочная | | |||
| | Чему равен рН 0,001 N раствора NaOH 11 | | |||
| | Реакция среды дистиллированной воды кислая | | |||
| | Электролиз - это физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита. | | |||
| | Медный купорос - это CuSO4 | | |||
| | | Сульфидом Na является соединение Na2SO4 | |||
| Перманганатом калия является соединение KMnO4 | |||||
| Цианидом калия является соединение KCN | |||||
| В атомах какого элемента заполняется подуровень 3d? | |||||
| Строению атома какого элемента отвечает электронная Конфигурация 1s22s22p63s23p64s2 Ca | |||||
| Ангидридом какой кислоты является Cl2O7 ? дихромовой | |||||
| Карбонатом Mg является MgCO3 | |||||
| Из перечисленных соединений Кристаллогидратом является | |||||
| Эквивалентная масса едкого натра равна 40 | |||||
| Эквивалентная масса кислоты зависит от числа атомов водорода | |||||
| Кислотным оксидом является | |||||
| Степень окисления P в ряду соединений P2O5, P, H3PO4 равна +5, 0, +5 | |||||
| Степень окисления Mn в ряду соединений MnCl2, Mn, KMnO4 равна +2, 0,+7 | |||||
| Из перечисленных соединений к основаниям относятся | |||||
| Из перечисленных соединений к солям относятся | |||||
| Манганат натрия –Это K2MnO4 | |||||
| Гидроксохлорид меди (II) - это | |||||
| Кислой солью является | |||||
| Амфотерным не является оксид | |||||
| Жесткость воды обусловлена наличием солей Ca и Mg | |||||
| К группе галогенов относится Cl, I, Br, F, At | |||||
| Параметр, определяющий пространственную ориентацию данной атомной орбитали и отчасти её форму магнитное кв. число | |||||
| Параметр, характеризующий собственный магнитный момент электрона спин | |||||
| Формулировка «электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам» относится к | |||||
| Какая из перечисленных электронных Конфигураций возможна? | |||||
| Сколько электронов в атоме скандия находится на подуровне 4s? 2 | |||||
| Кислую реакцию имеет раствор | |||||
| В присутствии основания лакмус становится синим | |||||
| Щелочную реакцию имеет раствор | |||||
