Закон сохранения массы гласит, что в ходе химической реакции остается постоянной масса (число взаимодействующих атомов)
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
| | Осмос – это проникновение через полупронецаемую перегородку в раствор с большей концентрацией растворенного вещества | | | ||
| | Следующие электролиты при диссоциации в водном растворе образуют ионы водорода: образованные сильной кислотой и слабым основанием | | | ||
| | Равновесие процесса N2 + 3H2 2NH3 при повышении давления сместится в сторону образования NH3 | | | ||
| | Для реакции Zn + 2HCl (г) ZnCl2 + H2 при понижении давления равновесие сместится в сторону в левую сторону | | | ||
| | Раствор отличается от химического соединения что состав раствора может изменяться непрерывно | | | ||
| | Растворитель-это компонент раствора агрегатное состояние которого не изменилось при образовании раствора | | | ||
| | Растворимость хлорида натрия выше в воде, например | | | ||
| | Электролиты – это субстанции, которые распадаются в водных растворах на частицы с электрическим зарядом - ионы | | | ||
| | По величине степени диссоциации электролиты делятся на сильные, средние и слабые | | | ||
| | Сильной кислотой является HNO3, HCl, H2SO4… | | | ||
| | Для слабых бинарных электролитов выражение 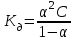 носит название константа диссоциации | | | ||
| | При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна корень из 1,8*10-5 = 0.134 | | | ||
| | Из приведенных электролитов выберите самый слабый | | | ||
| | Слабым основанием является NH4OH, Pb(OH)2… | | | ||
| | Ионное произведение воды равно КH2O = 1.10-14 | | | ||
| | Индикаторы – это органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно-основные (напр., фенолфталеин, лакмус),окислительно-восстановительные (напр., метиленовый синий) и др. | | | ||
| | Фенолфталеин в щелочной среде имеет цвет малиновый (рубиново-красный, пурпурный) | | | ||
| | Лакмус в кислой среде имеет цвет красный | | | ||
| | Окраска лакмуса в щелочной среде синяя | | | ||
| | Значение рН щелочного раствора рассчитывают по формуле рН=14+lg[OH-] | | | ||
| | рН в 0,0001 N растворе гидроксида калия равен: 14-4 = 10 | | | ||
| | Среда водного раствора, водородный показатель которого рН = 13,0 щелочная (сильно) | | | ||
| | Диссоциация ортофосфорной кислоты по второй ступени описывается уравнением H2PO4-H+ + HPO4- | | | ||
| | Реакции Fe(OH)3 + 3HCl FeCl3 + 3H2O отвечает следующее ионное уравнение Fe(OH)3 + 3H+ = Fe3+ + 3H2O | | | ||
| | Реакции Al2(SO4)3 + 3BaCl2 2AlCl3 + 3BaSO4 отвечает следующее ионное уравнение Ba2+ + SO42- = BaSO4 | | |||
| | В растворе хлорида цинка среда кислая | | |||
| | В растворе сульфата калия среда нейтральная | | | ||
| | Электролиз – это совокупность электрохимических окислительно-восстановительных реакций, проходящих при прохождении электрического тока через электролит, с погруженными в него электродами | | | ||
| | Коррозия – это разрушение металлов под действием окружающей среды | | | ||
| | Температура замерзания раствора температура начала кристаллизации твёрдой фазы из раствора | | | ||
| | Изменение температуры кипения раствора рассчитывается по формуле: 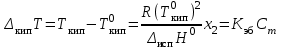 , , | | | ||
| | Окислителями являются вещества, в состав которых входят атомы, присоединяющие во время химической реакции электроны | | | ||
| | Восстановителем является вещество, отдающее электроны в ходе ОВР | | | ||
| | Марганец восстанавливается по схеме Mn+7+5e=Mn+2 в кислой среде | | | ||
| | Укажите, какие из приведенных процессов представляют собой окисление | | | ||
| | В нейтральной среде взаимодействие KMnO4 с Na2SO3 приводит к образованию: 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH(оксид марганца (IV)) | | | ||
| | Из KMnO4 в результате реакции KMnO4+FeSO4+H2SO4 образуется следующее вещество 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O (сульфатмарганца (II)) | | | ||
| | В результате реакции K2Cr2O7+Na2SO3+H2SO4 образуется следующее вещество 3Na2SO3 + 4H2SO4 + K2Cr2O7 = 3Na2SO4 + Cr2(SO4)3 + K2SO4+ 4H2O (сульфатхрома (III)) | | | ||
| | В результате реакции KBr+Cl2 образуется следующее вещество 2KBr + Cl2 = 2KCl + Br2↑ (бром) | | | ||
| | В результате реакции H2SO3+H2S образуется следующее вещество 2H2S + H2SO3 = 3S↓ + 3H2O (сера) | | | ||
| | В результате реакции Cu+HNO3(k) образуется следующее вещество Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O(нитрат меди или оксид азота (IV )) | | | ||
| | В результате реакции KMnO4+Na2SO3+KOH образуется следующее вещество Na2SO3 + 2KOH + 2KMnO4 = Na2SO4 + 2K2MnO4 + H2O (манганаткалия) | | | ||
| | Наиболее характерные степени окисления для железа +2, +3 | | | ||
| | Имеет степени окисления –1, 0, +1, +3, +5, +7 | ||||
