|
Закон сохранения массы гласит, что в ходе химической реакции остается постоянной
масса (число взаимодействующих атомов)
|
|
|
|
В первой половине XVIII века увеличение массы металла после прокаливания на воздухе объясняли
присоединением «огненной материи»
|
|
|
|
Гашеная известь – это Ca(OH)2
|
|
|
|
Эквивалентная масса карбоната натрия в реакции:
Na2CO3 + HCl = NaHCO3 + NaCl равна
106 /(2·1) = 53 г/моль
|
|
|
|
Моль вещества это такое его количество, которое
содержит 6,02·1023 (число Авогадро) частиц этого вещества
|
|
|
|
В каком из этих соединений больше массовая доля водорода
Массовая доля элемента в соединении – отношение массы данного элемента к массе всей порции вещества
|
|
|
|
Максимальная степень окисления железа равна
+6
|
|
|
|
Бор использовал в своей модели атома
квантовые числа
|
|
|
|
Главное квантовое число может принимать значения от 1 до бесконечности
|
|
|
|
Орбитальное квантовое число может принимать значения от 0 до n-1
|
|
|
|
Магнитное квантовое число может принимать значения
-L;…;0;…+L
|
|
|
|
Спиновое квантовое число может принимать значения
+1/2; -1/2
|
|
|
|
Порядок заполнения электронами орбиталей атома определяется принципами
Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей. Принцип Паули - на одной орбитали не может быть больше двух электронов. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
|
|
|
|
I правило Клечковского
Порядок заполнения энергетических уровней определяется возрастанием n+L, а при одинаковом её значении первым заполняется подуровень с меньшим значением n в этой сумме
|
|
|
|
Атом поглощает или излучает энергию при
Атом поглощает энергию при переходе электрона из состояния с низкой энергией в состояние с высокой энергией. Наоборот, атом излучает энергию при переходе электрона из состояния с высокой энергией в состояние с низкой энергией
|
|
|
|
Правило Хунда
В пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары
|
|
|
|
Энергия химической связи тем больше, чем
меньше длина связи
|
|
|
|
Физический смысл орбитального квантового числа
(АО – атомная орбиталь) характеризует форму АО
|
|
|
|
Символы только
d – элементов расположены в ряду
в побочной группе (все металлы)
|
|
|
|
Для какого металла в основном состоянии имеет место «провал» электрона типа:
1e
4s → 3d
Cu (медь)
|
|
|
|
Число неспаренных электронов в атоме золота равно
1 (один)
|
|
|
|
Максимально возможное число электронов на третьем энергетическом уровне
2*n2 = 2*32=18
|
|
|
|
Амминокомплексом является
например, [Cu(NH3)4]SO4, т.е. в комплекс-ионе есть (NH3)n
|
|
|
|
Элементом с конфигурацией внешнего слоя 3d104s1 является
Cu (медь)
|
|
|
|
Невозможна следующая конфигурация в атоме
|
|
|
|
Молекула HF образована следующей химической связью ковалентная полярная
|
|
|
|
Заряд комплексообразователя в комплексной соли K[Fe(H2O)2(SO4)2] равен:
Fe – комплексообразователь, заряд +3
|
|
|
|
Химическая связь в молекуле KCl называется ионная
|
|
|
|
В ряду элементов Li, Be, B, C, N, O, F
электроотрицательность возрастает
|
|
|
|
В атоме серы число неспаренных электронов равно 2
|
|
|
|
Химическая кинетика – это наука
которая изучает скорость химической реакции
|
|
|
|
Кинетическое уравнение химической реакции записывается в следующем виде:
v = k[A]a[B]b[C]c
|
|
|
|
Термодинамика есть наука, изучающая
взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию
|
|
|
|
Закон Гесса необходим для
нахождения теплового эффекта хим. р-ции
|
|
|
|
Размерность энтальпии
Дж/моль
|
|
|
|
При р, Т = const изменение энергии Гиббса вычисляется по формуле:
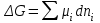
|
|
|
|
С увеличением температуры энтропия: возрастает
|
|
|
|
В результате изотермического процесса вся теплота идёт на совершение работы
|
|
|
|
Пара следующих ионов может находиться совместно в растворе буферные растворы
|
|
|
|
Соль, гидролизующаяся только по катиону
соль, образованная катионом слабого основания и анионом сильной кислоты
|
|
|
|
Соль, гидролизующаяся только по аниону
соль, образованная катионом сильного основания и анионом слабой кислоты
|
|
|
|
Соль, гидролизующаяся по катиону и аниону
соль, образованная катионом слабого основания и анионом слабой кислоты
|
|
|
|
Растворимость – это концентрация насыщенного раствора, показывающая содержание растворяемого вещества в определенном количестве растворителя.
|
|
|
|
Нормальность – это, содержащееся в 1 л раствора количество
грамм-эквивалентов
|
|
|
|
10 мл 0,2 N H2SO4 реагирует с 5 мл гидроксида натрия.
Какова нормальная концентрация щелочи?
(10*0.2)/5 = 0,4 N
|
|
|
|
Моляльная концентрация измеряется в моль р.в./кг р-ля
|
|
|
|
Если смешать 35 г калийной селитры и 65 г воды, какова массовая доля KNO3 в растворе:
KNO3 – калийная селитра, массовая доля 35/(65+35)*100% = 35%
|
|
|
|
Сколько г гидроксида аммония нужно взять, чтобы получить 2 М раствор?
M(NH4OH) = 35г/моль, нужно взять 35*2 = 70г
|
|
|
|
Константа равновесия равна
Kc = [C]c[D]d/[A]a[B]b
|
|
|
|
Константа скорости реакции зависит от
температуры и не зависит от pH среды
|
|
|
 Скачать 0.54 Mb.
Скачать 0.54 Mb.