Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
39. Переваривание белков: протеазы ЖКТ, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз. В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей. Переваривание белков в желудке Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию. Образование и роль соляной кислоты Основная пищеварительная функция желудка заключается в том, что в нём начинается переваривание белка. Существенную роль в этом процессе играет соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов -гастринов (см. раздел 11), которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. НСI образуется в обкладочных клетках желудочных желёз в ходе реакций, представленных на рис. 9-2. Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка из СО2, диффундирующего из крови, и Н2О под действием фермента карбоангидразы (карбонатдегидра-тазы): Н2О + СО2 → Н2СО3 → НСО3- + H+ Диссоциация Н2СО3 приводит к образованию бикарбоната, который с участием специальных белков выделяется в плазму в обмен на С1-, и ионов Н+, которые поступают в просвет желудка путём активного транспорта, катализируемого мембранной Н+/К+-АТФ-азой. При этом концентрация протонов в просвете желудка увеличивается в 106 раз. Ионы С1- поступают в просвет желудка через хлоридный канал. Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Приём белковой пищи часто сопровождается выделением щелочной мочи за счёт секреции большого количества бикарбоната в процессе образования НСl. Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина. Механизм активации пепсина Под действием гастринов в главных клетках желудочных желёз стимулируются синтез и секреция пепсиногена - неактивной формы пепсина. Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (молекулярная масса 32,7 кД) с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. Возрастные особенности переваривания белков в желудке У детей грудного возраста в желудке находится фермент реннин (химозин) , вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина. В слизистой оболочке желудка человека найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника. Трипсин – гидролизуетпептидные связи, образованными карбоксильными группами аргинина и лизина. Химотрипсин – гидролизует пептидные связи, образованные карбоксильными группами ароматических АК Карбоксипептидазы А и В – Отщепляют С-концевые остатки АК. Аминопептидазы – отщепляют N-концевые остатки АК пептидной цепи. Дипептидазы – расщепляют дипептиды на АК. Защита клеток от действия пептидаз: -ферменты образуются в виде неактивных предшественников. -слизистая оболочка покрыта слоем слизи. 40. Всасывание продуктов переваривания. Транспорт АК в клетки кишечника. Особенности транспорта АК в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания АК. Транспорт аминокислот в клетки Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4). Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Nа+-зависимых механизмов симпорта, подобно переносу глюкозы. Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот: -нейтральных, с короткой боковой цепью (аланин, серии, треонин); -нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин); -с катионными радикалами (лизин, аргинин); -с анионными радикалами (глутаминовая и аспарагиновая кислоты); -иминокислот (пролин, оксипролин). 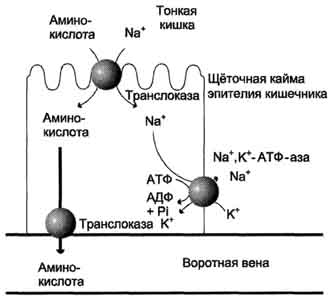 Рис. 9-4. Механизм всасывания аминокислот в кишечнике. L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Nа+,К+-АТФ-азы. Причём к числу Nа+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла (рис. 9-5). В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные - в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связан-ный фермент γ-глутамилтрансфераза.Этот фермент является гликопротеином и катализирует перенос γ-глутамильной группы от глутатиона (иногда другого γ-глутамильного пептида) на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Глутатион представляет собой трипептид - γ-глутамилцистеинилглицин, который находится во всех тканях животных. Реакция протекает следующим образом Аминокислота, связанная с γ-глутамильным остатком, оказывается внутри клетки. В следующей реакции происходит отщепление γ-глутамильного остатка под действием фермента γ- глутамилциклотрансферазы. 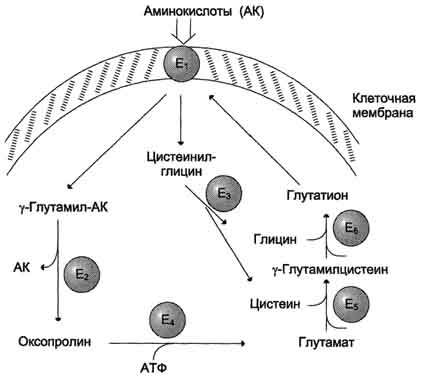 Рис. 9-5.γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием γ-глутамильного цикла затрачиваются 3 молекулы АТФ. Нарушение переваривания белков и транспорта аминокислот Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают. У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции. Очевидно, подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей. 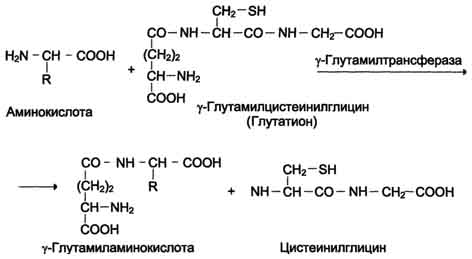 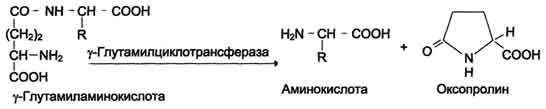 Схема А Схема Б Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии(нетропической спру)происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен. Такие заболевания, как цистинурия,болезнь Хартнапаи некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы (рис. 9-5, реакция 4). При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках. 41. Витамины. Классификация, номенклатура. Провитамины. Гипо, гипер и авитаминозы, причины возникновения. Витаминрезистентные и витаминзависимые состояния. Источники витаминов в детском возрасте. Биохимический механизм развития рахита. Витамины – это низкомолекулярные органические вещества разнообразной химической природы, являющиеся незаменимыми компонентами пищи, но не выполняющие структурные и энергетические функции. Впервые на важную роль этих соединений указал русский ученый Н.И. Лунин. В 1881 г. в опытах на мышах он установил, что искусственно составленная для них диета из белков, жиров, углеводов и минеральных веществ в тех же пропорциях, что и в естественном молоке, приводила мышей к гибели. Он сделал вывод, что в естественных продуктах содержатся какие-то дополнительные вещества, необходимые для нормальной жизнедеятельности. Эти вещества получили название добавочных факторов, позднее – витаминов Классификация и номенклатура витаминов. Провитамины, В основу классификации положен принцип, связанный с физико-химическими свойствами: жирорастворимые: А, Д, Е, К. водорастворимые: С, В1, В2, В6, В12, Вс, Н, РР, Р, В3 . витаминоподобные: полиненасыщенные высшие жирные кислоты, ПАБК, убихинон, холин, инозит и др. Их источники: продукты растительного происхождения продукты животного происхождения микрофлора кишечника. Жирорастворимыми витаминами наиболее богаты продукты животного происхождения. Ряд витаминов вырабатывается микрофлорой тонкого кишечника, например, витамины К, В12, холин. Провитамины – это предшественники витаминов, или неактивные формы витаминов. Известно, что провитамином витамина А являются α-, β-, γ-каротины и под воздействием каротиназы кишечника они активируются и превращаются в витамин А. Эргостерин УФО вит. Д2 7-дегидрохолестерол УФО вит. Д3 2.3. Гиповитаминозы, авитаминозы, гипервитаминозы, причины их возникновения. Гиповитаминозы – состояния, которые возникают вследствие недостаточности содержания какого-либо витамина в организме, при этом отсутствует четкая клиническая картина. Симптомы: слабость, головная боль, быстрая утомляемость, низкая сопротивляемость по отношению к инфекциям. Авитаминозы – заболевания, связанные с отсутствием того или иного витамина в организме. Авитаминозы являются следствием гиповитаминозов и имеют четкую клиническую картину, характерную для данного авитаминоза. Причины возникновения гипо- и авитаминозов делятся на 2 группы: Экзогенные (алиментарная форма), связанная с недостаточным содержанием или отсутствием витаминов в пище в связи:с: - однообразным питанием; -неправильным хранением и кулинарной обработкой продуктов; -спецификой трудовой деятельности; -возрастом; -физиологическим состоянием. Эндогенные (вторичные авитаминозы) связаны с: -частичным разрушением в ЖКТ (низкая секреция НСl) – разрушение витамина РР и других водорастворимых витаминов; -нарушением выработки внутреннего «фактора Касла», обеспечивающего всасывание витамина В12 (злокачественная -анемия); -нарушением всасывания жиров (нарушение функции печени; закупорка желчных протоков), нарушением функций поджелудочной железы; -с назначением сульфаниламидных препаратов; при этом угнетается не только болезнетворная, но и полезная микрофлора (дисбактериоз); -изменением на генетическом уровне – нарушение биосинтеза белков, которые участвуют во всасывании, транспорте витаминов и обрзлвании сложных белков (витаминрезистентные состояния). Гипервитаминозы – заболевания, связанные с избытком какого-либо витамина в организме. Их часто вызывают жирорастворимые витамины, способные накапливаться в организме. В настоящее время наблюдаются редко. Механизм действия жирорастворимых витаминов объясняется тем, что они влияют на генетический аппарат клетки, то есть на биосинтез белков. 2.4. Витамины ''С'', ''А'', ''Д'', ''Е'', ''К''. Химическое строение, явление недостаточности, биологическая роль, суточная потребность. |
