Шпора. Экзамен по химии. 1. Основные понятия в химии вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
                   1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль. 1.Основные понятия в химии: вещество, молекула, атом. Строение атома. Химический элемент. Изотопы. Атомная единица массы. Число Авогадро. Моль.Химия- наука о веществах и их превращениях друг в друга. Вещества- это химически чистые вещества Химически чистое вещество- это совокупность молекул, имеющих одинаковый качественный и количественный состав и одинаковое строение. С2Н6О СН3-О-СН3- СН3-СН2-ОН Молекула - мельчайшие частицы вещества, обладающие всеми его химическими свойствами; молекула состоит из атомов. Атом- это химически неделимые частицы, из-за которых образованы молекулы. ( для благородных газов молекула и атом одно и тоже, Не, Ar) Атом- электронейтральная частица, состоящая из положительно заряженного ядра, вокруг которого по своим строго определенным законам распределены отрицательно заряженные электроны. Причём суммарный заряд электронов равен заряду ядра. Ядро атомов состоит из положительно заряженных протонов (р) и нейтронов (n) не несущих никакого заряда. Общее название нейтронов и протонов – нуклоны. Масса протонов и нейтронов практически одинакова. Электроны (е-) несут отрицательный, заряд равный заряду протона. Масса е- составляет приблизительно 0,05% от массы протона и нейтрона. Таким образом, вся масса атома сосредоточена в его ядре. Число р в атоме, равные заряду ядра , называется порядковым номером (Z), так как атом электронейтрален число е- равно числу р. Массовым числом (А) атома называется сумма протонов и нейтронов в ядре. Соответственно число нейтронов в атоме равно разности между А и Z. (массовым числом атома и порядковым номером).(N=А-Z). 1735Cl р=17, N=18, Z=17. 17р+, 18n0, 17е-. Нуклоны Химические свойства атомов определяется их электронным строением (число электронов), которое равно порядковому номеру атомов (заряду ядра). Следовательно, все атомы с одинаковым зарядом ядра в химическом отношении ведут себя одинаково и рассчитываются как атомы одного и того же химического элемента. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. (110 химических элементов). Атомы, имея одинаковый заряд ядра, могут различаться массовым числом, что связанно с различным числом нейтронов в их ядрах. Атомы, имеющие одинаковый Z, но различное массовое число называются изотопы. 1735Cl 17 37Cl N=18 N=20 Изотопы водорода Н: Обозначение: 11Н 12Д 13Т Название: протий дейтерий тритий Состав ядра: 1р 1р+1n 1р+2n Протий и дейтерий-стабильны Тритий-распадается(радиоактивный) Используется в водородных бомбах. Атомная единица массы. Число Авогадро. Моль. Массы атомов и молекул очень малы (приблизительно 10-28 до 10-24г.), для практического отображения этих масс целесообразно ввести свою единицу измерения, которая бы приводила к удобной и привычной шкале. Т.к масса атома сосредоточена в его ядре, состоящих из практически одинаковых по массе протонов и нейтронов, то логично за единицу массы атомов принять массу одного нуклона. Условились за единицу массы атомов и молекул принять одну двенадцатую изотопа углерода, имеющее симметричное строение ядра (6р+6n). Эту единицу называют атомной единицей массы (а.е.м.), она численно равна массе одного нуклона. В этой шкале массы атомов близки к целочисленным значениям: Не-4; Al-27; Ra-226 а.е.м…… Рассчитаем массу 1 а.е.м в граммах. М(1 а.е.м)= = 1/12 (12С) 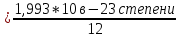 = =1,66*10-24г/а.е.м = =1,66*10-24г/а.е.мРассчитаем, какое количество а.е.м содержится в 1г. 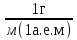 = =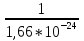 =6,02 * =6,02 *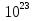 NA= 6,02 * 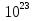 -число Авогадро -число АвогадроПолученное соотношение называется числом Авогадро, показывает сколько а.е.м содержится в 1г. Массы атомов, приведенные в Периодической таблице выражены в а.е.м Молекулярная масса- это масса молекулы, выраженная в а.е.м, находится как сумма масс всех атомов, образующих данную молекулу. м(1 молекулы Н2SO4)= 1*2+32*1+16*4= 98 а.е.м Для перехода от а.е.м к практически используемой в химии 1 г ввели порционный подсчёт количества вещества причём в каждой порции содержится число NA структурных единиц (атомов, молекул, ионов, электронов). В этом случае масса такой порции, называемой 1 моль, выраженной в граммах, численно равна атомной или молекулярной массе, выраженных в а.е.м. Найдём массу 1 моль Н2SO4: М(1 моль Н2SO4)= =98а.е.м*1,66* 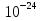 *6,02* *6,02*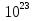 = ==98г 1г Как видно молекулярная и молярная массы численно равны. 1 моль – количество вещества, содержащее число Авогадро структурных единиц (атомов, молекул, ионов). Молекулярная масса(М)- масса 1 моль вещества, выраженная в граммах. Количество вещества-V(моль); масса вещества м(г); молярная масса М(г/моль)-связаны соотношением: V= 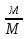 ; ;2Н2О+ О2 2Н2О 2 моль 1 моль 2.Основные законы химии Закон постоянства состава вещества- химически чистое вещество независимо от способа получения всегда имеет постоянный качественный и количественный составы. 2H2+O2=2H2O CH3+2O2=CO2+2H2O NaOH+HCl=NaCl+H2O Вещества с постоянным составом называются- дальтониты. В качестве исключения известны вещества неизменного состава- бертолиты (оксиды, карбиды, нитриды) Закон сохранения массы (Ломоносов)- масса веществ вступивших в реакцию всегда равна массе продуктов реакции. Из этого следует что атомы в ходе реакции не исчезают и не образуются они переходят из одних веществ в другие. На этом основан подбор коэффициентов в уравнении химической реакции, число атомов каждого элемента в левой и правой частях уравнения должно быть равно. Закон эквивалента- в химических реакциях вещества реагируют и образуются в количествах равных эквиваленту (Сколько эквивалента одного вещества израсходовано, ровно столько же эквивалентов израсходовано или образовалось другого вещества). Эквивалент- количество вещества, которое в ходе реакции присоединяет, замещает, высвобождает один моль атомов (ионов) H. Масса эквивалента выраженная в граммах называется эквивалентной массой (Э). Газовые законы Закон Дальтона- общее давление смеси газов равно сумме парциальных давлений всех компонентов газовой смеси. Закон Авогадро- равные объёмы различных газов при одинаковых условиях содержат равное число молекул. Следствие: один моль любого газа при нормальных условиях (t=0 градусов или 273K и P=1 атмосфера или 101255 Паскаль или 760 мм. Рт. Столба.) занимает V=22,4 л. V который занимает один моль газа называется молярным объёмом Vm. Зная объём газа (смеси газа) и Vm при данных условиях, легко рассчитать количество газа (газовой смеси) =V/Vm. Уравнение Менделеева- Клапейрона.- связывает количество газа с условиями, при которых он находится. pV=(m/M)*RT= *RT При использовании данного уравнения все физические величины должны быть выражены в СИ : p-давление газа (паскаль), V-объём газа (литры), m- масса газа (кг.) , М -молярная масса (кг/моль), Т-температура по абсолютной шкале (К), Ню-количество газа (моль), R- газовая постоянная = 8,31 Дж/(моль*К). Д- относительная плотность одного газа по другому- отношение М газа к М газа, выбранного в качестве стандарта, показывает во сколько раз один газ тяжелее другого Д=М1/М2. Способы выражения состава смеси веществ. Массовая доля W- отношение массы вещества к массы всей смеси W=((m в-ва)/(m р-ра))*100% Мольная доля æ -отношение кол-ва в-ва, к общему кол-ву всех вв. в смеси. æ = 1/ Σ Большинство химических элементов в природе представлены в виде смеси различных изотопов; зная изотопный состав химического элемента, выраженный в мольных долях, рассчитывают средневзвешенное значение атомной массы этого элемента, которая и переводится в ИСХЭ. А= Σ (æi*Аi)= æ1*А1+ æ2*А2+…+ æn*Аn , где æi- мольная доля i-ого изотопа , Аi- атомная масса i-ого изотопа. Объёмная доля (φ)- отношение Vi к объёму всей смеси. φi=Vi/VΣ Зная объёмны состав газовой смеси, рассчитывают Мср смеси газов. Мср= Σ (φi*Mi)= φ1*М1+ φ2*М2+…+ φn*Мn 3.Понятие эквивалента вещества. Определение эквивалента. Определение эквивалентной массы кислот, оснований, солей, оксидов, простых веществ в ОВР. Закон эквивалентов. Объемный анализ. Эквивалент- количество вещества, которое входе реакции присоединяет, замещает, выделяет 1 моль (атомов) ионов водорода. В ОВР под эквивалентом понимают такое количество вещества, которое отдает или присоединяет 1 моль элементов. Молярная концентрация(С)-отношение количества растворенного вещества, к общему раствора. С= 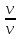 моль/л или М моль/л или МНормальная концентрация( 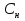 )- отношение числа эквивалента вещества к объему раствора. )- отношение числа эквивалента вещества к объему раствора. 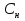 = = экв/л или Н экв/л или НСвязь нормальной и молярной концентрации С= F* 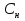 (С (С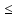 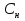 ) )Эквивалентная масса(Э)-масса одного эквивалента вещества, выраженная в граммах. Э гр/экв 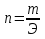 Расчет эквивалентных масс для соединений различных классов. 1 Оксиды- молярную массу вещества делят на число атомов элемента в оксиде, умноженное на его степень окисления. Э(CuO)= 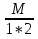 = =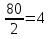 гр/экв (ν= гр/экв (ν=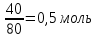 ) )CuO + 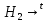 Cu + Cu + 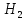 O O2 моль H → 1 моль CuO 1 моль H → 0,5 моль CuO 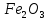 + 3 + 3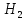 → 2Fe + 3 → 2Fe + 3 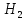 O O = = = =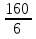 =27 г/экв =27 г/экв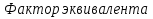 -концентрация, на которую надо умножить массу при расчете эквивалентной массы. -концентрация, на которую надо умножить массу при расчете эквивалентной массы.f ( 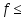  ) f = ) f = 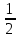 2 Кислоты - молярную массу делят на число атомов водорода, замещенных в молекуле кислоты входе реакции. 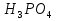 + 3NaOH + 3NaOH 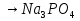 +3 +3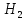 O O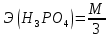 = =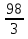 = 33 г/экв f = = 33 г/экв f = 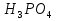 + 2NaOH + 2NaOH 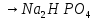 + 2 + 2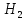 O O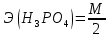 = =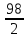 = 49 г/экв f = = 49 г/экв f =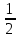 Для одноосновных кислот молярная масса и эквивалент равны . 3 Основания( щелочи ) – молярную массу делят на число гидроксильных групп, замещаемых в молекуле основания входе реакции. 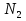 + + 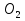 → 2NO → 2NO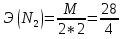 = 7 г/экв f = = 7 г/экв f =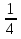 4 Соли- молярную массу делят на число атомов металла ,умноженных на его валентность. Закон эквивалентов- в химических реакциях вещества реагируют и образуются в количествах, равных эквивалентам ( сколько эквивалентов в-ва расходовано, столько же эквивалентов другого в-ва образовалось) Объемный анализ- является одним из методов количественного анализа. Сущность метода заключается в измерении объема раствора реактива известной концентрации, затраченного на реакцию. При анализе раствор реактива, концентрация которого известна, из калиброванного по объему сосуда (бюретки) по каплям приливают к исследуемому раствору до тех пор, пока тем или иным способом не будет установлено, что все вещество в исследуемом растворе прореагировало с добавляемым реактивом. Эта процедура называется титрование 4.Электронное строение атомов. Корпускулярно-волновой дуализм электронов. Атомная орбиталь. Энергетические уровни и подуровни. Квантовые числа, их физический смысл. Электронное строение атома. В атоме, с точки зрения механики, электрон рассматривается одновременно и как частица(имеет массу и заряд) и как волна(явление дифракции)или как говорят, обладает корпускулярно-волновым дуолизмом. Область околоядерного пространства, в котором наиболее вероятно нахождение электрона -атомная орбиталь .В этой области как бы «размазан» заряд электронов. Электроны с приблизительно равной энергией, находящиеся приблизительно на одинаковом расстоянии от ядра, образуют электронный слой(энергетический уровень). В пределах одного энергетического уровня электроны могут незначительно различаться по энергии, располагаясь на различных энергетических подуровнях. Движение электронов в атоме описывается волновым уравнением Шредингера, решение которой- волновая функция пси (Ψ)- может быть отображено набором целых чисел, называемых квантовыми числами. Главное квантовое число (n)-принимает значение натуральных чисел, показывает на каком энергетическом уровне от ядра расположен электрон. Орбитальное(побочное) квантовое число(l)-зависит от n, принимая значения от 0 до n-1 включительно. Показывает на каком энергетическом подуровне находится электрон, определяет форму орбитали электрона. Число значений l для данного n показывает число подуровней на данном энергетическом уровне. Числовым значениям l поставлено в соответствии буквенное обозначение.
Электронное строение атомов всех хим. элементов описывается четырьмя видами орбиталей: s, p, d, f. Электроны, располагающиеся на s подуровне- s электроны, и т. д Магнитное квантовое число 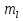 зависит от l, принимает целые значения от –l…., 0….,+l. Определяет взаимную ориентацию орбиталей. Число значений зависит от l, принимает целые значения от –l…., 0….,+l. Определяет взаимную ориентацию орбиталей. Число значений 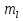 определяет число орбиталей на данном подуровне. определяет число орбиталей на данном подуровне.Для полного описания электрона в атоме потребовалось ввести четвертое квантовое число- Спиновое квантовое число  которое принимает 2 значения ±0,5. В приближенной форме можно сказать, что которое принимает 2 значения ±0,5. В приближенной форме можно сказать, что  отражает возможность вращения электрона вокруг своей оси как по часовой стрелке, так и против нее. отражает возможность вращения электрона вокруг своей оси как по часовой стрелке, так и против нее. |
