ШПОРЫ БХ 2 ИТОГОВАЯ. Эндергонические процессы, протекающие с увеличением свободной энергии. Катаболические превращения
 Скачать 2.83 Mb. Скачать 2.83 Mb.
|
|
Вопрос 1 . Анаболические превращения направлены на образование и обновление структурно-функциональных компонентов клетки, т.е. на синтез сложных биомолекул из более простых. Это восстановительные, эндергонические процессы, протекающие с увеличением свободной энергии. Катаболические превращения направлены на расщепление сложных молекул (как поступивших с пищей, так и уже входящих в состав клеток) до простых компонентов (на конечных стадиях – преимущественно до CO2 и воды). Это окислительные, экзергонические процессы, сопровождающиеся понижением свободной энергии. Анаболические процессы протекают благодаря энергии, заключенной в химических связях молекул специфической группы «высокоэнергетических» соединений (АТФ и др.), в которых аккумулируется энергия, выделяемая в катаболических процессах. В биохимии под "высокоэнергетическими" соединениями понимаются лабильные вещества, гидролиз которых в физиологических условиях сопровождается значительным понижением ∆G. Выигрыш в свободной энергии используется для смещения равновесия в сопряженных термодинамически невыгодных биохимических процессах, например синтеза биополимеров. Так, АТФ является сопрягающим энергетическим звеном обеих сторон метаболизма – анаболизма и катаболизма. Такое энергетическое сопряжение представляет собой основной способ использования энергии в живых организмах. Но не только АТФ, а и другие соединения, образующиеся в результате катаболизма и используемые в анаболических процессах для синтеза специфических биомолекул, выполняют роль субстратов, сопрягающих отдельные метаболические процессы. Такие пути (или циклы) катаболических и анаболических процессов – называют амфиболические. Амфиболические пути придают обмену веществ значительную гибкость и экономичность с точки зрения использования энергии и материальных ресурсов. Билет 2. БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ окислительно-восстановительные реакции, протекающие в организмах; осн. источник их энергии. Сводится к передаче атомов водорода или электронов от одного органич. соединения к другому с помощью ферментов-оксидоредуктаз, в первую очередь дегидрогеназ. При анаэробном Б. о. акцептором водорода являются низкомолекулярные соединения (НАД или НАДФ). При аэробном Б. о, (тканевое дыхание) акцептором водорода в конечном итоге служит кислород; ткани при этом поглощают кислород и выделяют CO2 и Н2О. В результате Б. о. освобождённая энергия накапливается в дыхательной цепи в виде химич. связей макроэргич. соединений и используется организмом для различных физиол. функций. Большое значение для Б. о. имеет ЦТК, в результате к-poro окисляются продукты жирового, углеводного и белкового обменов. Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О. 1.Экспериментально было подтверждено, что процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены. Первый процесс - перенос электронов от восстановленных коферментов NADH и FADH2 через ЦПЭ на кислород - экзергонический. Например: NADH + Н+ +1/2 O2 → NAD+ + H2O + 52 ккал/моль(≈220 кДж/моль). (1) Второй процесс - фосфорилирование АДФ, или синтез АТФ, - эндергонический: АДФ + Н3РО4+7,3 ккал/моль (30,5 кДж/моль) = АТФ + Н2О. (2) Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. 2.субстратное S---OP3H2+АДФ→АТФ+S (ФЕРМЕНТ-КИНАЗА) 3.ФОТОФОСФОРИЛИРОВАНИЕ H2O→NADH+H++O2 (hv-квант света) NADH+H++АДФ+P→АТФ+NAD+ Билет 3. Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. Отношение количества связанного фосфата к количеству поглощенного кислорода (О) называют коэффициентом фосфорилирования и обозначают как Р/О. Как было показано, коэффициент Р/О равен 3. Эта величина отражает теоретически возможный выход АТФ. В действительности часть энергии электрохимического потенциала используется не на синтез АТФ, а на перенос веществ через митохондриальную мембрану при участии ферментов транслоказ. Суммарный результат окисления (НАДН + Н+) и фосфорилирования АДФ в дыхательной цепи можно представить следующим образом: НАДН + Н++ ½О2 → НАД+ + Н2О; 3АДФ + 3Н3РО4 → 3АТФ + 3Н2О. Митохондрии обычно имеют форму цилиндра с закругленными концами, длиной 1–4 мкм и диаметром 0,3–0,7 мкм. Они состоят из внешней и внутренней мембран, которые различаются по составу, свойствам и функциям. Внешняя мембрана легко проницаема для молекул с молекулярной массой до 5 000, в то время как проницаемость внутренней мембраны строго ограничена и избирательна, что определяется наличием специфических транспортных систем. На долю ферментов дыхательной цепи приходится 30–40% всех белков внутренней мембраны. 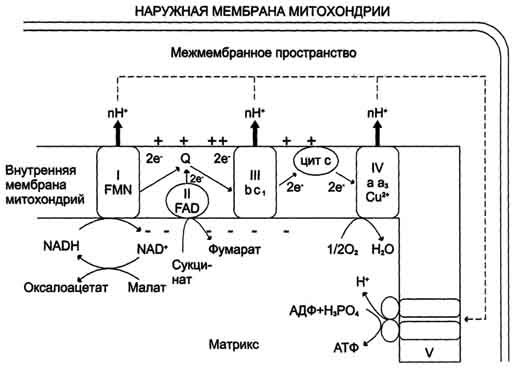 Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинатдегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. Билет 4. Дыхательная цепь — система структурно и функционально связанных трансмембранных белков и переносчиков электронов. Она позволяет запасти энергию, выделяющуюся в ходе окисления НАД∙Н и ФАДН2 молекулярным кислородом (в случае аэробного дыхания) или иными веществами (в случае анаэробного) в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи, сопряжённого с перекачкой протонов через мембрану. Организация дыхательной цепи в митохондриях. Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности. В этой последовательности их стандартные о-в потенциалы становятся более положительными по мере приближения к кислороду. Каждое звено этой цепи специфично в отношении донора и акцептора электронов. На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат а-гидрокси-кислоты малат, изоцитрат, 3-гидроксибутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADH-дегидрогеназой (комплекс I). Если субстратом служат такие соединения, как сукцинат или глицерол-3-фосфат, акцептором водорода служат FAD-зависимые дегидрогеназы. От NADH и FADH2 электроны и протоны передаются на убихинон и далее через цепь цитохромов к молекулярному кислороду. До сих пор точно неизвестно, каким образом расположены все переносчики электронов дыхательной цепи. Однако установлено, что в расположении дыхательных комплексов существует определённая асимметрия: некоторые из белков-переносчиков находятся ближе к той стороне внутренней мембраны, которая обращена к матриксу, а другие - к противоположной; некоторые белки пронизывают мембрану насквозь.
Ингибиторы дыхательной цепи Некоторые вещества блокируют перенос электронов через комплексы I, II, III, IV .
Билет 5. На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат а-гидрокси-кислоты малат, изоцитрат, 3-гидроксибутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADH-дегидрогеназой (комплекс I). Если субстратом служат такие соединения, как сукцинат или глицерол-3-фосфат, акцептором водорода служат FAD-зависимые дегидрогеназы. От NADH и FADH2 электроны и протоны передаются на убихинон и далее через цепь цитохромов к молекулярному кислороду. Никотинамидзависимыедегидрогеназы содержат в качестве коферментов NAD+ или NADP+ . NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид. Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа: R-CHOH-R1+ NAD+↔ R-CO-R1+ NADH + Н+. Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ. Молекулы убихинона различаются длиной углеводородной цепи, обозначается как Q10. В процессе переноса электронов с NADH-дегидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимыхдегидрогеназ, в частности, от сукцинат-дегидрогеназы. Убихинон участвует в реакциях типа: Е (FMNH2) + Q → Е (FMN) + QH2. QН2-дегидрогеназа (коэнзим Q-цитохром С-редуктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QН2-дегидрогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы тема, подобно FeS-центрам, переносят только по одному электрону. Таким образом, от молекулы QH2 2 электрона переносятся на 2 молекулы цитохрома b. В качестве промежуточного продукта в этих реакциях переноса электронов возможно образование свободного радикала се-михинона. В цитохромах типа b гем не связан ковалентно с белком, а в цитохромах с1 и с он присоединяется к белку при помощи тиоэфирных связей). Эти связи образуются путём присоединения 2 цистеиновых остатков к винильным группам гема. Цитохром с - периферический водорастворимый мембранный белок с молекулярной массой 12 500 Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков, и молекулу гема, ковалентно связанную с полипептидом. Билет 6. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаютсяв матрикс через ионные каналы АТФ-синтазы. Строение АТФ-синтазы и синтез АТФ АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1. Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. Комплекс F1 выступает в митоховдриальный матрикс. Он состоит из 9 субъединиц (Зα, 3β, γ, ε, δ). Субъединицы аир уложены попарно, образуя "головку"; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0. Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμH+ заставляет протоны двигаться по каналу АТФ-синтазыв матрикс. Параллельно под действием ΔμH+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ. Билет 7. Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Гипоэнергетические состояния Все живые клетки постоянно нуждаются в АТФ. Клетки мозга потребляют АТФ для синтеза нейромедиаторов, в печени происходит синтез гликогена, жиров, белков и др, в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; мышцы потребляют АТФ при нагрузке. Запасов АТФ в клетках практически не существует. для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ. Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Состояния, при которых синтез АТФ снижен, объединяют термином "гипоэнергетические". Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия. Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках. Причинами этих нарушений могут быть:
Примерно 13 из 100 белков, участвующих в окислительномфосфорилировании, кодируются митохондриальной ДНК: 7 субъединиц комплекса I, субъединица комплекса III, 3 субъединицы комплекса IV и 2 субъединицы комплекса V, а также необходимые компоненты их трансляции. Остальные митохондриальные белки синтезируются в ядре. Ядерная ДНК кодирует более 70 субъединиц белков, участвующих в окислительном фосфорилировании. Нарушения окислительного фосфорилирования в основном связаны с мутациями в митохондриальной ДНК, которые случаются примерно в 10 раз чаще, чем в ядерной. Ткани с высокой потребностью в АТФ (ЦНС, скелетные мышцы, миокард, почки и печень) наиболее чувствительны к нарушениям окислительного фосфорилирования. Дефекты митохондриальной ДНК наследуются по материнской линии, так как митохондрии из клеток сперматозоидов не проникают в оплодотворённую яйцеклетку. Мутации митохондриальной ДНК - частая причина, так как митохондрии не имеют такой же эффективной системы репарации ДНК, как ядро. Даже у здоровых индивидуумов соматические мутации снижают с возрастом возможности окислительного фосфорилирования. В этих случаях способность к синтезу АТФ ниже тканеспецифического уровня нормальных клеток. Билет 8. Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану вматрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт (или метаболиты, которые образуются в организме, билирубин , тироксин. Все эти вещества проявляют разобщающее действие только при их высокой концентрации. |
