Строение атома. Периодический закон. Iv строение атома и периодическая система элементов логическая схема главы 154 155
 Скачать 1.71 Mb. Скачать 1.71 Mb.
|
|
Глава IV СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Логическая схема главы 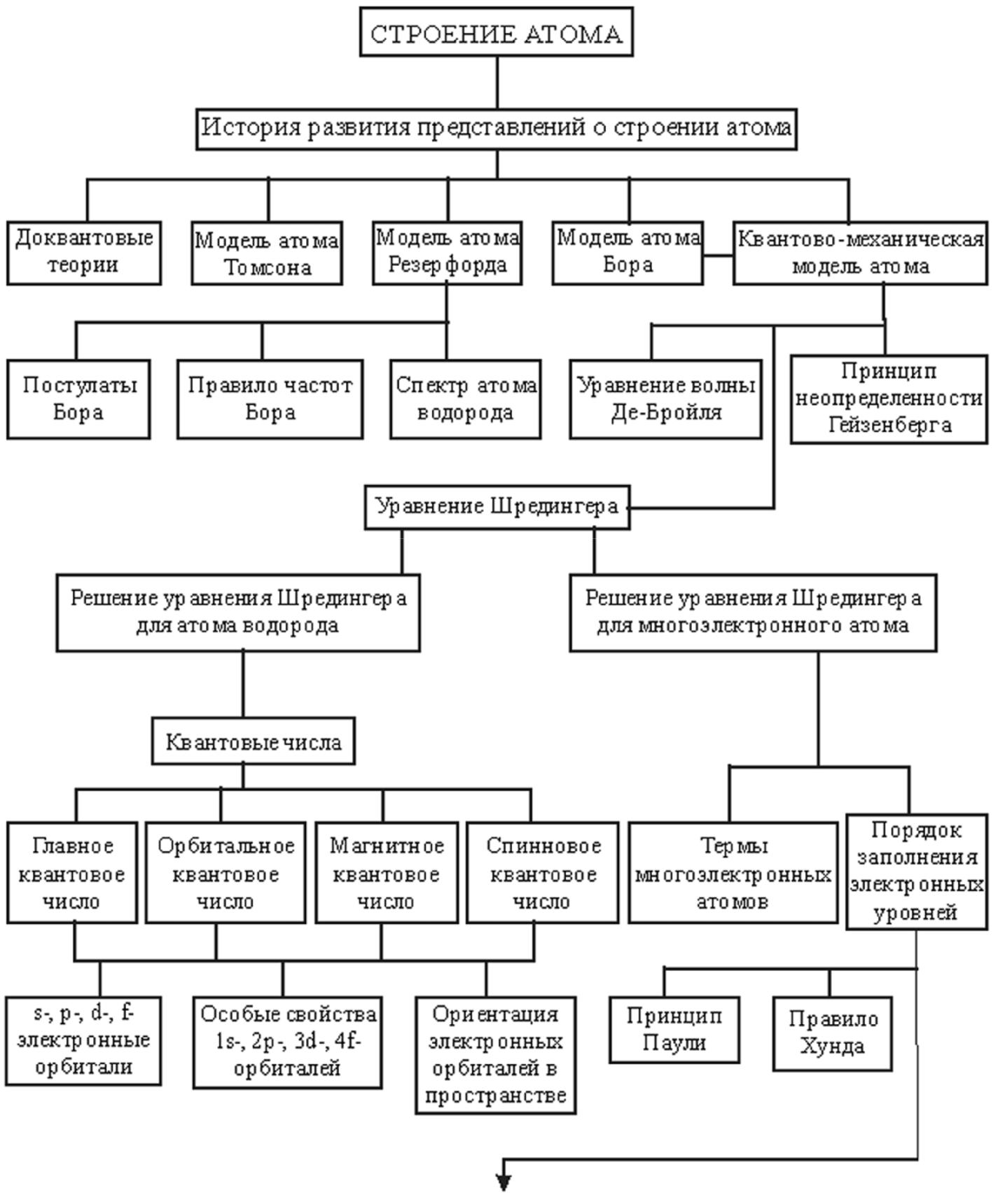 154 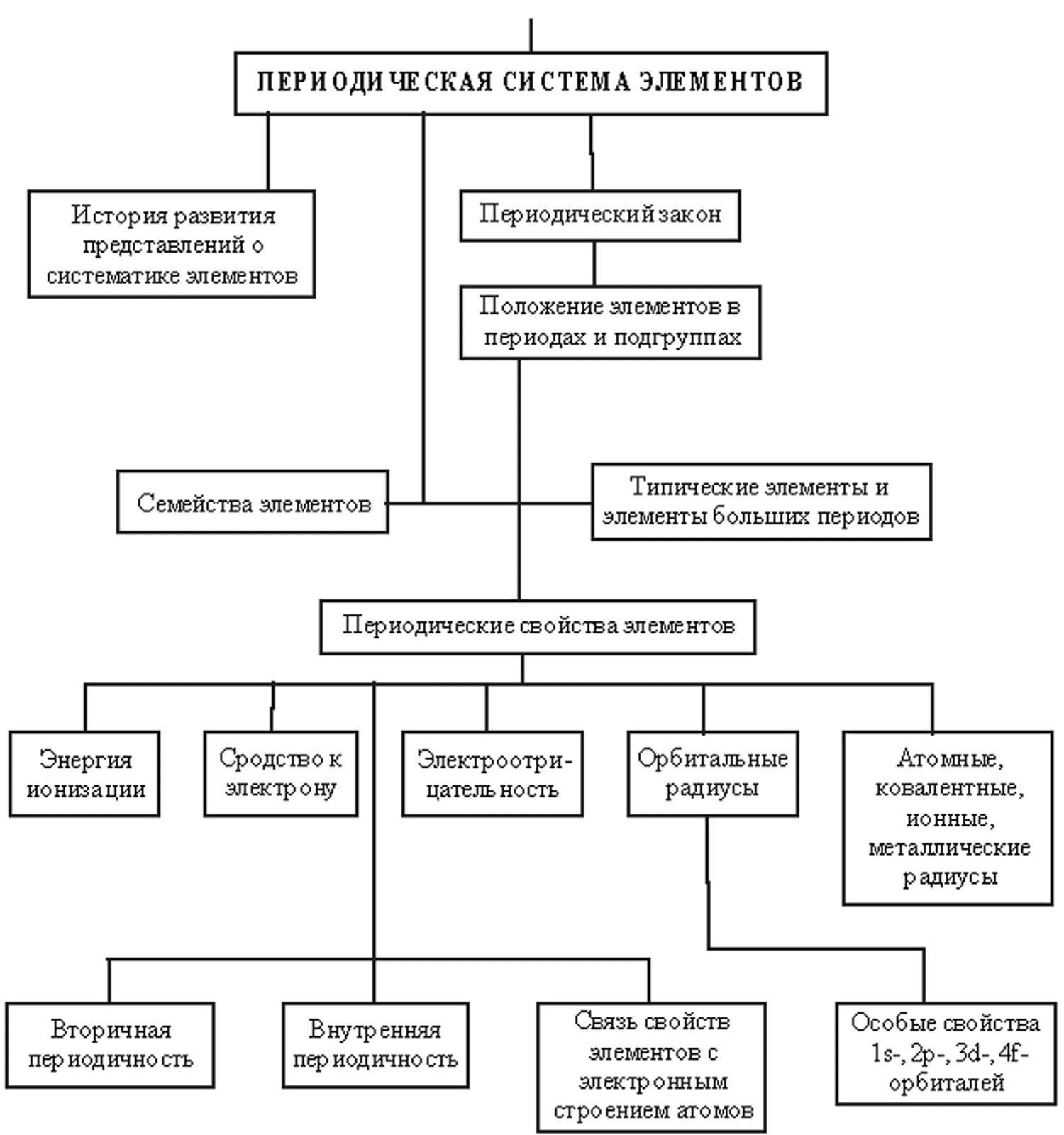 155 Строение атома Атом представляет собой очень сложную систему, состоящую из ядра и электронной оболочки. Ядро составляют нейтроны и протоны. В химии не изучают ядра атомов, но, тем не менее, ниже мы рассмотрим некоторые характеристики ядер. Ядра атомов – предмет изучения ядер-ной физики. Мы же будем рассматривать ядро как единое целое, а атом как частицу, состоящую из ядра и электронной оболочки. Мысль о существовании элементарного электрического заряда воз-никла еще в XVIII в. В работах Б. Франклина, В. Вебера, Г. Деви и дру-гих. можно найти указание на существование "электрического атома". Очень важными для подтверждения существования электрического за-ряда явились законы электролиза, открытые М. Фарадеем в 1830 г. Ана-лиз этих законов привел Г. Гельмгольца к идее элементарного электри-ческого заряда. Гельмгольц писал: "Если мы допускаем существование химических атомов, то мы вынуждены заключить отсюда, что и элек-тричество разделяется на определённые элементарные количества, ко-торые играют роль атомов электричества". Термин "электрон" предло-жен английским физиком Дж. Стони. Он писал: "В каждом химическом атоме может быть несколько элементарных зарядов. Эти заряды, кото-рые удобно назвать "электронами", не могут быть отделены от атомов, но они обнаруживаются, когда атомы вступают в химическое соедине-ние".
Вопрос о том, как располагаются ядро и электроны в атоме и како-во строение ядра волновали умы многих ученых. Но только в начале XX в. появились различные модели, изображающие строение атома, кото-рые каким-то образом объясняли свойства атомов. В 1904 г. Томсоном была предложена модель, согласно которой электроны располагались в атоме как изюм в булке. Взаимное отталкивание электронов обеспечи-вало их равномерное распределение в атоме. Таким образом достигался контакт между положительными и отрицательными зарядами. Иониза-цию можно было представить как вырывание электрона из атома, в ре-зультате чего оставался твердый массивный атом с положительным за-рядом. Теорию Томсона сменила планетарная модель атома Резерфорда (1911). Согласно этой теории в центре атома располагалось тяжёлое массивное ядро, вокруг которого, как планеты вокруг Солнца, враща-лись электроны. Но эта модель просуществовала недолго и имела ряд 156 очень существенных недостатков: модель не объясняла, во-первых, по-чему электроны при движении по орбите не теряли энергию и не падали на ядро; во-вторых, не объясняла дискретного спектра излучения ато-мов. Резерфорд отлично видел недостатки своей модели атома. Он пре-дупреждал, что «вопрос об устойчивости предлагаемого атома на этой стадии не следует подвергать рассмотрению. Устойчивость окажется, очевидно, зависящей от тонких деталей структуры атома и движения составляющих его заряженных частей».
1. Электрон вращается вокруг ядра, не излучая энергии, по строго определенным стационарным орбитам. Движение какого-либо объекта вокруг центра в классической меха-нике определяется моментом количества движения mvr. Согласно кван-товой механике, энергия такого объекта может иметь только определен-ные значения и изменяться скачками. Бор считал, что момент количества электрона должен квантоваться, т. е. должен быть равен це-лому числу квантов действия:
где n = 1,2,3...; h – постоянная Планка; h = 6,625 ⋅ 10-27 эрг ⋅ с = 6,62 ⋅ 10-34 Дж ⋅ с. Из (1) следует, что минимальная энергия электрона соответствует n
157 При вращении электрона вокруг ядра центробежная и центростре-мительная силы уравновешены и
Уравнение 7 называют правилом частот Бора. Энергию электрона в n-стационарном состоянии можно рассчитать
где ћ = h/2π . Для атома водорода при z = 1 и n = 1 Е = 13.6 эВ. Из уравнений (7) и (8) можно получить уравнение для расчета спектральных линий:
158
где (me4)/(4π ћ3) = R – постоянная Ридберга для описания линий спектра атома водорода в видимой области (серия Бальмера). Константа Ридбер-га входит в формулу Бальмера для расчёта спектральных линий в види-мой части спектра атома водорода:
где ν – частота излучения; с – скорость света, n и k – целые числа: n = 2, k = 3,4,5,6 ...; R – константа Ридберга (R = 109977,575 см-1). Рассчитанная из уравнения (9) постоянная Ридберга дает хорошее совпадение с экспериментальной величиной. Полная энергия электрона складывается из кинетической и потен-циальной E =(mv2)/2 – e2/r = (mv2)/2 – mv2= – (mv2)/2, Отсюда видно, что полная энергия электрона равна его кинетической энергии, взятой с обратным знаком. Бор рассчитал спектр атома водорода, который образуется при пе-реходе электронов между уровнями. Переходу на уровень с n = 1 соот-ветствует серия спектральных линий, называемая серией Лаймона:
Переходу на уровень с n = 2 соответствует серия спектральных ли-ний Бальмера:
Переходам на уровень с n = 3 соответствует серия Пашена:
Серии Бреккета соответствуют переходы на уровень n = 4:
159 Серия спектральных линий, соответствующая переходам на уровень со значением квантового числа n = 5, была предсказана Бором и открыта в 1924 г. Пфундом:
Полученные расчетные данные совпали с известными эксперимен-тальными. Таким образом, модель атома Бора объяснила спектр атома водорода. Достоинства модели Бора Модель Бора имела следующие достоинства:
Но у модели Бора было несколько существенных недостатков:
160 слова sharp (резкий), символ р – от слова principal (главный), d – от слова diffuse (диффузный), f – от fundamental (фундаментальный);
Модель Бора в 1916-1924 гг. развил Зоммерфельд, который пока-зал, что тонкую структуру атома можно объяснить, если допустить су-ществование не только круговых, но и эллиптических орбит. Он ввел понятие второго квантового числа, связанного с орбитальным движени-ем электронов. Это позволило объяснить различие в энергии подуровней
161
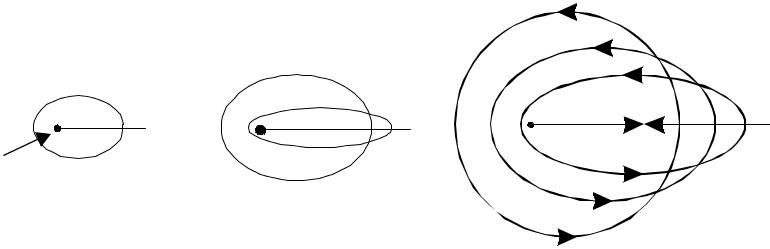 Ядро n=2 n=3 n=4 Рис.4.1. Зоммерфельдовские орбиты Наиболее эллиптичные из всех орбиталей s-орбитали, согласно мо-дели Зоммерфельда, соответствуют наиболее стабильным среди всех подуровням. В многоэлектронном атоме, ядро которого окружено экра-нирующими оболочками внутренних электронов, электроны на наиболее вытянутых эллиптических орбиталях, проникающие через эти оболочки, должны испытывать более сильное притяжение ядра. Поэтому такие орбиты оказываются более стабильными и имеют меньшую энергию. Так, 4р-подуровень должен располагаться ниже, чем 4f-подуровень. Модель Зоммерфельда позволила продвинуться в объяснении атом-ных спектров лишь до щелочных металлов. Далее она тоже зашла в ту-пик. Последующие открытия потребовали замены модели Бора – Зом-мерфельда более совершенной. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
