Строение атома. Периодический закон. Iv строение атома и периодическая система элементов логическая схема главы 154 155
 Скачать 1.71 Mb. Скачать 1.71 Mb.
|
|
Двойственная природа микрочастиц
162
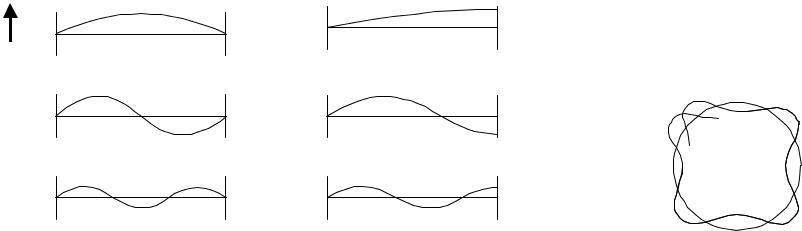 Рис.4.2. Приемлемые (а) и неприемлемые (б) стоячие волны, приемлемые (в) и неприемлемые (г) электронные волны Мы уже видели, что для фотона существует связь между волновыми и корпускулярными свойствами уже в выражении для его энергии:
По уравнению Эйнштейна
Отсюда, переходя к частице с массой m и скоростью v, получим:
Длину волны такой частицы часто называют длиной волны де Бройля. Исходя из формулы де Бройля, можно определить длину волны любой материальной частицы, необходимо только знать ее кинетиче- 163 скую энергию и скорость. Кинетическую энергию определяют экспери-ментально: E=mv2 2
Таким образом, длина волны электрона на первой орбитали атома водорода равна 3,33 Å, r = 0,53 Å. Длина окружности l = 2π r, отсюда для наружной орбиты l = 3.33 Å. Следовательно, длина волны электрона совпадает с окружностью орбиты. Отсюда вывод: на стационарных ор-битах, допускаемых квантовой механикой, длина волны электрона укла-дывается целое число раз, что подтвердило предположение де Бройля. Если рассчитать длину волны для макрочастиц, например частицы массой 1 г, движущейся со скоростью 1 см/с, то получим λ = 6.6 ⋅ 10-27 см. Это означает, что волновые свойства макрочастиц практически не проявляются. Предположение де Бройля было подтверждено экспериментально.
Принцип неопределенности
Согласно этому принципу невозможно точно определить местопо-ложение частицы и ее импульс. Чем точнее определяется координата частицы, тем более неопреде-ленным становится ее импульс, и, наоборот, чем точнее известен им-пульс, тем неопределеннее координата. 164 Если мы утверждаем, что определенный объект – частица, то мы должны уметь измерить корпускулярные свойства этого объекта (на-пример, скорость и положение в пространстве). Это было бы нетрудно сделать, если бы объектом служил мяч, но для электрона измерение этих величин требует особого подхода. Допустим, что у нас есть какой-то микроскоп, позволяющий уви-деть движущийся электрон. Сначала электрон движется прямо. Однако как только он столкнется с фотоном, имеющим сравнимую массу, то изменятся направление движения и скорость движения электрона. По-этому, наблюдая через малые промежутки времени, можно заметить, что электрон движется зигзагообразно под влиянием ударов фотонов. Для уменьшения влияния столкновения можно уменьшить энергию фотонов. Но это приведет к увеличению длины волны света Е = ћν , λ = c/ν , что уменьшит разрешающую способность микроскопа (т.е. точ-ность, с которой можно определить положение электрона), зависящую от длины волны излучения. Таким образом, используя свет большой длины, мы точно узнаем скорость электрона, но его положение точно определить не можем. С другой стороны, свет с короткой длиной волны, состоящий из фотонов высокой энергии (E = ћν ), позволяет точно определить положение элек-трона , но его скорость определить нельзя, так как на скорость электрона будут сильно влиять столкновения с фотонами. Таким образом, чем точнее определяем мы положение электрона в пространстве, тем неопределеннее его скорость, и наоборот, чем точнее определяем мы скорость электрона, тем более неопределеннее положе-ние электрона . Мы не можем одновременно точно определить положе-ние частицы и ее скорость. Соотношение неопределенностей имеет вид:
где ∆ x – неопределенность положения частицы; ∆ v – неопределенность скорости. Таким образом записывается принцип Гейзенберга (1927). Принцип неопределенности делает невозможным утверждение, что электрон, имеющий определенную скорость, находится в том или ином месте пространства. Мы можем только говорить о вероятности нахож-дения электрона в том или ином месте пространства. 165 Пример: Для электрона,движущегося по орбите со скоростью1056м/с, рассчитайте импульс и неопределенность по импульсу. Решение: Допустим,что мы можем измерить положение электрона
Согласно принципу неопределенности Гейзенберга неопределен-ность определения импульса составит:
Отсюда видно, что неопределенность по импульсу в 50 раз больше самого импульса. Уравнение Шредингера
Законы движения частиц в квантовой механике выражаются урав-нением Шредингера:
где h – постоянная Планка, m – масса частицы, U – потенциальная энер-гия частицы, E – полная энергия, x,y,z – координаты частицы. Уравнение Шредингера описывает общие законы движения микро-частицы и является одним из постулатов квантовой механики. Справед-ливость этого уравнения подтверждается согласием с опытом . Уравне-ние Шредингера играет в квантовой механике ту же роль, что и законы Ньютона в классической механике. Как и законы Ньютона, это уравне-ние невозможно вывести из каких-либо общих положений. Оно может 166 быть получено, исходя из определенной аналогии между уравнениями механики и оптики. Его можно получить, если в дифференциальное уравнение волны подставить λ из уравнения де Бройля и выразить им-пульс частицы через разность полной и потенциальной энергий. Познакомимся с математическим описанием волнового движения. Рассмотрим плоскую (одномерную) волну, которая с течением времени передвигается по оси Х (рис. 4.3.): 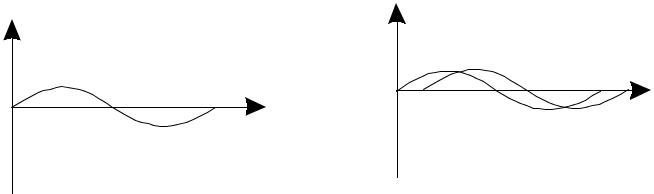 Х Х Рис. 4.3. Плоская одномерная волна Это волновое движение можно выразить уравнением:
где А – амплитуда волны; с – скорость движения волны; t – время. Решая это уравнение для одномерной волны, можно определить амплитуду А во время t и в положении x:
где Ψ – это трехмерный аналог А. Это уравнение Шредингер выбрал как основу для описания строения атома, так как, согласно гипотезе де Бройля, электрон – это стоячая волна. Поэтому, подставляя в волновое уравнение для трехмерной волны длину волны де Бройля, получим: 167
Учитывая, что полная энергия электрона в атоме является суммой потенциальной U и кинетической mv2/2 энергий
Это уравнение и называется уравнением Шредингера. Часто оно за-писывается в следующем виде:
где h – постоянная Планка; m – масса частицы; U – потенциальная энер-гия; E – полная энергия; x,y,z – координаты частицы. Это уравнение можно записать и по-другому:
Очень часто уравнение Шредингера изображают в краткой форме:
168 Величина Ψ называется волновой функцией. Ее квадрат имеет оп-ределенный физический смысл: величина Ψ 2dV пропорциональна веро-ятности нахождения электрона в элементарном объеме пространства с координатами x, y, z. Величину Ψ 2 называют плотностью вероятности, или электронной плотностью. Волновая функция должна быть конечной, непрерывной и одно-значной, а также обращаться в нуль там, где частица не может нахо-диться. Волновые функции, являющиеся решениями уравнения Шрединге-ра, могут быть сложными функциями пространственных переменных и времени. Они зависят от конкретного вида движения частицы. Кванто-во-механическая теория атома и молекулы сводится к нахождению удовлетворяющих уравнению Шредингера волновых функций и значе-ний энергии Е. Рассмотрим решение уравнения Шредингера в потенциальном поле ядра. Примером такой системы является атом водорода. Решения уравнения Шредингера для атома водорода были получе-ны в 1927 г. Эти решения приводят к понятию атомной орбитали, кван-товых чисел и квантованию энергий, которые являются фундаменталь-ными в современной теории строения атома. Для простейшей электронной системы – атома водорода – решение уравнения Шредингера в полярных координатах дает волновую функ-цию общего вида:
где N – постоянная нормировки, задается стопроцентной вероятностью нахождения электрона где-либо в пространстве около ядра; R(r) – радиальная часть волновой функции, возведенная в квадрат, показывает вероятность нахождения электрона в радиальном направле-нии от ядра на расстоянии r; Θ(ϑ)Φ (ϕ ) или Ф(x/r, y/r, z/r) – угловая часть волновой функции – определяет форму поверхностей, ограничивающих пространство, в ко-тором вероятность нахождения электрона составляет не менее 90%. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

