Ответы по инфекционным болезням. ОТВЕТЫ - ИНФЕКЦИИ 3. 1. Аденовирусная инфекция, этиология, эпидемиология, патогенез, клиника, диагностика, лечение, профилактика
 Скачать 2.27 Mb. Скачать 2.27 Mb.
|
|
5.Ботулизм. Клиника, диф. и лаб. Диагностика, лечение и профилактика. Ботулизм (син.: аллантиазис, ихтиизм) – тяжелое токсико инфекционное заболевание, характеризующееся поражением ботулотоксином нервной системы, преимущественно продолговатого и спинного мозга, протекающее с преобладанием офтальмоплегического и бульбарного синдромов. Этиология . Возбудитель ботулизма Cl. botulinum относится к роду Clostridium , семейству Bacillacea . Это анаэробная, подвижная вследствие наличия жгутиков, спорообразующая палочка размером (4 – 9) % (0,6 – 0,9) мкм. Известны 7 типов возбудителя – А, В, С (С1 и С2), Д, Е, F, G, различающихся по антигенной структуре выделяемого токсина. В России встречаются преимущественно типы А, В, Е. Возбудители ботулизма широко распространены в природе, обитают в почве. Наиболее благоприятная среда для размножения и токсинообразования – трупный материал. Ботулотоксин вырабатывается вегетативными формами. Строгие анаэробные условия для токсинообразования требуются не всегда, особенно для серотипа Е. Споровые формы клостридий выдерживают температуру 6 °C в течение нескольких месяцев, 100 °C – в течение нескольких часов, 120 °C – в течение 30 мин. Вегетативные формы бактерий малоустойчивы во внешней среде, погибают при температуре 60 °C. Ботулотоксин – один из наиболее сильных природных ядов (летальная доза для человека – 5 – 50 нг/кг массы тела), представляет собой токсический комплекс, состоящий из собственно нейротоксина, гемагглютинина и нетоксического белка с неизученными биологическими свойствами. Разрушается при температуре 80 °C в течение 30 мин, при температуре 100 °C – в течение 10 мин; хорошо нейтрализуется в щелочной среде. Эпидемиология. Ботулизм относят к сапрозоонозам. Основным резервуаром возбудителя ботулизма являются травоядные животные и реже холоднокровные (рыбы, моллюски, ракообразные), поглощающие споры Cl. botulinum с водой и кормом. Плотоядные животные обычно резистентны к данному возбудителю. Человек заражается ботулизмом при употреблении в пищу инфицированных спорами продуктов. Большая часть случаев ботулизма связана с употреблением продуктов домашнего консервирования – грибов, овощей, рыбы, мяса, сала и др. В редких случаях встречается раневой ботулизм и ботулизм грудных детей. Ботулизм относится к числу редко встречающихся заболеваний, и показатели заболеваемости не превышают доли процента, хотя в настоящее время заболеваемость ботулизмом регистрируется во всех странах мира. В Российской Федерации с 2007 г. ежегодно регистрируется около 200 случаев вспышек ботулизма с числом пострадавших около 300 пациентов в год. Патогенез. Вегетативные формы возбудителя и ботулотоксин попадают в организм человека при употреблении инфицированных пищевых продуктов. Действие токсина усиливается в желудке под влиянием протеолитических ферментов. Люди наиболее чувствительны к токсинам серотипов А, В, Е. Одномоментное воздействие ботулотоксина нескольких серотипов приводит к суммированию токсического эффекта. Ботулотоксин, всосавшийся через слизистую оболочку желудка и кишечника в кровь, вызывает парез гладкой мускулатуры, сужение кровеносных сосудов с последующим их парезом и повышением ломкости капилляров. Особой чувствительностью к ботулотоксину обладают мотонейроны спинного и продолговатого мозга, что проявляется развитием бульбарного и паралитического синдромов. Резко угнетается парасимпатическая нервная система при практической интактности симпатической нервной системы. Ботулотоксин блокирует освобождение ацетилхолина в окончаниях холинэргических нервов, что обусловливает развитие периферических параличей. В патогенезе ботулизма ведущую роль играет гипоксия – гипоксическая, гистотоксическая, гемическая и циркуляторная. Развитие прогрессирующей острой дыхательной недостаточности обусловлено угнетением активности больших мотонейронов, иннервирующих дыхательную мускулатуру. Гипоксическая гипоксия при ботулизме утяжеляется возможностью обтурации бронхов аспирированными рвотными массами, слюной и пищей, что связано с парезами мышц гортани, глотки и надгортанника. Токсинемия вызывает угнетение ферментов пентозофосфатного шунта, ингибирование Na/K насоса и обусловливает развитие гемической гипоксии. Механизм развития раневого ботулизма и ботулизма младенцев отличается тем, что заражение происходит спорами, которые прорастают в анаэробных условиях раны или вследствие особенностей флоры и ферментов кишечника грудных детей в вегетативные формы, продуцирующие токсины. Патологоанатомические изменения при ботулизме имеют неспецифический характер и определены глубокой гипоксией: полнокровие внутренних органов, отек головного мозга, точечные кровоизлияния в слизистую оболочку желудочно кишечного тракта. Клиническая картина . Инкубационный период болезни колеблется от 2 – 12 ч до 7 сут, составляя в среднем 18 – 24 ч. Ведущие синдромы при ботулизме: паралитический, гастроинтестинальный и интоксикационный. Начало болезни, как правило, острое. Больных беспокоят боли в эпигастральной области, тошнота, рвота, понос. Рвота и понос непродолжительны, являются следствием токсинемии. Температура тела остается нормальной, редко бывает субфебрильной. Рано отмечается быстрая утомляемость, прогрессирующая мышечная слабость. Спустя 3 – 4 ч от начала болезни развиваются симптомы поражения ядер черепных нервов и паралитические нарушения иннервации различных органов, характеризующиеся симметричностью поражений. Первыми типичными признаками ботулизма нередко являются сухость во рту и офтальмоплегические симптомы. Больные жалуются на ослабление зрения, «сетку» или «туман» перед глазами. Чтение затруднено или невозможно из за пареза аккомодации и двоения. Отмечается мидриаз со снижением или отсутствием реакции на свет, ограничение движения глазных яблок вплоть до полной неподвижности (парез взора), опущение верхних век (птоз), стробизм (косоглазие), горизонтальный нистагм. Может быть легкая анизокория. Наряду с глазными симптомами рано появляются нарушения глотания и речи в связи с поражением ядер IX и XII пар черепных нервов. У больных отмечается осиплость голоса, невнятность, смазанность речи, носовой оттенок голоса, иногда афония. Вследствие пареза мышц глотки, надгортанника и мягкого неба у больных возникают затруднение глотания, поперхивание, жидкая пища выливается через нос. Ботулизм сопровождается функциональными расстройствами сердечно сосудистой системы. Определяется расширение границ сердечной тупости и значительное приглушение тонов сердца с акцентом II тона на легочной артерии. Нарушения функций пищеварительной системы проявляются сухостью слизистых оболочек рта, мучительной жаждой, ощущениями распирания вследствие застоя содержимого в желудке, вздутием живота, запором, парезом кишечника. Вовлечение больших мотонейронов шейных и грудных отделов спинного мозга приводит к развитию парезов и параличей скелетных мышц. Вдох совершается с большим трудом, больной жалуется на сдавление и сжатие в грудной клетке, принимает вынужденное положение, способствующее включению вспомогательной дыхательной мускулатуры. Исчезает кашлевой рефлекс. Расстройство и остановка дыхания являются одной из ведущих причин смерти при ботулизме. Развитие аспирационных пневмоний усугубляет дыхательную недостаточность. В терминальный период прогрессируют явления мионейроплегии: миастения, адинамия. Мышцы приобретают тестообразную консистенцию. Выздоровление наступает медленно, в течение 1 – 1,5 мес. Неврологическая симптоматика ликвидируется в обратной последовательности: сначала восстанавливается дыхание и глотание. Головная боль, гнусавость, глазные симптомы, сердечно сосудистая недостаточность сохраняются длительно, астения держится до полугода. Выздоровление после перенесенного ботулизма полное, но наступает медленно. Типичным осложнением ботулизма является аспирационная пневмония, вторичная инфекция, связанная с инвазивными методами лечения (интубация, ИВЛ, катетеризация мочевого пузыря и т. п.). В гемограмме отмечается умеренный лейкоцитоз с нейтрофильным сдвигом влево. Прогноз при ботулизме всегда серьезный. При отсутствии адекватной терапии летальность 25 %. Диагностика осуществляется на основании клинической картины, эпидемиологических данных и результатов лабораторных исследований. Лабораторная диагностика основывается на выявлении ботулотоксина и возбудителя ботулизма в материалах, взятых от больных (кровь, рвотные массы, промывные воды желудка, испражнения), а также в подозрительных пищевых продуктах. Кровь берут из вены в объеме 8 – 10 мл до введения лечебной сыворотки. Ботулотоксин выявляют в реакции нейтрализации возбудителя заболевания (биологическая проба на мышах), путем посева на питательные среды (пепсин пептон, среда Китта – Тароцци, бульон Хоттингера). Дифференциальная диагностика . Ботулизм следует дифференцировать от ПТИ другого происхождения, отравлений ядовитыми грибами, белладонной и атропином, дифтерии, полиомиелита и различных заболеваний ЦНС. Центр по контролю и профилактике заболеваний США выделяет основные признаки, позволяющие дифференцировать ботулизм от других клинически схожих заболеваний: отсутствие лихорадки, симметричность неврологической симптоматики, отсутствие нарушений сознания и психики, нормо– или брадикардия при отсутствии пониженного АД, отсутствие нарушений чувствительности. Лечение. Больные с подозрением на ботулизм подлежат обязательной госпитализации в инфекционный стационар под постоянное наблюдение с готовностью проведения немедленной дыхательной реанимации. Всем больным проводят промывание желудка 5 % раствором пищевой соды (50 г на литр воды) объемом до 10 л. Сода нейтрализует токсин, но промывать желудок можно только при отсутствии нарушений дыхания и глотания. Для нейтрализации свободно циркулирующего в крови ботулотоксина применяют лечебные моновалентные противоботулинические сыворотки, что наиболее эффективно в 1 – 3 сутки болезни. Для нейтрализации каждого из токсинов (А, В, Е) существует своя антитоксическая противоботулиническая сыворотка, но при ботулизме счет идет на минуты, а на дифференциацию необходимо 2 – 3 дня, поэтому вводят сразу три препарата – сыворотки типа А, В и Е. Одна лечебная доза составляет по 10 тыс. МЕ антитоксинов типов А,С и Е, 5 тыс. МЕ типа В и 3 тыс. МЕ типа F. Лечебные сыворотки вводят после специфической гипосенсибилизации. В комплект антитоксических противоботулинических сывороток входят сыворотки типов А, В и Е, а сыворотки С, F и G не включены из за ограниченной потребности в них. При тяжелых формах первые дозы сыворотки вводят внутривенно, в остальных случаях – внутримышечно. Вначале вводят по 10 – 15 тыс. МЕ сывороток типов АиЕи5 – 7,5 тыс. МЕ сыворотки типа В, при необходимости сыворотки вводят повторно через 6 – 8 ч. Дозы и частота введения лечебных сывороток определяются тяжестью заболевания и динамикой симптомов болезни, продолжительность серотерапии – 3 – 4 дня. Наряду со специфической антитоксической терапией показаны энтеросорбенты полифепан, энтеродез, а также инфузионно дезинтоксикационная терапия: гемодез, лактосоль, растворы глюкозы с одновременным назначением фуросемида или лазикса. Для борьбы с гипоксией показана гипербарическая оксигенация. Перспективна специфическая антитоксическая терапия лечебной гомологичной плазмой при лечении ботулизма у детей в возрасте до 1 года в дозе 50 мг/кг. Для воздействия на вегетативные формы возбудителя показано использование левомицетина и препаратов тетрациклинового ряда. Важное место в терапии ботулизма занимает борьба с расстройствами дыхания и гипоксией. С этой целью используют гипербарическую оксигенацию. При нарастании асфиксии вследствие паралитического закрытия верхних дыхательных путей делают трахеостомию. В случаях расстройства дыхания вследствие паралича дыхательных мышц используют ИВЛ. При развитии пневмонии показана антибактериальная терапия. При расстройствах глотания обеспечивают зондовое питание. При атонии кишечника в восстановительный период применяют ацетилхолинэстеразные препараты (прозерин). Даже при своевременно начатом интенсивном лечении, включающем ИВЛ, летальность оставляет 2 – 3 %. Причина в том, что противоботулиническая сыворотка нейтрализует токсин в крови больных, но не может повлиять на токсины, уже проникшие в ЦНС. После перенесенного ботулизма иммунитет не сохраняется. Профилактика. Соблюдение санитарно гигиенических правил при обработке, транспортировке, хранении и приготовлении пищевых продуктов исключает возможность накопления в них ботулотоксина. Необходим строгий контроль при стерилизации и хранении консервированных продуктов. Большое значение имеет разъяснение населению правил заготовки и консервирования продуктов в домашних условиях, в первую очередь мясных, рыбных, грибных и овощных. Кипячение в течение 10 – 15 мин перед употреблением таких продуктов позволяет полностью нейтрализовать ботулотоксин. 6.Ботулизм. Этология, эпидем-я, патогенез, диагностика в поликлинических условиях(выше) 7.Бруцелез. Этиология, эпидемиология, патогенез, клиника, диагностика, лечение, профилактика. Бруцеллез (син.: мальтийская, средиземноморская, неаполитанская, кипрская, ундулирующая лихорадка, септицемия Брюса, болезнь Банга, болезнь Траума) – зоонозное инфекционное заболевание с высоким потенциалом хронизации. Характеризуется длительной лихорадкой и поражением опорно двигательного аппарата. Этиология. В настоящее время известны шесть основных видов возбудителей бруцеллеза: Br. melitensis, Br. abоrtus bovis, Br. abortus suis, Br. neotomae, Br. canis, Br. ovis . Основными носителями Br. melitensis являются овцы и козы, Br. abortus bovis поражает преимущественно крупный рогатый скот, Br. abortus suis – свиней; Br. neotomae – пустынных кустарниковых крыс; Br. canis – собак; Br. ovis – овец. Каждый из видов бруцелл подразделяется на биотипы с различно выраженной патогенностью для человека. Br. neotomae для людей не патогенны, значение Br. ovis в патологии человека изучается. В морфологическом отношении виды бруцелл не отличаются друг от друга. Микробы имеют шаровидную или овоидную форму; размеры их 0,3 – 0,6 мкм. Они грамотрицательны, могут расти на обычных питательных средах. В первых генерациях при высеве из организма бруцеллы растут медленно (2 – 4 нед.), при пересевах их рост ускоряется. Под влиянием антибиотиков бактерии способны трансформироваться в L формы. Бруцеллы характеризуются высокой способностью к инвазии и внутриклеточному паразитированию. При их разрушении выделяется эндотоксин. Бруцеллы не устойчивы к высокой температуре: при 60 °C они погибают в течение 30 мин, кипячение губит бактерии моментально. При низких температурах они могут сохраняться длительное время. Бруцеллы быстро погибают под воздействием прямых солнечных лучей и обычных дезинфицирующих веществ в рабочих концентрациях. Эпидемиология. Бруцеллез относится к типичным зоонозам, человек является биологическим тупиком – больной человек не является источником инфекции. Эта инфекция характеризуется множественными путями заражения и выраженным профессиональным характером заболеваемости. Источниками инфекции являются мелкий и крупный рогатый скот, свиньи, а в некоторых местах и северные олени. Наиболее важное эпидемиологическое значение принадлежит мелкому рогатому скоту вследствие облигатной патогенности для человека Br. melitensis. Эпизоотии бруцеллеза среди овец и коз влекут за собой эпидемические вспышки этого заболевания у людей. Br. abortus bovis, Br. abortus suis менее патогенны для человека. По этой причине крупный рогатый скот и свиньи имеют меньшее эпидемиологическое значение. При совместном содержании или выпасе нескольких видов больных и здоровых животных между ними происходит обмен различными видами бруцелл. В этом процессе большое эпидемиологическое значение приобретает миграция Br. melitensis мелкого рогатого скота на крупный рогатый скот и другие виды животных. Заболевание бруцеллезом животных в период беременности в большинстве случаев влечет за собой аборт, при этом в плоде, его оболочках, околоплодной жидкости, плаценте возбудитель содержится в большом количестве. У животных бруцеллы выделяются с мочой, испражнениями и молоком, а у абортировавших и с околоплодной жидкостью. В передаче инфекции от животных к человеку большое эпидемиологическое значение имеют мясо и сырые молочные продукты: молоко, брынза, сыр. В сырых молочных продуктах бруцеллы сохраняются 15 – 60 дней, в мясе – до 20 дней. Выделениями больных животных, содержащих бруцеллы, загрязняются шерсть, корм, подстилка в стойлах, почва, вода и др. Все эти инфицированные объекты служат факторами передачи возбудителя. Заражение человека обычно происходит алиментарным или контактным путями. Однако возможен и аэрогенный механизм заражения, обусловленный проникновением микробов через верхние дыхательные пути с пылевыми частицами шерсти, навоза, подстилки и земли. В интенсивных очагах, особенно овечьего и свиного бруцеллеза, основным является контактный путь заражения человека. При этом микробы проникают через кожные покровы лиц, ухаживающих за больными животными или обрабатывающих сырье животного происхождения. Связь заболевания бруцеллезом с больными животными и продуктами животноводства обусловливает выраженный профессиональный характер этой инфекции. Основной контингент больных – работники животноводства и предприятий, обрабатывающих продукты от животных. В энзоотических очагах бруцеллеза сезонный подъем заболеваемости людей связан с периодом отела, окота или опороса у животных. В результате проведения в государственном порядке противобруцеллезных мероприятий во многих регионах нашей страны заболеваемость бруцеллезом сельскохозяйственных животных полностью ликвидирована; прекратились и заболевания людей. Однако бруцеллез сохранил свою значимость как краевая патология в азиатских регионах страны, в Казахстане, Закавказье, во многих странах Азии, Африки и Южной Америки. Иммунитет при бруцеллезе ненапряженный и непродолжительный, в среднем он длится 6 – 9 мес., не является строго специфическим. Это дает возможность вакцинировать людей маловирулентным штаммом коровьего типа (Br. bovis ), создавая иммунитет к овечьему типу бруцелл (Br. melitensis ). Патогенез. Бруцеллы проникают в организм через кожу или слизистые оболочки, захватываются макрофагами, размножаются в них и током лимфы заносятся в регионарные лимфатические узлы, а из последних по лимфатическим и кровеносным сосудам распространяются по всему организму. Патогенез бруцеллеза включает пять фаз: лимфогенную, гематогенную, фазу полиочаговых локализаций, фазу экзоочаговых обсеменений и фазу метаморфоза. Степень проявления отдельных фаз и последовательность их развития зависят от индивидуальных особенностей организма, входных ворот инфекции, вида и дозы возбудителя, условий заражения. Поступление возбудителей инфекции по лимфатическим путям в регионарные лимфатические узлы – первая фаза патогенеза, фаза лимфогенного заноса и лимфорецепторных раздражений соответствует инкубационному периоду заболевания. Дальнейшее развитие патологического процесса определяется инфицирующей дозой и состоянием защитных сил организма. Бруцеллы могут длительно сохраняться в лимфатических узлах, обусловливая иммунологическую перестройку организма без каких либо клинических проявлений (первичная латенция). При значительном накоплении возбудителя вследствие незавершенного фагоцитоза лимфатические узлы становятся резервуарами возбудителей, откуда бруцеллы могут поступать в кровь и распространяться по всему организму (фаза гематогенного заноса, или первичной генерализации). Клинически это соответствует острому периоду болезни, проявляется лихорадкой, ознобами, потами, микрополиаденитом и другими симптомами. Из крови бруцеллы захватываются клетками системы мононуклеарных фагоцитов различных органов (печень, селезенка, костный мозг и др.) с формированием в них метастатических очагов инфекции (фаза полиочаговых локализаций). С началом генерализации возбудителя и формирования метастатических инфекционных очагов происходит иммуноаллергическая перестройка организма, определяющая особенности патогенеза и патоморфологической картины заболевания. Бруцеллез относится к тем инфекционным заболеваниям, при которых иммунный ответ не обеспечивает у значительной части больных бактериологического очищения организма. Бруцеллы длительно сохраняются в метастатических очагах, из них происходит повторная многократная диссеминация возбудителя с развитием реактивно аллергических изменений и хронизацией процесса (фаза экзоочаговых обсеменений и реактивно аллергических изменений). Суперинфекция, нередко имеющая место у больных в эндемических очагах болезни, является дополнительным фактором, способствующим развитию обострений, рецидивов и хронизации заболевания. Хроническое течение, сопровождающееся многократной генерализацией возбудителя из метастатических очагов, придает бруцеллезу характер хрониосепсиса. Длительное воздействие возбудителя и продуктов его жизнедеятельности на органы и ткани обусловливает иммуноаллергическую перестройку организма и комплекс проявлений, характерных для подострого и хронического бруцеллеза. В клинической картине наряду с присущими острому бруцеллезу симптомами появляются очаговые поражения различной локализации. В этот период уменьшается вероятность высева бруцелл из крови, выявляются положительные аллергические пробы (проба Бюрне). Вместе с тем следует отметить, что и в эту фазу болезни возможно выделение бруцелл из крови, чаще в виде L форм. Следующая фаза – фаза резидуального метаморфоза – соответствует исходам бруцеллеза, завершающегося либо полным рассасыванием воспалительных образований, либо формированием стойких необратимых рубцовых изменений в пораженных органах и тканях. Клиническая картина. Инкубационный период при бруцеллезе длится от 7 до 30 дней. Клинические проявления весьма полиморфны и могут варьировать как по длительности течения, так и по разнообразию симптомов. В очагах инфекции нередко встречается латентный бруцеллез, при котором у зараженных людей бруцеллы находятся в виде «дремлющей» инфекции, вызывающей иммуноаллергическую перестройку организма. Однако при тщательном клиническом обследовании у части инфицированных лиц можно обнаружить некоторые симптомы болезни: увеличение лимфатических узлов, функциональные расстройства нервной системы, увеличение печени и селезенки и т. д. Серологические пробы и кожная аллергическая проба Бюрне у таких людей положительные. Клинически выраженные формы бруцеллеза проявляются длительной лихорадкой, ознобами, повышенной потливостью, гепатоспленомегалией, поражением опорно двигательного аппарата, нервной, сердечно сосудистой, урогенитальной и других систем организма. Известны несколько клинических классификаций бруцеллеза. одна из них: 1. Субклиническая форма (положительно реагирующие на пробу Бюрне). 2. Клинически выраженные формы: – острый бруцеллез; – подострый бруцеллез; – хронический бруцеллез (с указанием органопатологии): компенсированный, субкомпенсированный, декомпенсированный; – суперинфекция; – реинфекция. 3. Резидуальный бруцеллез (остаточные явления). Острая и подострая формы бруцеллеза. В начале заболевания нередко имеет место продромальный период длительностью 3 – 5 дней, проявляющийся недомоганием, слабостью, подавленностью настроения, быстрой физической и умственной утомляемостью, легкой головной болью и понижением аппетита. К концу продромального периода признаки интоксикации нарастают. Развиваются основные клинические проявления болезни, среди которых кардинальными являются гипертермия, сопровождающаяся ознобами и проливными потами, гепатоспленомегалия. Лихорадка длительная, в разгар заболевания температурная кривая ремиттирующего типа (с подъемом во второй половине дня или в вечерние часы). Могут быть также ундулирующий (волнообразный) и интермиттирующий типы температурной реакции или длительный субфебрилитет. Несмотря на длительность и высоту лихорадки, состояние больных почти не нарушается, самочувствие остается относительно хорошим, часто у больных наблюдается словоохотливость и эйфория. При острой форме бруцеллеза в течение одного и того же дня у больных наблюдаются однократные и многократные познабливания, иногда потрясающий озноб. В начале озноба температура тела иногда падает ниже нормы, затем возникает жар, сухость во рту, постепенно нарастает температура тела. Каждый раз озноб и повышение температуры завершаются профузным потоотделением. Лимфатические узлы, особенно шейные и подмышечные, увеличены в размерах (от 1 – 2 до 1,5 – 3 см), безболезненны и не спаяны с окружающей тканью. У большинства больных обнаруживаются умеренное расширение границ сердца влево, приглушенность его тонов, систолический шум на верхушке; в тяжелых случаях выявляются миокардит, эндокардит, перикардит. АД и венозное давление понижены. Частота пульса соответствует температуре. У ряда больных бывает дикротия пульса, иногда экстрасистолия. Повышается проницаемость капилляров. При острой форме заболевания, по мере развития токсико септического процесса, выявляются изменения со стороны органов дыхания: катаральное воспаление ВДП, бронхиты, бронхопневмонии, бронхоадениты. Печень и селезенка увеличены, по консистенции они мягкие, болезненные при пальпации. Часто отмечаются ноющие боли в правом подреберье. О поражении нервной системы в разгар острой формы заболевания свидетельствуют головные боли, раздражительность, эмоциональная неустойчивость, чрезмерная утомляемость, нарушения сна. В тяжелых случаях бруцеллезной инфекции наблюдаются расстройства психики, явления менингизма и менингита. Течение менингита обычно вялое, без четкой выраженности общемозговых и менингеальных симптомов. Лишь в отдельных случаях менингит протекает с яркой симптоматикой. Бруцеллезный менингит имеет обычно серозный характер. Опорно двигательная система при остром бруцеллезе поражается лишь у части больных в виде кратковременных артралгий, которые быстро исчезают по мере уменьшения признаков интоксикации. На поздних сроках заболевания появляются клинические признаки иммунноаллергической перестройки организма. У значительной части больных заболевание характеризуется склонностью к затяжному течению с переходом его в подострую и хроническую формы. Этому может способствовать несвоевременная диагностика и поздно начатое лечение. После проведенной этиотропной терапии в организме больных даже при полном отсутствии клинических признаков могут сохраняться бруцеллы, локализованные внутриклеточно в системе мононуклеарных фагоцитов внутренних органов. При наличии факторов, снижающих защитные силы организма (физические и эмоциональные перегрузки, переохлаждения, резкое нарушение обменных процессов и др.), развивается вторичная генерализация инфекции – рецидив заболевания, который может проявиться через 1 – 2 мес. или в более поздние сроки после угасания симптомов острой фазы болезни. Обычно рецидив бруцеллеза протекает с ознобом, повышением температуры, усилением потоотделения. С первых же дней рецидива выявляются очаговые поражения отдельных органов и систем, при этом наиболее постоянно поражается опорно двигательная система. При определении продолжительности бруцеллезной инфекции следует учитывать возможность супер– и реинфекции, часто возникающей в эндемических очагах и значительно увеличивающей продолжительность заболевания. Некоторая часть больных при своевременном и правильно проведенном лечении выздоравливает спустя 1 – 2 года от начала болезни, однако чаще болезненный процесс затягивается и принимает хроническое течение. Хроническая форма бруцеллеза развивается чаще всего вследствие ранее перенесенных острой и подострой форм болезни и ее рецидивов. Однако допускается возможность развития первично хронического бруцеллеза непосредственно после периода первичной латенции. Клинические симптомы хронического бруцеллеза проявляются на фоне предшествующей иммуноаллергической перестройки организма. Эта форма отличается полиморфизмом и лабильностью клинических признаков, рецидивирующим течением, слабой выраженностью интоксикации, преобладанием очагового поражения систем и органов. Наиболее часто при хроническом бруцеллезе наблюдается поражение опорно двигательной системы в виде артритов, периоститов, перихондритов. Характерны полиартриты с вовлечением в патологический процесс преимущественно крупных суставов – коленного, тазобедренного, локтевого, пояснично крестцового сочленения и др., редко поражаются мелкие суставы. Отмечаются боли в мышцах и суставах, ограничение движений. Суставы опухают, может быть гиперемия кожи за счет периартрита. В суставах могут развиваться воспалительные изменения, сопровождающиеся накоплением выпота. При повторных поражениях суставов изменению подвергаются внутрисуставные поверхности, мениски, хрящи с последующим сужением суставной щели и ее заращиванием. Это в свою очередь приводит к артрозам, спондилоартрозам, анкилозу. Характерно поражение крестцово подвздошных сочленений с развитием анкилоза. При хроническом бруцеллезе часто поражаются мышцы. Миозиты сопровождаются продолжительными, разной интенсивности болями. Помимо миозитов у больных бруцеллезом часто выявляются фиброзиты (целлюлиты). Они локализуются в подкожной клетчатке на спине, пояснице, реже – на голенях и предплечьях. Размеры их колеблются от 5 – 10 мм до 3 – 4 см. Со временем они уменьшаются в размерах, могут полностью рассосаться или склерозируются и остаются длительно безболезненными. Жалобы больных на общую слабость, утомляемость, повышенную раздражительность, нарушение сна свидетельствуют о функциональных расстройствах нервной системы, протекающих по типу неврастении. Поражения периферической нервной системы при хроническом бруцеллезе проявляются радикулитами, плекситами, межреберными и другими видами невралгий, расстройствами чувствительности, парезами, невритами слухового и зрительного нервов со значительным снижением слуха и остроты зрения. Хроническая интоксикация ЦНС, особенно коры головного мозга, в случаях длительного течения инфекции приводит к тяжелым неврозам, реактивным состояниям, ипохондрии, психозам. Наблюдаются кратковременные психосенсорные расстройства, оптико вестибулярные и рецепторные нарушения. Более стойкими бывают расстройства психики с астеническим и ипохондрическим синдромами, ослабление памяти, понижение или повышение эмоциональной возбудимости. При вовлечении в процесс вегетативной нервной системы нарушается тонус сосудов, возникают акроцианоз, обильное потоотделение, трофические нарушения кожи. Закономерно поражается сердечно сосудистая система и в первую очередь кровеносные сосуды. У больных возникают эндо , пери– и панваскулиты, повышается проницаемость капилляров. Нередко отмечаются миокардиты, эндокардиты, панкардиты. Печень и селезенка увеличены, уплотнены, их функции нарушены. При хроническом бруцеллезе нередко поражается урогенитальная система: у мужчин возникают орхит, эпидидимит, у женщин – оофарит, сальпингит, эндометрит, нарушение менструального цикла и прерывание беременности. В ряде случаев выявляется нарушение функции щитовидной железы, надпочечников и других эндокринных органов. Картина крови характеризуется лейкопенией, лимфоцитозом, моноцитозом, эозинопенией, тромбоцитопенией. Для хронического бруцеллеза характерно волнообразное течение с ремиссиями и рецидивами. Больные надолго утрачивают работоспособность, могут стать инвалидами. У вакцинированных лиц заболевание протекает легче и менее продолжительно, с невысокой температурой, нередко с самого начала отличается локальными симптомами в виде первично хронической формы болезни. У значительного числа вакцинированных, заболевших первично хроническим бруцеллезом, заболевание принимает стертый характер с мало выраженными проявлениями. Наиболее постоянным и иногда единственным симптомом в таких случаях являются артралгии. Резидуальная фаза (клиника последствий) бруцеллеза . У лиц, перенесших бруцеллез, нередко наблюдаются те или иные остаточные явления, в основном функционального характера, обусловленные иммуноаллергической перестройкой организма и расстройствами вегетативной нервной системы. У таких больных отмечаются повышенная потливость, раздражительность, изменения нервно психической сферы, нередко имеются артралгии. Боли в суставах чаще непостоянного характера, при этом видимых изменений в суставах не выявляется. Эти боли усиливаются при выполнении физической работы и в связи с переменой погоды. Температура тела у больных обычно нормальная, иногда субфебрильная. У ряда больных, перенесших бруцеллез, наблюдаются органические изменения опорно двигательной системы с деформациями суставов за счет разрастания околосуставной ткани, что выявляется при клиническом и рентгенологическом обследовании. Стойкие и необратимые явления со стороны опорно двигательного аппарата могут требовать оперативного вмешательства. Прогноз. Для жизни, как правило, благоприятный. Летальность крайне низка. Прогноз в отношении трудоспособности и здоровья нередко бывает неудовлетворительным. Диагностика. В диагностике бруцеллеза учитывают клинические данные, эпидемиологический анамнез и результаты лабораторного обследования. Эпидемиологический анамнез, указывающий на возможность профессионального или бытового заражения, имеет исключительное значение в диагностике бруцеллеза. Каждый случай заболевания, подозрительный на бруцеллез, обязательно должен быть подтвержден лабораторно. Для этого обычно используют бактериологический, биологический, серологический и аллергологический методы исследования. Выделение культуры бруцелл от больных является несомненным подтверждением диагноза. Возбудитель может быть получен (с использованием специальных сред) из крови, костного мозга, желчи, мочи, лимфатических узлов, цереброспинальной жидкости, суставной жидкости (при артритах), влагалищного отделяемого, пунктата селезенки. Рост бруцелл происходит медленно, в течение месяца. Бактериологические исследования ввиду их сложности и необходимости соблюдения мер предосторожности проводятся в специальных лабораториях. В целях иммунодиагностики бруцеллеза разработан довольно специфичный и чувствительный метод иммуноферментного анализа (ИФА), который пока не нашел широкого применения в нашей стране в силу затратности из за малой распространенности болезни. В серологической диагностике бруцеллеза большое значение сохраняет реакция Райта, которая часто является положительной уже в первые дни заболевания; диагностическим считается титр агглютининов в исследуемой сыворотке крови не менее 1: 200. Для ускорения серодиагностики бруцеллеза широко применяется пластинчатая реакция агглютинации Хеддльсона с цельной сывороткой и концентрированным антигеном. Диагностическую ценность имеют РСК, РНГА и реакция Кумбса. Они отличаются более высокой чувствительностью, чем другие серологические методы. Из аллергологических методов диагностики бруцеллеза используют реакцию Бюрне путем внутрикожного введения бруцеллина – фильтрата бульонной культуры возбудителя. Эта реакция основана на способности организма, сенсибилизированного бруцеллезным антигеном, отвечать развитием специфического процесса в коже в виде покраснения и отека. Реакцию учитывают по величине отека: при его диаметре менее 1 см реакция считается сомнительной, от 1 до 3 см – слабоположительной, от 3 до 6 см – положительной и более 6 см – резко положительной. Как правило, внутрикожная проба становится положительной к концу первого месяца заболевания. Она бывает положительной и у лиц, вакцинированных живой бруцеллезной вакциной. Особое значение эта реакция приобретает в диагностике хронического бруцеллеза. Лечение. Задачами лечения больных бруцеллезом являются купирование болезненного процесса, ликвидация его последствий и восстановление трудоспособности пациента. Терапия болезни зависит от фазы, степени компенсации процесса и характера иммуноаллергической перестройки организма. Для лечения острых и подострых форм бруцеллеза вначале применяют антибиотики: тетрациклин (по 0,5 г через 6 ч в течение 3 – 6 нед.) в сочетании со стрептомицином (по 1,0 г 2 раза в сутки внутримышечно). Возможна замена тетрациклина доксициклином, стрептомицина гентамицином. В последние годы в терапии бруцеллеза с хорошим эффектом применяют препараты из группы хинолонов (офлоксацин, дифлоксацин и др.), цефалоспоринов III поколения. При хроническом бруцеллезе антибиотики применяют лишь в период обострения болезни с выраженными клинико лабораторными проявлениями. При отсутствии признаков активации процесса, а также в стадии субкомпенсации хронического бруцеллеза с устойчивой нормализацией температуры тела назначение антибиотиков нецелесообразно. Широко применявшаяся в прошлом лечебная вакцина в настоящее время используется крайне редко из за высокой аллергизации населения вообще и сенсибилизирующих свойств вакцины. При тяжелом течении острого бруцеллеза, иногда и при подострой и хронической формах болезни, применяют глюкокортикостероиды. С целью иммунной коррекции при бруцеллезе применяются различные иммуномодуляторы. При артритах и периартритах эффективно внутри– или периартикулярное введение гидрокортизона. При подостром и хроническом бруцеллезе с преимущественным поражением опорно двигательного аппарата и периферической нервной системы назначают НПВС с анальгезирующим эффектом: бутадион, ацетилсалициловая кислота, анальгин, реопирин, индометацин, ибупрофен, вольтарен, диклофенак и др. Для лечения больных бруцеллезом широко применяют стимулирующую и десенсибилизирующую терапию, положительное воздействие на больных с опорно двигательными поражениями оказывают физиотерапия (УВЧ, лазерное излучение, диатермия и др.), лечебная физкультура, массаж. В стадии компенсации или резидуальных проявлений бруцеллеза для больных эффективно санаторно курортное лечение, в особенности на бальнеологических курортах с радоновыми и сернорадоновыми водами. При поражении суставов эффективно грязелечение. Профилактика. Основные меры предупреждения бруцеллеза заключаются в искоренении инфекции у сельскохозяйственных животных, что предопределяется строгим соблюдением ветеринарно санитарных правил. В целях профилактики бруцеллеза у людей производят обеззараживание молока кипячением и пастеризацией. Продукты, изготовленные из сырого молока, перед употреблением выдерживают необходимые сроки. Следует принимать меры, препятствующие распространению возбудителя с мясом и мясопродуктами. Обеззараживанию подлежат шкуры и шерсть животных. К работе с инфицированными животными и на предприятиях по обработке животноводческого сырья допускаются лица, положительно реагирующие на бруцеллин или вакцинированные против бруцеллеза. При работе должны использоваться защитная одежда и дезинфицирующие вещества. Специфическая профилактика бруцеллеза достигается применением живой противобруцеллезной вакцины, обеспечивающей иммунитет на 1 – 2 года. Вакцинацию проводят в районах, где имеется заболеваемость бруцеллезом среди животных. Иммунопрофилактике подлежат лица, обслуживающие сельскохозяйственных животных, и работники предприятий по обработке продуктов животноводства. Несмотря на важную роль иммунопрофилактики бруцеллеза, решающее значение в предупреждении инфекции имеют санитарно гигиенические и ветеринарные мероприятия. 8.Брюшной тиф. Диагностика, лечение. Правила выписки из стационара, профилактика. 9.Брюшной тиф. Клиническая классификация, клиника, особенности лечения на современном этапе. 10. Брюшной тиф. Осложнения, их профилактика и лечение. выше 11.Брюшной тиф. Этиология, эпидемиология ,патогенез, патологическая анатомия. выше Брюшной тиф, паратифы А и В– острые инфекционные заболевания, сходные по своим клиническим проявлениям и патогенезу. Все они вызываются бактериями рода сальмонелл, характеризуются поражением лимфатического аппарата кишечника (главным образом тонкой кишки), бактериемией и протекают с выраженной интоксикацией, увеличением печени и селезенки и часто с розеолезной сыпью. В России брюшной тиф и паратифы А и В обычно объединяют в одну группу тифо-паратифозных заболеваний. Этиология. Возбудители брюшного тифа (Salmonella typhi ) и паратифовА и В (Salmonella paratyphi A et B ) относятся к роду Salmonella (серологической группе D), семейству кишечных бактерий (Enterobacteriaceae ). Морфологически они не отличаются друг от друга, имеют форму палочек размером (0,5 – 0,8) % (1,5 – 3) мкм. Установлено также наличие фильтрующихся и L форм бактерий. Спор и капсул сальмонеллы не образуют, они подвижны, имеют перитрихиально расположенные жгутики. Бактерии грамотрицательны, растут на обычных питательных средах, лучше – на содержащих желчь. Содержат эндотоксин, который освобождается при разрушении бактериальной клетки. В биохимическом отношении более активны паратифозные бактерии: они расщепляют углеводы с образованием кислоты и газа. Брюшнотифозные бактерии содержат соматический (термостабильный) О антиген, жгутиковый (термолабильный) Н антиген и соматический термолабильный Vi антиген, располагающийся более поверхностно, чем О антиген. Во внешней среде тифо паратифозные бактерии относительно устойчивы. В воде и почве они могут сохраняться от нескольких дней до нескольких месяцев. Благоприятной средой для бактерий являются пищевые продукты (молоко, сметана, творог, мясной фарш, студень), в которых они не только сохраняются, но и способны размножаться. Бактерии хорошо переносят низкие температуры, но при нагревании быстро погибают (при 60 °C – через 30 мин, при 100 °C – почти мгновенно). Дезинфицирующие средства (гипохлориты, хлорамины, лизол) в обычных концентрациях убивают возбудителя в течение нескольких минут. Эпидемиология. Брюшной тиф, паратифы А и В относятся к кишечным антропонозам. Источником инфекции является только человек – больной или бактерионоситель. Из организма больного человека возбудители выделяются во внешнюю среду вместе с испражнениями, мочой и слюной. Массивное выделение начинается после 7 го дня заболевания, достигает максимума в разгаре болезни и уменьшается в период реконвалесценции. В большинстве случаев бактериовыделение продолжается не более 3 мес. (острое бактериовыделение), но иногда и всю жизнь (хроническое бактериовыделение). Хронические бактериовыделители являются основными источниками брюшнотифозной инфекции. Характерен фекально оральный механизм заражения. Пути: водный, пищевой и контактно бытовой. В ряде случаев контактно бытовой путь. Наиболее часто заболевают люди в возрасте 15 – 45 лет, преимущественно мужчины. После перенесенной инфекции сохраняется стойкий иммунитет, однако у некоторых пациентов через несколько лет возможны повторные заболевания. Характерно сезонное повышение заболеваемости в летне осенний период. Патогенез. При попадании в организм через рот и преодолении защитных барьеров верхних отделов пищеварительного тракта брюшнотифозные бактерии проникают в просвет тонкой кишки (фаза инфицирования ). Из просвета кишки через лимфоидные образования ее слизистой оболочки бактерии проникают в регионарные лимфатические узлы (преимущественно брыжеечные), где интенсивно размножаются, что приводит к развитию воспалительного процесса (фаза первичной регионарной инфекции ). Указанные патогенетические фазы соответствуют инкубационному периоду. Возможно, в этот период развития болезни происходит сенсибилизация организма, в том числе и лимфатического аппарата кишечника, с чем связывают все последующие характерные для брюшного тифа патоморфологические изменения. В результате нарушения проницаемости гематолимфатического барьера бактерии поступают в кровяное русло, развивается бактериемия, с которой совпадает начало лихорадочного периода болезни. 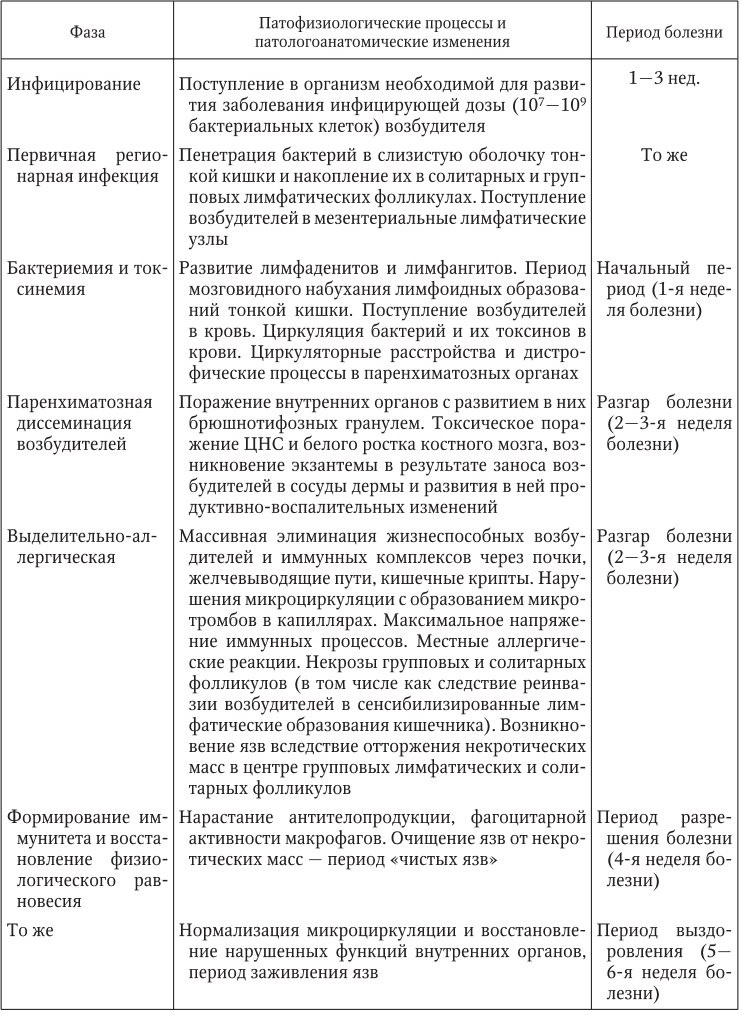 При гибели части бактерий под влиянием бактерицидных свойств крови и вследствие фагоцитоза клетками системы мононуклеарных фагоцитов освобождаются эндотоксины, вызывающие общую интоксикацию организма (фаза бактериемии и токсинемии ). Обладая выраженными нейротропными свойствами, они оказывают повреждающее действие на ЦНС и в тяжелых случаях способны вызывать status typhosus . Поражение вегетативной нервной системы приводит к появлению симптомов ваготонии, развитию метеоризма, болей в животе, к трофическим расстройствам. |
