1. Первичная структура белков
 Скачать 1.7 Mb. Скачать 1.7 Mb.
|
|
1. Первичная структура белков. Аминокислоты – амфотерные соединения, соединяющиеся друг с другом в молекуле белка с помощью пептидных связей. α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей 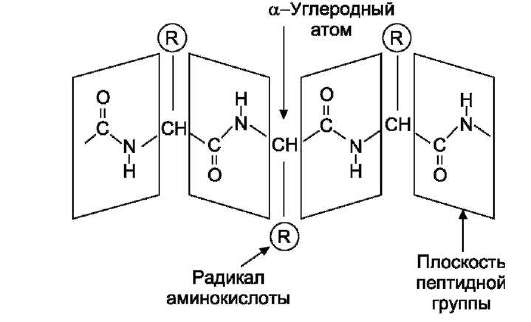 по отношению друг к другу пептидные группы располагаются под углом. Линейную последовательность аминокислотных остатков в полипептидной цепи называют «первичная структура белка Видовая специфичность белков Индивидуальность белковых молекул определяется порядком чередования АК в белке. Однако многие белки, выполняя одну и ту же функцию, несколько отличаются по строению у разных представителей одного и того же вида. Примером могут служить белки групп крови у человека. Такое разнообразие белков обусловливает индивидуальную специфичность организмов. Наследствен ные изменения первичной структуры. Полиморфизм белков первичная структура белков, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению структуры синтезируемого белка. Если изменение последовательности аАКносит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. это полиморфизм белков. примерами полиморфизма : гемоглобин человека( эмбриональный, фетальный, и А гемоглобин взрослого человека Наследствен ные протеинопатии: серповидно-клеточная анемия, другие примеры. Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате,а значит и в белках анемию с обнаружением в его крови, похожих на полумесяц, эритроцитов. Заболевание получило название «серповидно-клеточной анемии, оно вызвано изменением первичной структуры НЬА. В молекуле гемоглобина S мутантными оказались 2 β-цепи, в которых глутамат, в положении 6 была заменена валином, содержащим гидрофобный радикал. «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Семейная гиперхолестеринемия - это генетическая болезнь, характеризующаяся высоким уровнем холестерина в крови, и ЛПНП а также ранним возникновением сердечно-сосудистых заболеваний. У многих пациентов происходят мутации в гене рецептора ЛПНП, кодирующего соответствующий белок ЛПНП-рецептора или аполипопротеина В (апо-В), который является частью ЛПНП, который связывается с рецептором 2. Конформация белковых молекул (вторичная и третичная структуры) Вторичная структурабелка – это способ укладки полипептидной цепи, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей.В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура. 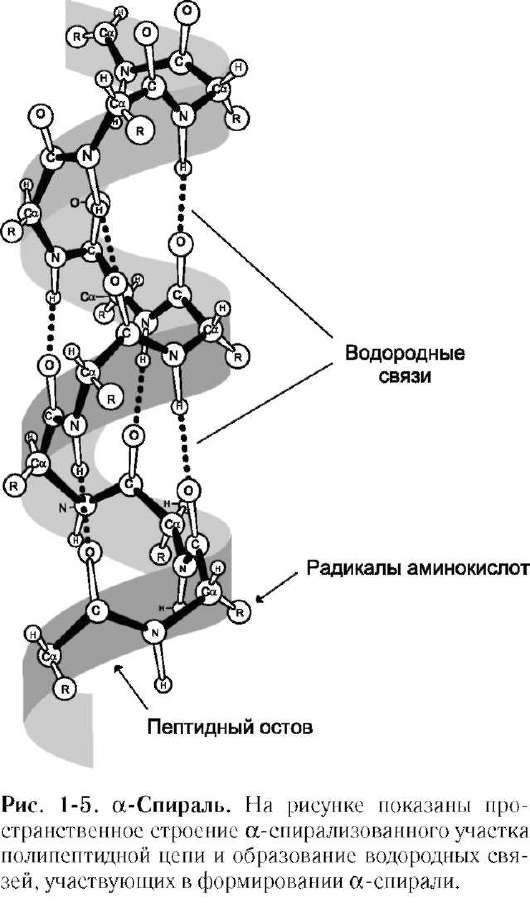 α-Спираль является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп. β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями. Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя ( 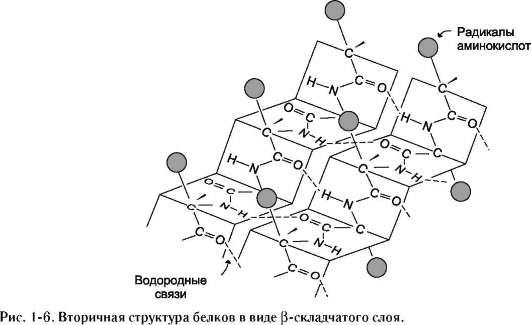 Третичная структура белков Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот Связи, участвующие в формировании третичной структуры белков Гидрофобные взаимодействия гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры Ионные и водородные связи и Ковалентные связи дисульфидные связи, образующиеся за счёт взаимодействия SН-групп двух остатков цистеина. Активный центр белков- определённый участок белковой молекулы, находящийся в её углублении сформированный радикалами собранных при формировании третичной структуры осуществляет взаимодействие с молекулой субстрата конформационной лабильностью - склонностью к изменениям конформации за счёт разрыва одних,и образования других слабых связей. Конформация белка меняется при изменении хим и физ свойств среды, при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры и конформации белка в целом. 3. Четвертичная структура белков. Кооперативные изменения конформации протомеров. Примеры строения и функционирования олигомерных белков: гемоглобин (в сравнении с миоглобином, аллостерические ферменты). Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков». Отдельные полипептидные цепи в таком белке- протомеров, или субъединиц. они объединяются гидрофобных, ионных, водородных. Каждый протомер взаимодействует с другим во многих точках. субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение О2 к гемоглобину. Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, связанную с белковой частью апомиоглобин. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь. Миоглобин участвует в запасании кислорода. Третичная структура имеет вид компактной глобулы 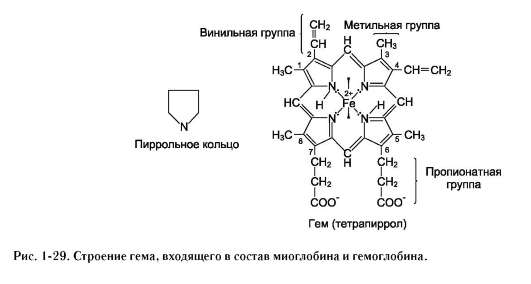 Гемоглобины, так же как миоглобин, относят к гемопротеинам, но он имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций. Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β (2α2β). Гемоглобин А2 2%. Он состоит из 2 α- и 2 δ-цепей. Протомеры гемоглобина, так же как и апомиоглобин, состоят из 8 спиралей, свёрнутых в плотную глобулярную структуру, содержащую внутреннее гидрофобное ядро и «карман» для связывания гема. но тетрамерная структура гемоглобина представляет собой более сложный комплекс, чем миоглобин. Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами; они имеют аллостерический центр, удалённый от каталитического активного центра; эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; 4. Понятие о ферментах. Специфичность действия ферментов. Кофакторы ферментов. Зависимость скорости ферментативных реакций от концентра ции субстрата, фермента, температуры и рН. Принципы количественного определения ферментов. Единицы активности. Ферменты являются белками. они увеличивают скорость протекания химической реакции, но не расходуются. Простые ферменты состоят только из АК, а сложные из 2х частей: белковой (апофермент) и небелковой (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической группой, если непрочно – коферментом. I класс - оксидоредуктазы овр II класс - трансферазы перенос химических групп III класс - гидролазы разрушения химических связей с участием воды. IV класс - лиазы разр. химических связей без участия воды. V класс - изомеразы реакции изомерных превращений. VI класс - лигазы реакции синтеза. Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают: • абсолютную субстратную специфичность; Активный центр ферментов комплементарен только одному субстрату.(аргиназа(катал. расщеп. аргинина до мочевины и орнитина) • групповую субстратную специфичность;катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. панкреатическая липаза( превращение триацилглицерола до моно- и 2-х вжк) • стереоспецифичность. к цис-транс-изомерам. Фермент фумараза оказывает действие только на фумарат Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера "ключ-замок") 2. Теория Кошланда "рука-перчатка" – подразумевает гибкость активного центра.. Каталитическая специфичность, обеспечивает преобразование одного и того же субстрата под действием разных ферментов. Например,глюкозо-6-фосфат является субстратом четырех ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Кофакторы ферментов: Ионы металлов - стабилизаторы молекулы субстрата Ионы металла - стабилизаторы активного центра ферментаОни выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. Зависимость от концентрации субстрата При увеличении концентрации субстрата скорость реакции сначала возрастает, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации скорость реакции снижается. Концентрация субстрата при которой скорость р-ии равно половине мах наз-ся константой махаэлиса – она хар-ет сродство фермента к субстрату., чем онаниже тем сроство выше Зависимость от концентрации фермента прямопропорционально увеличивается Зависимость скорости реакции от температуры описывается колоколообразной кривой с максимумом скорости при значениях оптимальнойtдля данного фермента. Зависимость скорости реакции от рН колоколообразной кривой с максимумом при оптимальном рН. Принципы определения активности ферментов: по скорости исчезновения субстрата; по скорости накопления продуктов реакции. За единицу активности любого фермента принимают такое его кол-во которое катализирует превращ-е 1мкм вещ-ва в 1 минуту. 2) В системе СИ активность выражают в каталах: (1кат.=1 моль/с) Удельная активность=мкм/мин.мг белка. В энзимологии активность фермента выражают в единицах (U) на 1 л
участок фермента в котором происходит специфическое связываение субстрата и его превращение в продукт, называется активным центром. у сложных ферм.в состав акт.центра входит кофактор. по теории фишера ключ замок по теории кошланда рука перчатка В свою очередь в активном центре выделяют два участка: 1) якорный(контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, 2)каталитический– непосредственно отвечает за осуществление реакции. этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S). 2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий. 3. Превращение переходного комплекса в комплекс фермент-продукт (E-P). 4. Отделение конечных продуктов от фермента. Типы ферментативных реакций:1. Тип "пинг-понг"– фермент взаимодействует с субстратом А, отбирая у него химические группы . Затем к ферменту присоединяется субстрат В, получающий эти химические группы. перенос аминогрупп от аминокислот на кетокислоты - трансаминирование.2. Тип последовательных реакций– к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента.3. Тип случайных взаимодействий– субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются. Ингибитор- вещество, вызывающее специфичное снижение активности фермента. два направления ингибирования: 1. по прочности связывания с ингибитором обратимым и необратимым. 2. по отношению ингибитора к активному центру фермента конкурентное и неконкурент При необратимом ингибировании происходит связывание или разрушение функциональных групп Ф.модификации подвергается активный центр. Бывают: а)Специфические (блокируют определенные группы активного центра: б) Неспецифические .являются ферментными ядами: При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента слабыми нековалентными связями, активность фермента постепенно восстанавливается. Пр.: прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре Конкурентный ингибитор похож на субстрат фермента. он соперничает с субстратом за активный центр. ингибирование сукцинатдегидрогеназ-ной реакции малоновой кислотой Неконкурентное ингибирование связано с присоединением ингибитора не в активном центре, а в другом месте молекулы с образованием неактивного комплекса, что приводит к инактивации активного центра и снижению скорости реакции. (аллостерич или токсины) ингибиторы протеаз (контрикал, гордокс) при панкреатитах – когда происходит активирование трипсина в протоках и клетках поджелудочной железы. Аллопуринол – ингибитор ксантиноксидазы,, требуется для снижения образования мочевой кислоты (подагра) Ингибитор карбоангидразы (ацетазол-амид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, и горной болезни.
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях: 1. изменением количества молекул фермента; 2.доступностью молекул субстрата и кофермента; 3.изменением каталитической активности молекулы фермента. Метаболический путь — ряд последовательных превращений вещества в организме 5. Аллостерическая регуляция.Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Аллостерический центр – центр регуляции активности фермента Присоедин регулятора к алостерич центру приводит к изменению конформации фермента и активного центра. Аллостерические ферменты обычно стоят в начале метаболических путей, Поэтому они часто называются ключевыми ферментами. Аллостерическая регуляция имеет большое значение в следующих ситуациях: -при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений; -при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. -для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). 6. Белок-белковое взаимодействие в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.пример аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона). 7. Ковалентная (химическая) модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще фосфорная кислота, реже метильные и ацетильные группы. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Выделяют 6 классов ферментов: I класс – Оксидоредуктазы овр. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота). II класс – Трансферазы переноса различных групп от одного субстрата (донор) к другому (акцептор. Коферментами являются пиридоксальфосфат, коэнзим А, метилкобаламин. трансферазы– киназы перенос фосфата от АТФ на субстрат (моносахариды, белки и др), III класс – Гидролазы разрыв внутримолекулярных связей в субстрате путем присоединения элементов Н2О.например, пепсин, трипсин. Коферменты отсутствуют. 1. Эстеразы – гидролиз сложноэфирных связей. 2. Липазы – гидролиз нейтральных жиров (триацилглицеролов). 3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты. IV класс – Лиазы разрыв С-О, С-С, C-N и других связей Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Коферментами служат пиридоксальфосфат, тиаминдифосфат, V класс – Изомеразы изомерные превращения в пределах одной молекулы.коферментам относятся пиридоксальфосфат,глутатион VI класс – Лигазы присоединение друг к другу двух молекул с использованием энергии АТФ . Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты. энзимопатологии – состояния, связанные с патологическим изменением активности ферментов. По характеру нарушения выделяют первичные и вторичные энзимопатии. Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности, фенилкетонуриясвязана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты. Алкаптонурия - нарушено окисление гомогентизиновой кислоты в тканях (катаболизм тирозина). много гомогентизиновой кислоты и выведение её с мочой. при О2 гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон, моча черная. галактоземия, недостаточность лактазы и сахаразы. Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак.Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий. ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование трипсина в протоках и клетках поджелудочной железы Аллопуринол – ингибитор ксантиноксидазы,, требуется для снижения образования мочевой кислоты (подагра) 8. Понятие о катаболизме и анаболизме и их взаимосвязи. Эндоргонические и экзергонические реакции в метаболизме. Способы передачи электронов. Особенности протекания окислительных реакций в организме. Этапы расщепления веществ и освобождения энергии (этапы катаболизма). Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. состоит из катаболизма и анаболизма Катаболизм- процесс расщепления органических молекул до конечных продуктов- СО2, Н2О и мочевина. Реакции сопровождаются выделением энергии (экзергонические реакции). Весь катаболизм условно подразделяется на три этапа: I этап. Специфический. Происходит в кишечнике или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии,она рассеивается в виде тепла. II этап.Специфический. Вещества, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) или другие. Локализация – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13%т.е. запасается в виде АТФ. III этап.Общий, неспецефический. в митохондриях. Ацетил-SКоА включается в реакции цтк и окисляется до со2. водород соединяется с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате "окислительного фосфорилирования" образуется вода и АТФ. Часть в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ. Анаболизмобъединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции). .Эндергонические и экзергонические реакции |
