1. Первичная структура белков
 Скачать 1.7 Mb. Скачать 1.7 Mb.
|
Устройство системы репарацииКаждая из систем репарации включает следующие компоненты:
Первичная структура РНК- порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. Вторичная структура РНК.Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Третичная структура РНК .Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры.Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями. (мРНК, синоним — информацио́нная РНК, иРНК) — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков[1]. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходетрансляции как матрица для синтеза белков. Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5'-кэп»шапочка для узнаваня и защиты от5нуклеаз. , 5'-нетранслируемая область Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5'-нетранслируемая область и 3'-нетранслируемая область,, регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. кодирующая (транслируемая) область, 3'-нетранслируемая область и 3'-полиадениновый «хвост». последовательность адениновых оснований Примерами вторичной структуры могут служить стебель-петля и псевдоузел тРНК — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к местусинтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». Аминокислота ковалентно присоединяется к 3'-концу молекулы с помощью специфичного для каждого типа тРНК ферментааминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий аминокислоте. (рРНК) — несколько молекул РНК, составляющих основу рибосомы. Основной функцией рРНК является осуществление процесса трансляции — считывания информации с мРНК при помощи адапторных молекул тРНК и катализ образования пептидных связеймежду присоединёнными к тРНК аминокислотами. Рибосомальные РНК (рРНК).Рибосомальные РНК имеют многочисленные спирализованные участки. Различают рРНК - 5S, 5,8S, 28S и 18S (S - коэффициент седиментации). Рибосомальные РНК содержат несколько модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2'-метилрибоза). рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков. в транскрипции выделяют 5 необходимых элементов: 1)матрица – одна из цепей ДНК, 2)растущая цепь – РНК, 3)субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ), 4)источник энергии – УТФ, ГТФ, ЦТФ, АТФ. 5)ферменты РНК-полимеразы и белковые факторы транскрипции. Стадии транскрипции.Выделяют три стадии транскрипции: инициация, элонгация и терминация. Инициация.Промотор содержит стартовый сигнал транскрипции – ТАТА-бокс. Он связывает 1 факторинициации тата-фактор.Этот ТАТА-фактор обеспечивает присоединение РНК-. Для связывания РНК-полимеразы с промотором необходим– σ-фактор, но сразу после синтеза затравочного фрагмента РНК (длиной 8-10 рибонуклеотидов) σ-фактор отрывается от фермента.Другие факторы инициации раскручивают спираль ДНК перед РНК-полимеразой. Элонгация.Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетают молекулу. РНК-полимераза продвигается в направлении 5'→3'. Фермент использует АТФ, ГТФ, ЦТФ, УТФ одновременно в качестве субстрата и в качестве источника энергии. Терминация.РНК-полимераза остановится, когда достигнет терминирующих кодонов. С помощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ – "ро"), от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая является первичным транскриптом, предшественником мРНК или тРНК или рРНК. Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг. РНК включают в себя информативные (экзоны) и неинформативные (интроны) участки. 1. Сплайсинг– особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов. Состоят из двух разделяемых субчастиц, или рибосомных субъединиц. При определенных условиях Р. обратимо диссоциирует на две субчастицы с соотношением их мол. масс ок. 2:1. Эукариотическая Р. разделяется на субчастицы 60S и 40S. Две рибосомные субчастицы объединены в полную Р. строго определенным образом, предполагающим специфич. контакты их поверхностей. Полисома - Временный комплекс (4-5 и более) рибосом, транслирующих одновременно одну молекулу мРНК. Каждой трнк соответсвует своя аминокислота и за связывание эфирной связью отвечает свя аминоацил-трнк-синтетаза Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения - аминоацил-АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК
Генетический (биологический) код– это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода четырехзначного языка нуклеотидов (А, Г, У, Ц) в двадцатизначный язык аминокислот. Он обладает характерными особенностями: Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон. Специфичность(или однозначность) – каждому кодону соответствует только одна аминокислота. Вырожденность– одной аминокислоте может соответствовать несколько кодонов. Универсальность– биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения). Колинеарность– последовательность кодонов соответствует последовательности аминокислот в кодируемом белке. Неперекрываемость– триплеты не накладываются друг на друга, располагаясь рядом. Однонаправленность– при синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад. адапторная роль тРНК заключается: 1.в специфичном связывании с аминокислотами, 2.в специфичном, согласно кодон-антикодоновому взаимодействию, связывании с мРНК, 3.и, как результат, во вклТрансляция– этобиосинтез белкана матрице мРНК. ючении аминокислот в белковую цепь в соответствии с информацией мРНК.\ основные компоннты белоксинтез системы -Аминокислоты Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. -Аминоацил-тРНК синтетазы -Рибосомы В 40S субъединицу входит рРНК с константой седиментации 18S и 33 молекулы белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и 49 различных белков. -Белковые факторы Эти белки связываются с рибосомой или её субъединицами на определённых стадиях процесса и стабилизируют или облегчают функционирование белоксинтезирующей машины. Инициация.Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина. В начале этой стадии формируются два тройных комплекса: первый комплекс– мРНК + малая субъединица + ИФ-3, второй комплекс– метионил-тРНК + ИФ-2 + ГТФ. После формирования тройные комплексы объединяются с большой субъединицей рибосомы После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК Первый цикл (и следующие циклы) элонгации включает три шага: 1.Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ. Терминация.Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют: 1)Гидролитическое отщепление полипептида от конечной тРНК. 2)Отделение от П-центра последней, уже пустой, тРНК. 3)Диссоциацию рибосомы. Источником энергии для завершения трансляции является ГТФ. Далее процессинг 1. Удаление с N-конца метионина 2. Образование дисульфидных мостиков между остатками цистеина. 3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином или протеолитическими ферментами ЖКТ. 4. Присоединение химической группы к аминокислотным остаткам белковой цепи: фосфорной кислоты карбокси группы метильной гидроксильной 5. Включение простетической группы: Гемма углеводных остатков Фолдинг белков – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру.
Предложены две схемы регуляции скорости транскрипции: по механизму индукции (лактозный оперон) и по механизму репресии (триптофановый оперон).Лактозный оперонв целом отвечает за катаболизм лактозы. При изучении E.coli было замечено, что в клетке может быть две взаимоисключающие ситуации: -активность одного из ферментов катаболизма лактозы низка, если в среде имеется глюкоза. -активность этого фермента резко повышается в обратной ситуации, т.е. при отсутствии глюкозы и при наличии лактозы.На основании наблюдений была предложена схема регуляции оперона по механизму индукции: 1. В отсутствие лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются. 2. Если глюкозы нет, а лактоза есть, то последняя связывается с белком-репрессором и ингибирует его, не давая связаться с геном-оператором. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез ферментов катаболизма лактозы, и синтезировать мРНК. Т.о., лактоза является индуктором транскрипции. Триптофановый оперонв целом отвечает за синтез триптофана.Функционирование триптофанового оперона в некотором смысле противоположно лактозному. Регуляцияосуществляется по механизму репрессии. 1. В отличие от лактозного оперона, белок-репрессор синтезируется в неактивном состоянии и не может заблокировать транскрипцию генов, кодирующих ферменты синтеза триптофана. Синтез этой аминокислоты будет в клетке продолжаться до тех пор, пока в питательной среде не появится триптофан. 2. Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. В этом случае триптофан является репрессором транскрипции. Регуляция у эукариот 1. Амплификация– это увеличение количества генов, точнее многократное копирование одного гена. Естественно, все полученные копии равнозначны и одинаково активно обеспечивают транскрипцию. 2. Энхансеры– это участки ДНК в 10-20 пар оснований, способные значительно усиливать экспрессию генов той же ДНК. В 3. Сайленсеры– участки ДНК, в принципе схожие с энхансерами, но они способны замедлять транскрипцию генов, связываясь с регуляторными белками (которые ее активируют). 5. Процессинг мРНК– некоторые пре-мРНК подвергаются разным вариантам сплайсинга в результате чего образуются разные мРНК, и соответственно, белки с разной функцией. 6. Изменение стабильности мРНК– чем выше продолжительность жизни мРНК в цитозоле клетки, тем больше синтезируется соответствующего белка. Лекарственная регуляция транскрипции Ингибирование. 1. доксорубицин, дауномицин и актиномицин встраиваться между соседними парами оснований Г-Ц. В результате возникает препятствие для движения РНК-полимеразы остановка транскрипции.. 3. α-Аманитин, октапептид бледной поганки (Amanita phalloides) блокирует РНК-полимеразу II эукариот и предотвращает продукцию мРНК. Многие вещества обладают способностью связываться с элементами рибосом или другими факторами трансляции. Некоторые из этих веществ используются в качестве лекарственных средств, которые в состоянии действовать на разных уровнях трансляции, например: интерферон активирует внутриклеточные протеинкиназы, которые, в свою очередь, фосфорилируют белковый фактор инициации ИФ-2 и подавляют его активность. стрептомицин присоединяется к малой субъединице и вызывает ошибку считывания первого основания кодона. тетрациклины блокируют А-центр рибосомы и лишают ее способности связываться с аминоацил-тРНК, левомицетин связывается с 50S-частицей рибосомы и ингибирует пептидил-трансферазу,
Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями. Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. 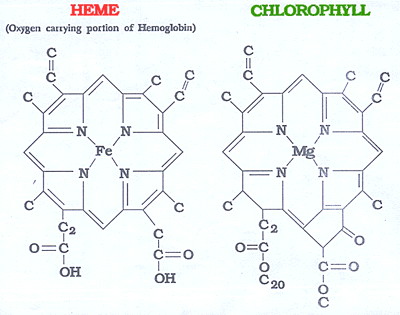 Синтез белковой части (глобина) происходит обычным путем на рибосомах. Для образования гема требуются: железо, глицин, сукцинил-КоА, витамины В6, В12 и фолиевая кислота. 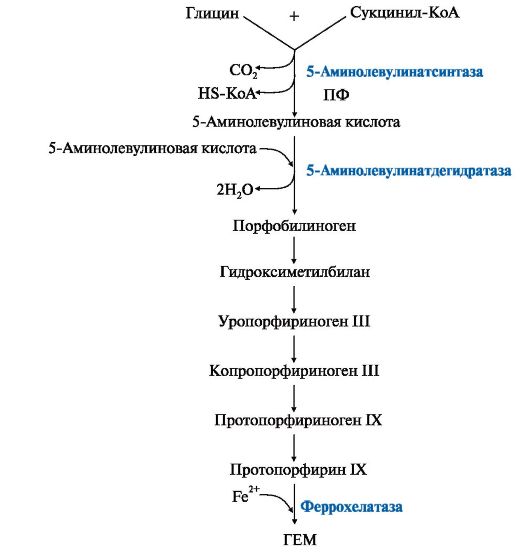 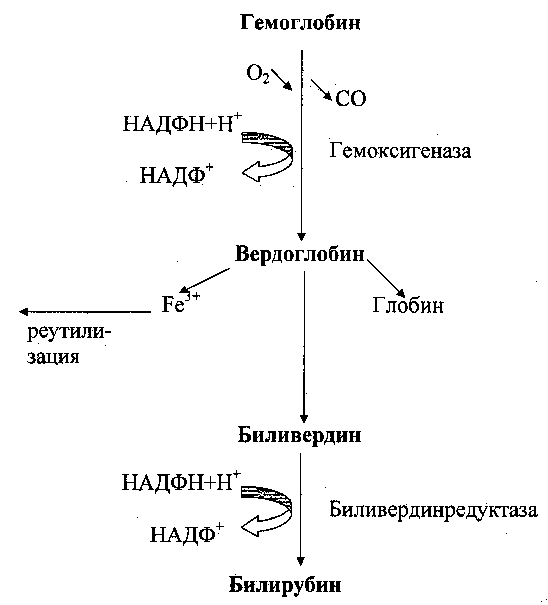 Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина Билирубин – токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани. Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы , в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой Далее попадает по желчным протоам в к иечник где блягодаря микрофлоре превращается в мезоилирубин и мезобилиноген(уробилиноген, часть уробилиногена всасывается и попадает обратно в печень а часть окисляется до стеркобилиногена и окрашивает кал Различают:
Кроме того, выделяют физиологическую желтуху новорожденных и гемолитическую болезнь новорожденных. Недостаток глюкуронилтрансферазы и повышенное содержание свобоного билирубина нужен фенобарбитал.
|
