1. Первичная структура белков
 Скачать 1.7 Mb. Скачать 1.7 Mb.
|
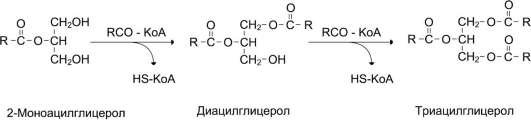
Липиды– органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге. Функции: 1. Резервно-энергетическаяфункция. 9,3 кКал Е. Является резервом эндогенной воды 1,7г воды 2. Структурная функция.Мембраны клеток состоят из фосфолипидов, обязательным компонентом являются гликолипиды и холестерол. 3.Сигнальная функция.Гликолипиды выполняют рецепторные функции и задачи взаимодействия с другими клетками. 4. Защитная функция. жир 5. Необходимы для растворения и всасывая жирорастворимых витаминов (А, Е, D,K,Q) 6. Являются предшественниками других соединений: глицерин испол-ся на синтез глюкозы, жирные к-ты окисляются до ацетилКоА и могут быть использованы на образование ацетилхолина) 7. Специфические функции: обеспечивают устойчивость эритроцитов, ганглиозиды связывают различные токсины и яды. 80-100 г в сутки жира должно быть Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием «липазы языка» . 1. Эмульгированиежиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу. используется процесс эмульгирования, когда гидрофобные молекулы (ТАГ, эфиры ХС) погружаются внутрь мицеллы, а гидрофильные остаются на поверхности, обращенной к воде 2. Гидролизтриацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ. Переваривание жиров - гидролиз жиров панкреатической липазой и колипазой. рн8 3. Образование мицелл В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, жирные кислоты и свободный холестерол, формирующие мицеллы. Свободный глицерол всасывается прямо в кровь. 4. Всасывание мицелл.. всасываются. 1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь просто.Глицерол тоже всасывается напрямую. 2. Другие продукты переваривания (жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Через водную фазу мицеллы мигрируют к каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты проникают внутрь клетки, после чего транспортируются в эндоплазматический ретикулум. Желчные кислоты остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта. 5. Ресинтезтриацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах. Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирных кислот: HS КоА + RCOOH + АТФ → R-CO |
| 22. | Окисление глицерина и высших жирных кислот. Последовательность реак ций. Связь β-окисления с циклом Кребса и дыхательной цепью. Физиоло гическое значение окисления жирных кислот в зависимости от ритма пита ния и мышечной активности. |
Этапы окисления жирных кислот:1. активироваться в цитозоле.
RCOOH + HSKoA + АТФ → RCO КоА + АМФ + PPi.
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану,и он заходит в комплексе с карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
3. После св-ия с карнитином ж к-та переносится ч/з мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь обр-ет ацил-S-КоА вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически.
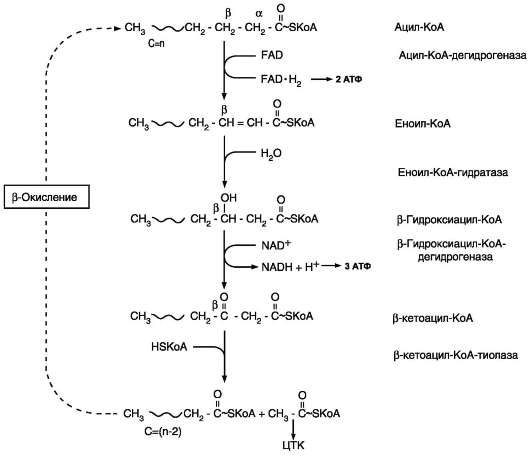
образовавшийся фадН2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ
Восстановленный NADH,окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ
Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA →
| |
8 CH3-CO-KoA + 7 FADH2 + 7 (NADH + H+).131-2 на активацию жк=129атф
Глицерин– трехатомный спирт, водорастворим и легко всасывается из кишечника и по воротной вене поступает в печень.Окисление глицерина
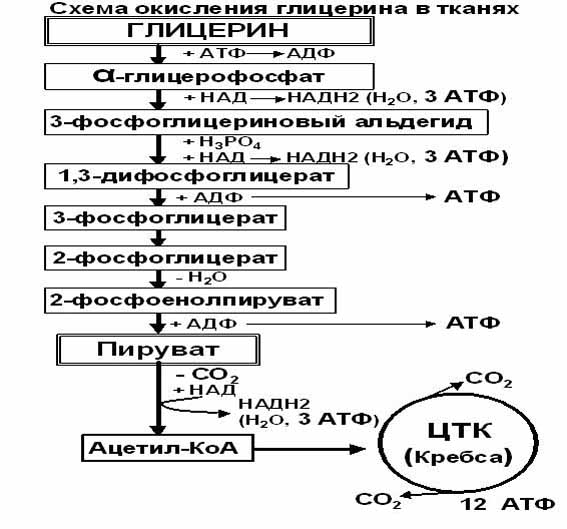 Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты.
Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты. Е значение в-окисление имеет для скелетных мышц (50% Е), для сердечной мышцы (70%), головной мозг и другие нервные ткани, а также эритроциты не используют жирные к-ты для окисления; они не поступают в головной мозг, т.к. не проходят ч/з гематоэнцефалический барьер.
Физиоло гическое значение окисления жирных кислот в зависимости от ритма пита ния и мышечной активности.
| 23. | Липолиз и липогенез. Значение. Зависимость липогенеза от ритма питания и состава пищи. Регуляция липолиза и липогенеза. Транспорт и использо вание жирных кислот, образующихся при мобилизации жира. |
Липолиз— это расщепление жира до глицерина и ЖК. Катализируется триглицеридлипазой, диглицеридлипазой и моноглицеридлипазой. Триглицеридлипаза является лимитирующим ферментом липолиза. Она имеет две формы: фосфорилированIную (активную) и нефосфорилированную (неактивную).
Превращение неактивной формы в активную происходит под влиянием протеинкиназы. Протеинкиназа, в свою очередь, активируется в результате присоединения к ее аллостерическим цен трам цАМФ.Регуляция липолизапроисходит под действием гормонов.Активируют липолиз:катехоламины, глюкагон, СТГ, АКТГ, ти роксин, липотропин гипофиза, цАМФ.Ингибирует липолизинсулин.Липогенез —это синтез жира. Для синтеза жира необходи мы глицерин и ЖК в активных формах. Активной формой глицерина является 3-фосфоглицерол (α-глицерофосфат), ЖК - ацил-КоА.
В жировой ткани 3-фосфоглицерол образуется из ДОАФ (ме таболит гликолиза) путем гидрирования под действием глицерофосфатдегидрогеназы с затратой НАДН. В печени и поч ках 3-фосфоглицерол образуется путем фосфорилирования гли церина под действием глицеролкиназы с затратой АТФ.Ацил-КоА образуется при взаимодействии ЖК НSКоА с затратой АТФ под влиянием ацил-КоА-синтетазы. Сборка триглицерида происходит из 3-фосфоглицерола и ацилов-КоА под действием ацилтрансферазы.Ингибируютлипогенез КА, СТГ, ЙТ, АКТГ, АДФ.Активируют— инсулин, эстрогены и АДФ.
| 24. | Биосинтез жирных кислот: последовательность реакций, физиологическое значение, регуляция. |
1. Образование ацетил-КоА и его транспорт в цитозоль( на схеме начинать с оксолацетата справа!!! заканчивать оксолацетатом слева)
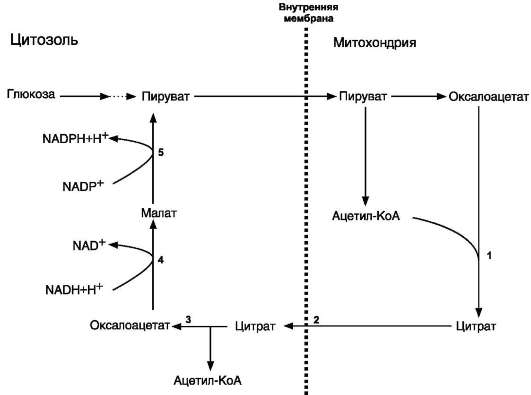
1 - цитрат-синтаза; 2 - транслоказа; 3 - цитратлиаза; 4 - малатдегидрогеназа; 5 - малик-фермент.
2. Образование малонил-КоА из ацетил-КоА (ацетил-КоА-кар-боксилаза)
После образования малонил-КоА синтез жирных кислот продолжается на мультифер-ментном комплексе - синтазе жирных кислот (пальмитоилсинтетазе)он последовательно удлиняет радикал жирной кислоты на 2 углеродных атома, донором которых служит малонил-КоА. Конечный продукт работы этого комплекса - пальмитиновая кислота
Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА имеет следующий вид:(7 циклов)
CH3-CO-SKoA + 7 HOOC-CH2-CO-SKoA + 14 (NADPH + H+) → C15H31COOH + 7 CO2 + 6 H2O + 8 HSKoA + 14 NADP+.
Регуляторный фермент синтеза жирных кислот - ацетил-КоА-карбоксилаза. Этот фермент регулируется несколькими способами.
| |
Основной продукт элонгации в печени - стеариновая кислота (С18:0),
Включение двойных связей в радикалы жирных кислот называется деса-турацией. Основные жирные кислоты, образующиеся в организме человека в результате десатурации - пальмитоолеино-вая (С16:19) и олеиновая (С18:1Δ9).
Для образования двойной связи в радикале жирной кислоты требуется молекулярный кислород, NADH, цитохром b5 и FAD-зави-симая редуктаза цитохрома b5. Атомы водорода, отщепляемые от насыщенной кислоты, выделяются в виде воды. Один атом молекулярного кислорода включается в молекулу воды, а другой также восстанавливается до воды с участием электронов NADH, которые передаются через FADH2 и цитохром b5.
Регул:Ассоциация/диссоциация комплексов субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы, каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат; он стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА; он вызывает диссоциацию комплекса и снижение активности фермента
| 25. | Пути образования и использования ацетил-КоА. Биосинтез и значение ке тоновых тел. Пределы изменений концентрации кетоновых тел в крови в норме, при голодании и сахарном диабете. |
АцетилКоА- это центральный метаболит липидного обмена.
Источники: 1)Глюкоза 2)глицерин 3)АК (при кратковременной напряженной мышечной работе) 4)Жирные к-ты (в-окисление при длительной мышечной работе, голодании, на холоде, при беременности и сахарном диабете).
Пути использования образовавшегося ацетилКоА зависят от функционального состояния клетки и ее специфики. Если в кл достаточно АТФ, то он используется на синтез ж к-т,т.к. АТФ активирует ключевой фермент ситеза ж к-т, а их накопление стимулирует синтез жира. Распад жира тормозится и в-окисление при этом тоже тормозится. Напряженная мышечная работа, стресс, увел-ие секреции катехоламинов активирует липолиз, в-окисление ж к-т; в этом случае актив-ся синтез кетоновых тел и ЦТК.
Пути использования: 1. окисляется в цикле Кребса(90%); 2.используется в синтезе ЖК (9%) 3. Образование В-гидрокси-в-метилглутарилКоА (а из него либо холестерин, либо кетоновые тела -1%)
К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон.
Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления.
В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное кетоновое тело в крови - именно β-гид-роксибутират.
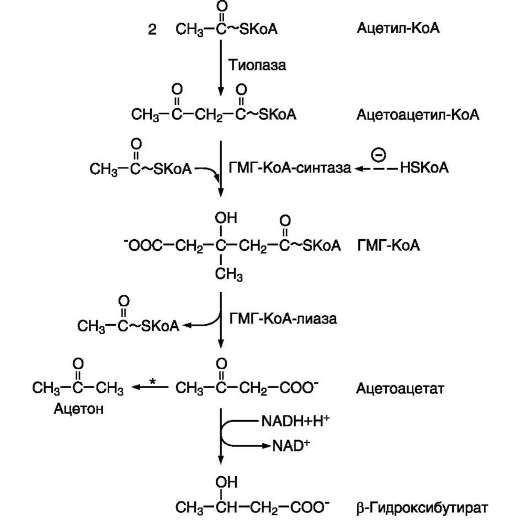
Диктовать реакциями!
• ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови
• ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А.
• Если поступление жирных кислот в клетки печени уменьшается, то увеличивается концентрация свободного КоА,ингибирующего фермент.
В норме в крови кол-во КТ 1-3 мг, в моче 40мг. При сахарном диабете 10-50 мг в моче. Накопление кетоновых тел в организме называется кетозом.Он сопровождается кетонемией и кетонурией. Физиологиеский кетоз – при голодании, тяжелой мышечной работе, у новорожденных. Патологический – при сахарном диабете.
При тяжелых формах сахарного диабета до 20 ммоль/л.. накопление кт приводит к сдвигу pH в кислую сторону. Кетоацидоз
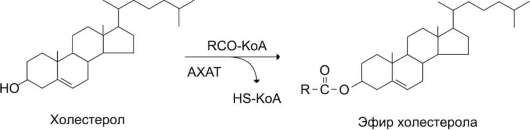
| 26. | Синтез холестерина, регуляция. Биологическое .значение холестерина. Атеросклероз. Факторы риска для развития атеросклероза. |
холестерин (Холестерол) представляет собой одноатомный спирт
.Биосинтез холестеролапроисходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий из митохондрий в составе цитрата. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН
3. После объединения трех молекул изопентенилдифосфата синтезируется фарнезилдифосфат.
4. Синтез скваленапроисходит при связывания двух остатков фарнезилдифосфата.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Диктовать реакциями!!
Регуляция синтеза.Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза,
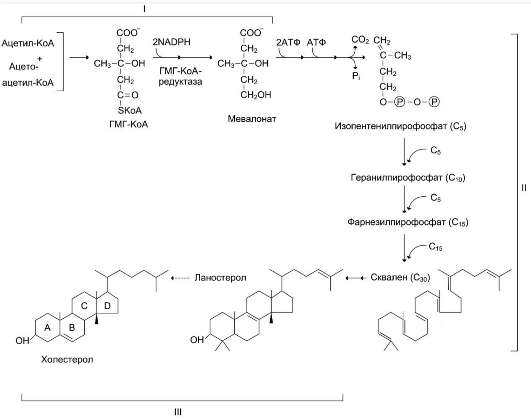
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент ингибируется конечным продуктом реакции – холестеролом.
2. Ковалентная модификация при гормональной регуляции: инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
Биологическая роль:
1)В печени из него синт-ся желчные к-ты, необходимые для эмульгирования жира, активации липазы и всасывания переваренных продуктов;
2)Под действием УФ-лучей в подкожной жировой клетчатке обр-ся витамин Д;
3) В эндокринных железах из холестерина образуются в коре надпочечников ГКС, минералокортикоиды, слабые эстрогены и андрогены
4)Холестерин входит в состав всех плазматических мембран
Атеросклероз– это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка
1обрат стадия – повреждение эндотелия На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости
2обрат стадия – стадия начальных изменений. модификация липопротеинов в зоне воспаления,
3необрат стадия – стадия поздних изменений. проявл-ся как выступание поверхности в просвет сосуда.
4необрат стадия – стадия осложнений. и возможно разрыв сосуда.
К факторам риска относят: высокое содержание холестерина в крови; наличие сахарного диабета, гипертонии, ожирения; курение, наследственность, пожилой возраст, мужской пол.
| 27. | Транспортные липопротеиды крови: особенности строения, состава и функций разных липопротеидов. Роль в обмене жиров и холестерина. Пре делы изменений концентрации жиров и холестерина в крови. Патология липидного обмена. |
липиды являются гидрофобными молекулами и они транспортируются в крови в составе– липопротеинов.
Поверхность липопротеиновой частицы гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Белки в липопротеинах обычно называются апобелками
Липопротеины очень низкой плотности:
-синтезируются в печени из эндогенных и экзогенных липидов,
-8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов
-в норме концентрация 1,3-2,0 г/л,
Функция:Транспорт ТАГ от печени в ткани, запасающие и использующие жиры
Метаболизм:
3. Аналогично хиломикронам, на эндотелии капилляров ЛПОНП подвергаются воздействию липопротеинлипазы,с образованием свободных жирных кислот и глицерина. Жирные кислоты перемещаются в клетки органов , либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани.
4. Остаточные ЛПОНП либо эвакуируются в гепатоциты посредством эндоцитоза, либо после воздействия на них печеночной ТАГ-липазы превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП).
Липопротеины низкой плотности:
Образуются в крови. Состоят из 25% белка и 75% липидов. является холестерин примерно50%. На клеточных мембранах имеются рецепторы для ЛПНППосле узнавания проникают в клетки путем эндоцитоза, там распадаются под действием ферментов гидролаз в лизосомах. холистерин идёт на построение мембран и метаболические нужды клеток. Функция: транспорт холестерина в ткани, в том числе в печени.
Липопротеины высокой плотности (ЛПВП или а-липопротеины):
Состав: 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. В поверхностном слое ЛПВПобразуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ)Далее он транспортируется в печень, где холестерин исп-ся на синтез желчных к-т. ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеидов и транспортируют его в печень, предотвращая накопление его в клетках.
ЛПОНП и ЛПНП считают атерогенными, то есть вызыва¬ющими атеросклероз. ЛПВП — антитиатерогенными.
Повышение липопротеидов называется гиперлипопротеидемией.
Атеросклероз-это патология, которая характеризуется отложением, холестерина в стенке крупных сосудов с образованием вначале пятен, полосок. Затем на их месте образуются утолщения . вокруг него развивается соединительная ткань, затем наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение ткани, а на месте бляшек могут возникать тромбы.
Болезнь Вольмана– аутосомно-рецессивное заболевание из-за дефекта кислой эстеразы лизосом, что обусловливает накопление эфиров холестерола в лизосомах печени, селезенки, надпочечников, костного мозга и тонкого кишечника. Больные умирают в возрасте до 6 мес
.Болезнь Шюллера-Кристиана аутосомно-рецессивное заболевание характеризуется отложением в плоских костях, твердой мозговой оболочке и коже холестерола и его эфиров. Течение заболевания прогрессирующее. Дефектный фермент неизвестен.
| 28. | Функции пептидов и белков. Суточная потребность в белках. Переварива ние белков. Регуляция переваривания белков. Патология переваривания и всасывания белков. |
1.Структурная.
2.Ферментативная.
3.Гормональная. инсулин и глюкагон.
4.Рецепторная.
5.Транспортная
7.Сократительная. (тубулин, актин, миозин).
8.Защитная. иммуноглобулины крови, белки свертывающей системы
100-120 г белков в сутки.
Пепсин образуется главными клетками желудка в виде препепсина. расщепляет(фенилаланина, тирозина и триптофана). Пепсин действует в сильно кислой среде при рН 1,5 - 2,5.
Гастриксин образуется в желудке, (глутамата и аспартата), действует при рН 3,5.
Трипсин образуется в поджелудочной железе в виде претрипсина. Активируется энтеропептидазой кишечника.действует на связи аргинина или лизина.
Химотрипсин образуется в поджелудочной железе в виде прехимотрипсина. Активируется под действием трипсина. Расщепляет связи, образованные карбоксильными группами ароматических аминокислот.
Эластаза образуется в поджелудочной железе, расщепляет связи образованные пролином.
Коллагеназа образуется в поджелудочной железе, расщепляет коллаген.
Карбоксипептидаза образуется в поджелудочной железе, активируется трипсином, отщепляет аминокислоты с С-конца,.
Аминопептидаза образуется в кишечнике, отщепляет аминокислоты с N-конца.
Дипептидазы образуются в кишечнике и расщепляют дипептиды.
В результате действия вышеперечисленных пептидаз белки расщепляются до аминокислот, которые всасываются стенкой кишечника путем активного транспорта с использованием специфических переносчиков, витамина В6 и АТФ. Через воротную вену аминокислоты попадают в печень.
Роль НСl
- необходима для превращения препепсина в пепсин;
- создает оптимум рН для работы пепсина;
- способствует денатурации и набуханию пищевых белков;
Различают
первичные (при различных формах патологии желудка и кишечника — хронических гастритах, язвенной болезни, раке) и вторич¬ные или функциональные расстройства секреторной и всасывательной функции эпителия в результате отека слизистой оболочки желудка и ки¬шечника, нарушения. причины недостаточного расщепления белков —уменьшение секреции соляной кислоты и ферментов, снижение активности протеолитических ферментов и связанное с этим недостаточное образование аминокислот, ускорение перистальтики. если мало НСЛ то низкое пн и белки набухшие послабление. белки переходят из желудка в двенадцатиперстную кишку в неизменном состоянии, что затрудняет действие трип¬сина, химотрипсина и других протеолитических ферментов кишечника.
| 29. | Источники аминокислот и пути их использования. Заменимые и незамени мые аминокислоты. Биосинтез заменимых аминокислот с использованием глюкозы. Источники азота для аминокислот. Глюконеогенез из аминокислот: регуляция, физиологическое значение. |
Источники аминокислот
Переваривание пищевых белков в ЖКТ.
Расщепление клеточных белков лизосомальными пептидазами (катепсинами).
Синтез из других аминокислот.
Образование из безазотистых соединений (прежде всего из кетокислот).
Пути использования аминокислот
Синтез белков (это основной путь использования аминокислот).
Синтез биологически важных соединений (пуринов, пиримидинов, гормонов, порфиринов и других).
Дезаминирование аминокислот с образованием кетокислот, которые могут:
- окисляться в цикле Кребса,
- использоваться в ГНГ на синтез глюкозы,
- превращаться в кетоновые тела.
незаменимыми. К ним относят фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
заменимыми. К ним относят глицин, аспарагиновую кислоту, аспа-рагин, глутаминовую кислоту, глутамин, серин, пролин, аланин. аргинин и гистидин тирозин и цистеин
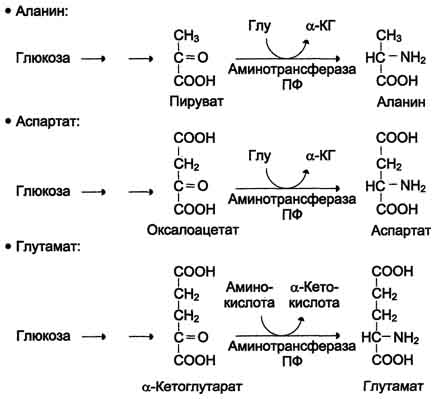
К глюкогенным относятся аминокислоты (их большинство), при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат.
Из гликогенных амиокислот синтезируется глюкоза
аминокислоты с разветвленными боковыми цепочками, частично преобразутся в аминокислотный аланин, В цикле преобразования глюкозы аминокислоты с разветвленной цепочкой являются донорами химических групп для пируватов с последующим образованием аланина. Преобразуясь в глюкозу, аминокислоты участвуют в работе цикла трикарбоновых кислот, вырабатывающего энергию в мышцах.
регуляция:пируват карбоксилаза
В отсутствие ацетил-КоА ферментпочти полностью лишен активности.
Регуляция:Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
| 30. | Декарбоксилирование аминокислот. Его сущность. Декарбоксилирование гистидина, серина, цистеина, орнитина, лизина и глутамата. Роль биогенных аминов в регуляции метаболизма и функций. |
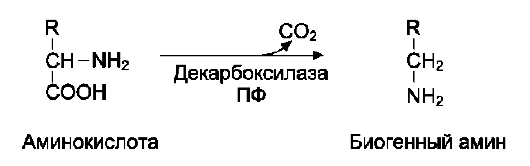
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования
образующиеся продукты реакции – биогенные амины – функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).катализируются– декарбоксилазами аминокислот. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ).
декарбоксилирование гистидина
гистамин стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
сокращает гладкую мускулатуру лёгких, вызывает удушье;
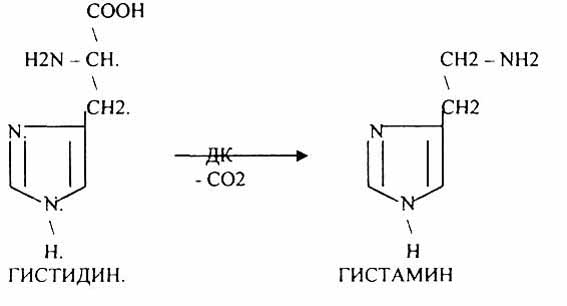
2.Этаноламин образуется при декарбоксилировании серина. Используется для синтеза холина, ацетилхолина, фосфолипидов (фосфатидилэтаноламина, фосфатидилхолина).
NH2-CH(CH2OH)-COOH NH2-CH2(CH2OH)
декарбоксилирование цистеина меркаптоэтиламин который входит в состав КоА.
COOH-CH(SH)-NH2
5.декарбоксилирование орнитина приводит к путресцину H2N(CH2)4NH2
В тканях организма путресцин — исходное соединение для синтеза двух физиологически активных полиаминов — спермидина и спермина. Спермин ассоциируется с нуклеиновыми кислотами и предположительно участвует в стабилизации их спиральной структуры, в частности, у вирусов
лизин-кадаверин Из них об¬разуются полиамины.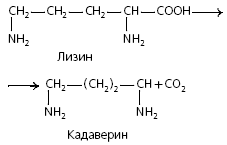
Глутамат-гамма амино масляная кислота. ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором.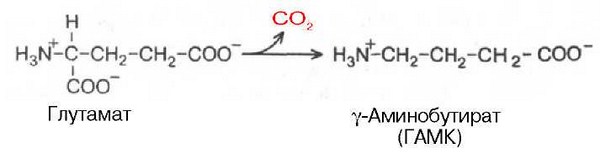
| 31. | Трансаминирование аминокислот. Специфичность аминотрансфераз. Значение реакций трансаминирования. Непрямое дезаминирование аминокис лот: последовательность реакций, ферменты, биологическое значение. |
Значение реакции переаминирования
1. Коллекторная функция, то есть аминогруппы от многих аминокислот собираются в одной форме в виде глутамата;
2. Является источником заменимых аминокислот;
3. В ходе этой реакции аминокислоты превращаются в кетокислоты, которые могут окисляться в цикле Кребса, использоваться в ГНГ или превращаться в кетоновые тела.
4. Аминотрансферазы – фермент , который содержится только в клетках при появлении его в крови можно говорить о некрозах. Аспартатаминотрансфераза-сердце, аланин…-печень
Трансаминирование - реакция переноса а-аминогруппы с аминокислоты на α-кетокисло-ту, в результате чего образуются новая кетокисло-та и новая аминокислота.(меняются местами радикалы)
Реакции катализируют ферменты аминотранс-феразы, коферментом которых служит пиридок-сальфосфат (ПФ) - производное витамина В6
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глу-тамат, аланин, аспартати соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат
Сначала должен образоваться глутамат и потом уже новая аминокислота
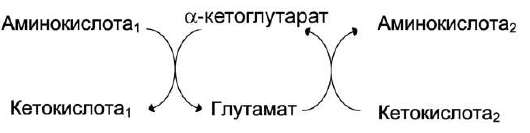
СООН-СО-СН2-СН2-СО-СООН- кетоглутарат .
СООН-СН(NH2)-CH2-CH2-CO-COOH глутамат
СН3-СН(NH2)-СООН аланин
COOH-CH2-CH(NH2)-COOH аспартат
СН3СОСООН, пируват
(HO2C-C(O)-CH2-CO2H) оксолацетат
Непрямое дезаминирование, необходимо потому что Большинство аминокислот не способно де-заминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглу-тарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию.
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегид-рогеназы (кофермент NAD+).
Можно выделить 4 стадии процесса:
• трансаминирование с α-кетоглутаратом, образование глутамата;
• трансаминирование глутамата с оксалоаце-татом (фермент АСТ), образование аспар-тата;
• реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
• гидролитическое дезаминирование АМФ. Перенос аминогруппы от аспартата и синтез
| 32. | Образование и пути использования аммиака. Биосинтез мочевины: после довательность реакций, регуляция. Гипераммониемия. |
Источники аммиака и пути его обезвреживания
Основные источники аммиака:
1.неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
2.окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
3.дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
4.катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
5.жизнедеятельность бактерий толстого кишечника,
6.распад пуриновых и пиримидиновых оснований – во всех тканях.
. Содержание аммиака в крови в норме 25-40 мкмоль/л.
- используется на восстановительное аминирование (имеет небольшое значение);
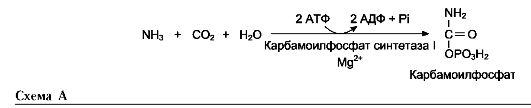
- используется на образование амидов (аспарагина и глутамина), которые поступают в кровь и переносятся в печень и почки, где под действием глутаминазы и аспарагиназы соответственно расщепляются до глутамата или аспартата и аммиака. В печени аммиак используется на образование карбамоилфосфата, из почек аммиак выводится в виде аммонийных солей с мочой.
- в мышцах аммиак используется на образование аланина, который в печени превращается в пируват, используемый в ГНГ для синтеза глюкозы. Образовавшаяся глюкоза поступает в кровь и переносится в мышцы, где превращается в пируват в ходе гликолиза. существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата: синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком.
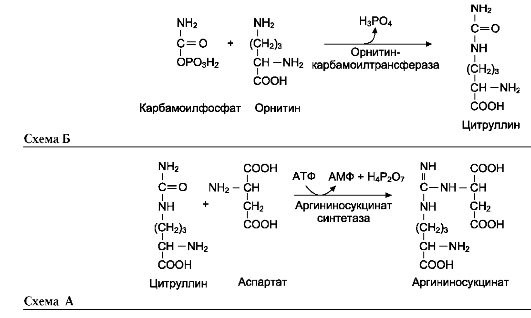
ОРНИТИНОВЫЙ цикл
Далее фермент аргининосукцинатлиаза (арги-ниносукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина
Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина.
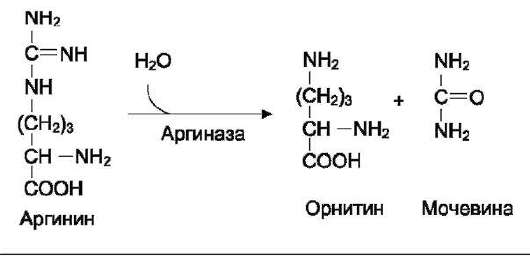
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращении
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3РО4) + АМФ + Н4Р2О7
Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой.
Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
Гипераммониемия сопровождается появлением следующих симптомов:
• тошнота, повторяющаяся рвота;
• головокружение, судороги;
• потеря сознания, отёк мозга (в тяжёлых случаях);
• отставание умственного развития (при хронической врождённой форме).
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион
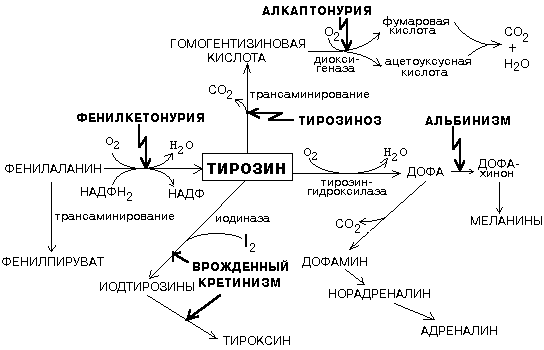
| 33. | Обмен фенилаланина и тирозина. Наследственные нарушения обмена фенилаланина и тирозина. Значение серина, глицина и метионина. |
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина.
1. Метаболизм фенилаланина
Основное количество фенилаланина расходуется по 2 путям:
• включается в белки;
• превращается в тирозин. Превращение фенилаланина в тирозин прежде
Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в
синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и катаболизируется до СО2 и Н2О.
Начинать слева с фенилаланина! Диктовать обе таблицы полностью
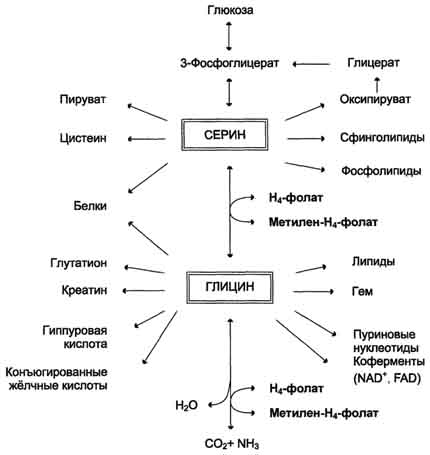
Метионин
-удаляет из печени избытки жира благодаря спосоности отдавать метил группу
-способствует синтезу холина
-участвует в синтезе адреналина креатина
-обезвреживает токсичные продукты-способствует снижению содержания холестерина в крови
| 34. | Синтез креатина: последовательность реакций, значение креатинфосфата. Физиологическая креатинурия. Значение креатинкиназы и креатинина в диагностике. |
Креатин - это небелковое азотсодержащее соединение, в образовании которого участвуют печень и почки. Процесс начинается в почках, где из глицина и аргинина образуются гликоциамин (гуанидиноацетат) и орнитин. Орнитин используется в синтезе мочевины. Гликоциамин поступает в кровь и переносится в печень, где он метилируется при участии S-аденозилметионина, превращаясь в креатин, который поступает в мышцы. Когда мышца находится в состоянии покоя, креатин под действием креатинкиназы и при участии АТФ превращается в креатинфосфат - запасной макроэрг. При мышечном сокращении фосфат с креатинфосфата переносится под действием креатинкиназы на АДФ с образованием АТФ.
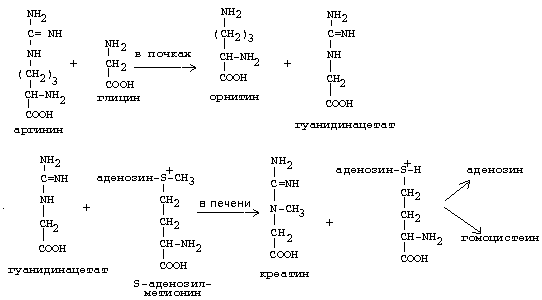
Креатинурия — повышенное выделение с мочой креатина (см.). Патологическая креатинурия наблюдается при поражениях мышц и состояниях, сопровождающихся повышенным распадом белка: голодании, ожогах, острых лихорадочных заболеваниях, диабете, гипертиреозе. Физиологическая креатинурия может наблюдаться у детей и у женщин в период беременности.
Активность креатинкиназы значительно увеличена при всех типах мышечной дистрофии. Высокие значения активности фермента в сыворотке наблюдаются при вирусных миозитах, полимиозитах, инфаркте
Острые или хронические нарушения функции почек любой этиологии (заболевание собственно почек, нарушение перфузии почек, обтурация мочевых путей).
Акромегалия и гигантизм.
Гипертиреоз.
Мясная диета.