1. Первичная структура белков
 Скачать 1.7 Mb. Скачать 1.7 Mb.
|
часть внутренней энергии(Е) которая используется для совершения полезной работы-свободная энергия(G), а изменение свободной энергии системы ΔG.
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота. Наиболее распространены следующие рабочие названия оксидоредуктаз: 1. Дегидрогеназы–дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. 2.Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами. 3. Оксидазы окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата. 4. Монооксигеназы внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 5. Диоксигеназы–внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 6. Пероксидазы–реакции с пероксидом водорода в качестве акцептора электронов. Первичные акцепторы водорода ОВР относят к 2 типам дегидрогеназ: никотин-амид-зависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина. Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+,NAD+и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид . Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+.ни катализируют реакции типа: R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+. NADPH не является непосредственным донором электронов в ЦПЭ, а используется почти исключительно в восстановительных биосинтезах. 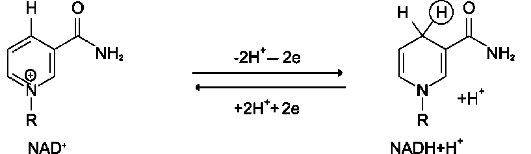 Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2. Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит сопряжённая циклическая система. FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента. В цикле Кребса FAD является простетической группой фермента сукцинатдегидрогеназы, которая окисляет сукцинат дофумарата, в бета-окислении липидов FAD является коферментом Ac-CoA дегидрогеназы Сукцинатдегидрогеназа — фермент класса оксидоредуктаз. В цтк катализирует обратимое окисление сукцината до фумаровой кислоты. Окисление 1 моля янтарной кислоты приводит к синтезу 2 молей (АТФ). При этом электроны от сукцинатдегидрогеназы передаются в дыхательную цепь на кофермент Q. Ацил-коа-дегидрогеназа фермент класса оксидоредуктаз , катализирующий окисление ацилкоэнзима А до 2,3-дегидроацил-КоА; участвует в обмене жирных кислот. 10. Окислительное декарбоксилирование пирувата и цикл Кребса: последовательность реакций, связь с дыхательной цепью, регуляция, значение. Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. пируват в анаэробных условиях восстанавливается до молочной кислоты. В аэробных условиях пируват с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А. Превращение пирувата в ацетил-КоА катализируется пируватдегидрогеназным комплексом. Пируватдегидрогеназный комплекс состоит из трех ферментов(пируватдекарбоксилаза, дегидролипоил-транс-ацетилаза и дигидролипоил-гидроксилаза) и содержит пять коферментов: НАД, ФАД, , амид липоевой кислоты, СоА. Этот процесс включает 4 реакции, суммарное уравнение записывается так СН3-СО-СООН + NAD+ + HSKoA → СН3-СО SKоА + NADH + H+ + СО2. Окислительное декарбоксилирование пи-рувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфо-рилирования 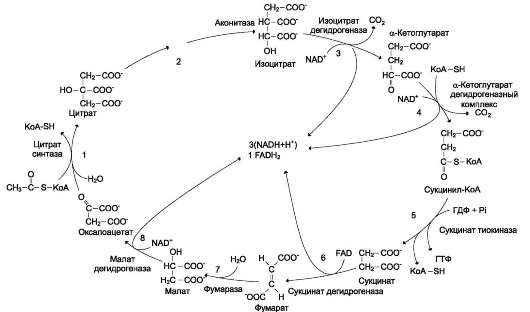 3 молекулы NADH и 1 молекула FADH2, образованные в цтк, отдают электроны в ЦПЭ на кислород и взаимодействует с протонами с образованием воды. На каждую молекулу NADH при образовании молекулы воды в процессе тканевого дыхания синтезируются 3 молекулы ATФ, а на каждую молекулу FADH2 - 2 молекулы АТФ каждый оборот цтк сопровождается синтезом 11 молекул АТФ путём окислительного фосфо-рилирования. Одна молекула АТФ образуется путём субстратного фосфорилирования. регулятором ЦТК является оксалоацетат, а точнее его доступность. Наличие оксалоацетата вовлекает в ЦТК ацетил-SКоА и запускает процесс. ключевые ферменты Цитаратсинатаза Ацетил-КоА, оксалоацетат АТФ, НАДН, сукцинил-КоА, (начальный) динноцепочечные жирные кислоты активаторы Изоцитратдегидрогеназа АДФ(аллостерический), АТФ, НАДН, НАДФН (лимитирующий) цАМФ, Са2+ ингибиторы L-кетоглутаратдегидрогеназа цАМФ, Са2+ сукцинил-КоА, АТФ, НАДН (фермент на развилке) Значение:1) Анаболическое: 2) Энергетичекая – 3) Является основным поставщиком Н2 для дыхательной цепи, в составе НАДН и ФАДН2. 4) Регуляторная: продукты цикла являются регуляторами других процессов (АТФ и цитрат тормозят расщепление глюкозы, о стимулируют синитез ж. кислот. 11. Дыхательная цепь, компоненты, структурная организация. Электрохимиче ский потенциал, его значение. Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью. За исключением убихинона (КоQ), все компоненты ЦПЭ - белки. 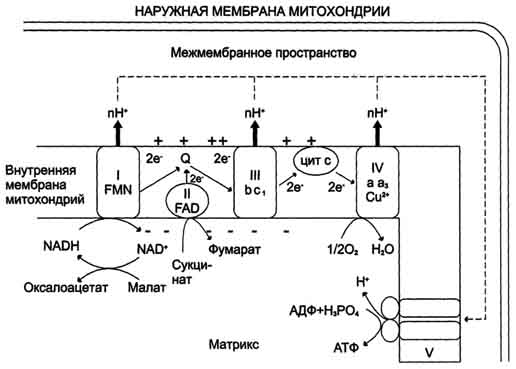 . .восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование окислитльное В дыхательной цепи есть 2 входа: 1. Протоны поступают в цепь ч/з НАДН; 2. В составе ФАДН2 Характеристика компонентов дыхательной цепи (ферментативных комплексов): 1)НАДН-дегидрогеназа(НАДН-КоQ-оксидоредуктаза) – встроена во внутреннюю мембрану митохондрий. Это флавин-зависимый фермент, в состав которого входит витамин В2. , имеет 2 простетические группы: ФМН и Железосерные белки. Функция: а)Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). б) Переносит 4 иона Н+на наружную поверхность внутренней митохондриальной мембраны. 2) КоQ (убихинон) – небелковый переносчик, является жирорастворимым не заряжен. Поэтому он принимает электроны и протоны с ФАДН2, т.е. ч/з 2й вход в дыхательную цепь. 3) Цитохромы (b,c1,c, а, а3)– сложные белки (гемпротеины), небелковой частью которых является гем, содержащийFе3+(окисленная форма). Fе гема может обратимо принимать и отдавать электроны. 4) УбихинолДГ (КоQ-цитохром с-оксидоредуктаза)– это ферментный комплекс, состоящий из цитохромов b и с1, включающий также FеS-центры. Функция: а) Принимает электроны от ко-Q и передает их на цитохром; б)Переносит 2 иона Н+ на наружну 5) Цитохром с-кислород-оксидоредуктаза- В этом комплексе находятся цитохромы а и а3, В комплексе также имеется 2 иона меди. Функция: а) Принимает электроны от цитохрома с и передает их на кислород с образованием воды. б)Переносит 4 иона Н+ на наружну 6) АТФ-синтаза– комплекс, две большие группы: одна группа формирует субъединицу Fо –по ней выкачанные наружу протоны водорода устремляются в матрикс. Другая группа образует субъединицу F1 –используя энергию протонов, синтезирует АТФ. (ΔμН+) – величина, определяющая разность концетрации протонов на внешней и внутренней стороне мембраны митохондрии. может служить источником энергии для синтеза АТФ, обеспечения транспорта веществ, др. энергозависимых процессов клетки. электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. 12 Окислительное фосфорилирование АДФ. Механизм. Сопряжение и разоб щение окисления и фосфорилирования в дыхательной цепи. Коэффициент Р/0. Регуляция дыхательной цепи. 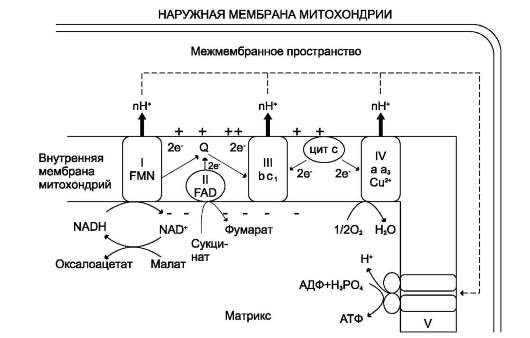 Характеристика компонентов дыхательной цепи (ферментативных комплексов): 1)НАДН-дегидрогеназа(НАДН-КоQ-оксидоредуктаза) – встроена во внутреннюю мембрану митохондрий. Это флавин-зависимый фермент, в состав которого входит витамин В2. , имеет 2 простетические группы: ФМН и Железосерные белки. Функция: а)Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). б) Переносит 4 иона Н+на наружную поверхность внутренней митохондриальной мембраны. 2) КоQ (убихинон) – небелковый переносчик, является жирорастворимым не заряжен. Поэтому он принимает электроны и протоны с ФАДН2, т.е. ч/з 2й вход в дыхательную цепь. 3) Цитохромы (b,c1,c, а, а3)– сложные белки (гемпротеины), небелковой частью которых является гем, содержащийFе3+(окисленная форма). Fе гема может обратимо принимать и отдавать электроны. 4) УбихинолДГ (КоQ-цитохром с-оксидоредуктаза)– это ферментный комплекс, состоящий из цитохромов b и с1, включающий также FеS-центры. Функция: а) Принимает электроны от ко-Q и передает их на цитохром; б)Переносит 2 иона Н+ на наружну 5) Цитохром с-кислород-оксидоредуктаза- В этом комплексе находятся цитохромы а и а3, В комплексе также имеется 2 иона меди. Функция: а) Принимает электроны от цитохрома с и передает их на кислород с образованием воды. б)Переносит 4 иона Н+ на наружну 6) АТФ-синтаза– комплекс, две большие группы: одна группа формирует субъединицу Fо –по ней выкачанные наружу протоны водорода устремляются в матрикс. Другая группа образует субъединицу F1 –используя энергию протонов, синтезирует АТФ. Сопряжение в дыхательной цепи— это такое состояние, когда окисление (перенос электронов) сопровождается фосфорилированием, то есть синтезом АТФ. Разобщение— это состояние дыхательной цепи, когда окисление идет, а фосфорилирование не происходит, то есть пункты фосфорилирования выключены.Е в виде тепла. Разобщение вызывают липофиль-ные вещества, которые способны переносить протоны водорода с внешней стороны внутренней мембраны митохондрий на внутреннюю, минуя АТФ-синтетазу. 2,4-ДНФ (динитрофенол), яды промышленных производств, бактериальные токсины, набухание митохондрий, жирные кислоты, ионофоры (вещества, переносящие ионы через мембрану). Разобщители повышают скорость переноса электронов по дыхательной цепи и выводят ее из под контроля АТФ. Выделяют три основных группы ингибиторов: 1. действующие на I комплекс, например, амитал (производное барбитуровой кислоты), ротенон, прогестерон, 2. действующие на III комплекс, например, экспериментальный антибиотик антимицин А, 3. действующие на IV комплекс, например, сероводород (H2S), угарный газ (СО), цианиды (-CN). Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование AДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О = 2. Дыхательный контроль–Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду.
субстратное фосфорилирование — процесс образования АТФ, не связанный с мембранами. В этом случае АТФ образуется За счет того, что фосфатная группа перемещается от (субстрата) к АДФ (например, образование АТФ при гликолизе). Этот способ связан с передачей макроэргического фосфата субстрата на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем 7,3 ккал/моль в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ. Отличия: разные источники энергии, для окислительного необходимы движение электронов в дых цепи, для субстратного необ-ма энергия макроэргической связи.оксилительное на мембране митохондрий, субстратное в цитозоле, Существует три основных способа использованияАТФ: 1. биосинтез веществ, 2. транспорт веществ через мембраны, 3. изменение формы клетки и ее движение. Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл: Использование АТФ как источника Е возможно только при условии непрерывного синтеза АТФ из АДФ за счёт Е окисления орг-их соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах. 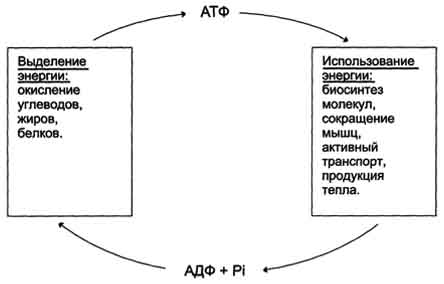 |
