Лекции Лаборант школы (химия). 1 посуда лабораторная
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
РН-метрияНа практике для выражения кислотности или щѐлочности раствора вместо определения концентрации ионов водорода используют его отрица- тельный логарифм, который называется водородным показателем. pH = -lg[H+] Многие аналитические реакции проходят при постоянном значении рН, которое должно сохраняться. В ходе некоторых реакций рН может изменяться при связывании ионов водорода. Поэтому для сохранения рН применяют буферные растворы. Буферные растворы представляют собой смеси слабых кислот с солями этих кислот или смеси слабых оснований с солями этих же оснований. Для измерения рН используют рН-метры. В качестве измерительно- го электрода применяют стеклянный электрод, в качестве сравнительного – хлорсеребряный. Определение рН со стеклянным электродом основано на измерении ЭДС элемента, обратимого относительно ионов водорода. Потенциал поверхности стекла, соприкасающийся с раствором кислоты, зависит от рН раствора. Это свойство стекла используют в стеклянных электродах. Стеклянный электрод имеет форму пробирки, донная часть ко- торой выполнена в виде тонкостенной стеклянной пластинки или в виде шарика. В качестве электрода сравнения использую хлор-серебряный электрод. Который заполняют насыщенным раствором хлористого калия. Н-метр проверяют и настраивают по буферному раствору, рН которого близок к рН исследуемого раствора. Правила работы на рН-метре изложены в инструкции по эксплуатацииприбора. Настроить рН-метр по буферному раствору. Электроды промыть дистиллированной водой, остаток удалить фильтровальной бумагой. Буферные растворы при многократном применении могут менять рН. Поэтому прежде, чем проводить корректировку, необходимо убедить- ся в том, что изменение погрешности вызвано изменением настройки при- бора, а не изменением рН буферного раствора. Изменение настройки рН- метра может быть обнаружено проверкой по свежеприготовленному бу- ферному раствору. Не допускать высыхания стеклянного электрода, он должен быть по- гружен в дистиллированную воду. В случае образования плѐнок на элек- троде, он должен быть промыт органическими растворителями, кислотами или щелочами. Если раствор имеет постоянную температуру, то можно пользовать- ся ручкой температурной компенсации. В случае если температура раство- ров меняется, используется автоматический термокомпенсатор, который погружается вместе с парой электродов в раствор.  
Инфракрасная спектроскопияФизический метод исследования химической структуры веществ, основанный на их способности взаимодействовать с электромагнитным излучением в инфракрасной области энергетического спектра. Внутренняя энергия молекул складывается из трех составляющих: энергии электронов, энергии колебания атомов и энергии вращения атомных групп. Первая составляющая проявляет себя в ультрафиолето- вой и видимой частях шкалы электромагнитных волн. В инфракрасной области обнаруживает себя колебательная состав- ляющая, поэтому инфракрасные спектры часто называют колебательны- ми, а метод – колебательной спектроскопией. Этот метод завоевал признание химиков благодаря простоте, точ- ности и экономичности. Проба исследуемого вещества может быть очень маленькой, до 10-6 г. Приборы для проведения анализа – ИК-спектрофотометры. Инфракрасная область спектра электромагнитных волн лежит меж- ду длинами волн 0,74 – 2000 мкм, но для химического анализа обычно используют длины волн от 1 до 15 мкм. Источниками излучения служат карбид кремния или смесь оксидов циркония, иттрия и тория, нагретые до высокой температуры (1400 – 1900°С) и дающие излучение с непре- рывным спектром. ИК-лучи проходят через монохроматор – устройство, пропускаю- щее лучи определенной длины. Основу его составляют призмы, изготов- ленные из поваренной соли, фторида лития или других галогенидов ме- таллов, прозрачных для ИК-лучей определенной длины (стекло и кварц не прозрачны в средней ИК-области). После монохроматора устанавли- вается кювета – сосуд из прозрачного для ИК-лучей материала, в кото- рый помещается проба исследуемого вещества. Проба может быть при- готовлена в виде пленки, раствора, пасты, таблетки или газа. В разнооб- разии формы и агрегатного состояния пробы большое преимущество ИК- метода анализа по сравнению с другими физическими методами. Через кювету последовательно пропускают лучи с различной дли- ной волны. После прохождения кюветы они попадают в детектор – при- емник излучения – устройство, которое регистрирует эти лучи и измеря- ет их интенсивность. В качестве детектора излучения применяют тепло- вые приемники (болометры, термоэлементы), приемники с внешним фо- тоэффектом (фотоэлементы, фотоумножители, электронно-оптические преобразователи) либо с внутренним фотоэффектом. 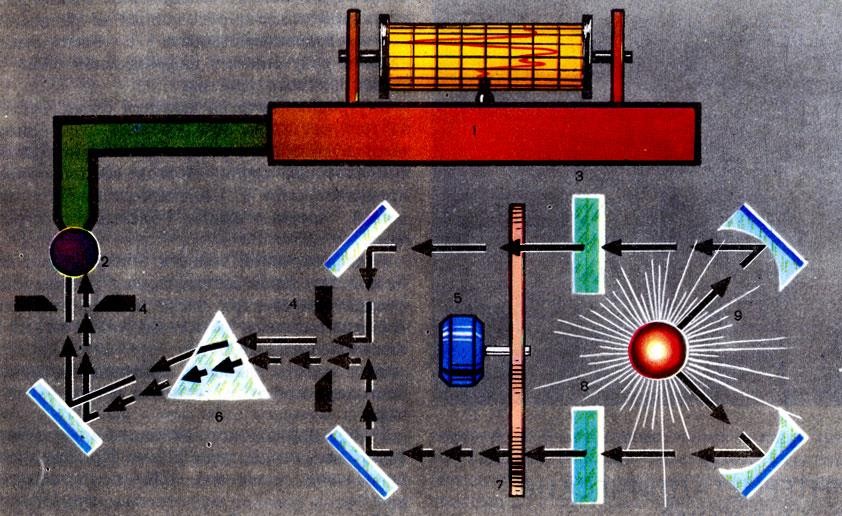 Рис. 42. Схематическое изображение двухлучевого записывающего инфра- красного спектрометра: 1 – самописец; 2 – детектор ИК-излучения; 3 – кювета с раствором образца; 4 – шели; 5 – мотор; 6 – призма хлорида натрия; 7 – прерыватель луча; 8 – кювета с растворителем; 9 – источник ИК-излучения (нить, нагреваемая током) Сигнал, полученный в детекторе, усиливается, измеряется фото- метром и поступает на самописец, который вычерчивает линию на дви- жущейся бумажной ленте. Получается график в координатах: интенсив- ность излучения, прошедшего через образец, – длина волны. Если луч с данной длиной волны поглощается исследуемым веществом, то это вы- зывает отклонение пера самописца, и на ИК-спектре (так называют полу- чаемый график) видна характерная полоса поглощения. 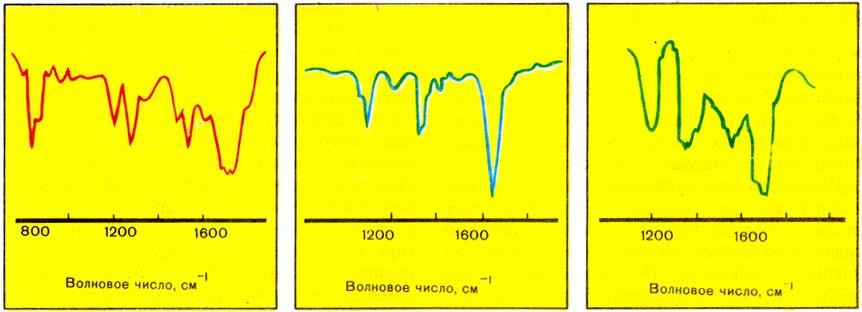 Рис. 43. ИК-спектры трех различных веществ По традиции длину волны света в ИК-спектроскопии измеряют волновым числом - величиной, обратной длине волны, в см-1. Между длиной волны и частотой существует следующее соотношение: λν=C, ν=C/λ где λ – длина волны, vν – частота, С – скорость света. Волновое число 1/λ пропорционально частоте. Частоты поглощения инфракрасного излучения данной молекулы совпадают с частотами колебаний атомов в этой молекуле. Для многих тысяч индивидуальных веществ рассчитаны и экспе- риментально определены характеристические (т.е. типичные для опреде- ленных структурных групп атомов) частоты поглощения. Получив ИК- спектр исследуемого вещества, химик прежде всего сравнивает его со стандартными спектрами, приведенными в специальных каталогах. Если спектр исследуемого вещества полностью совпал с одним из стандарт- ных спектров, то можно утверждать, что исследуемый препарат является тем веществом, с чьим спектром проводилось сравнение. ИК-спектроскопия дает возможность установить химический со- став и строение неизвестных веществ, наличие в них определенных функциональных групп, что очень важно в химических исследованиях |
