Методы аналитической биохимии. 1. Правила проведения работ в лаборатории при проведении биохимического анализа с использованием лабораторных животных
 Скачать 1.66 Mb. Скачать 1.66 Mb.
|
|
14. Центрифугирование в биохимическом анализе. Разделение веществ с помощью центрифугирования основано на разном поведении частиц в центробежном поле, в котором частицы имеют разные плотность, форму и размеры, осаждаются с разной скоростью. Скорость седиментации зависит от центробежного ускорения (G), прямо пропорционально угловой скорости ротора (ω, рад*с-1) и расстоянию между частицей и осью вращения (r, см): G=ω2 r. При перечислении условий разделения частиц указывают скорость вращения и радиус вращения ротора, а также время центрифугирования. Скорость седиментации сферических частиц зависит не только от центробежного ускорения, но и от плотности и радиуса самих частиц и вязкости среды суспендирования. Время, необходимое для осаждения сферической частицы в жидкой среде от мениска жидкости до дна центрифужной пробирки, обратно пропорционально скорости седиментации и определяется следующим уравнением: 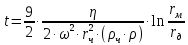 , где t – время седиментации, η - вязкость среды, rч – радиус частицы, ρч – плотность частицы, ρ - плотность среды, rм – расстояние от оси вращения до мениска жидкости, rд - расстояние от оси вращения до дна пробирки. , где t – время седиментации, η - вязкость среды, rч – радиус частицы, ρч – плотность частицы, ρ - плотность среды, rм – расстояние от оси вращения до мениска жидкости, rд - расстояние от оси вращения до дна пробирки.Осаждение несферических частиц не подчиняется данному уравнению, поэтому частицы одинаковой массы, но различной формы осаждаются при разных скоростях. Различают препаративное и аналитическое центрифугирование. Препаративное центрифугирование заключается в выделении биологического материала для последующих биохимических исследований. Выделяют большое количество клеточных частиц для изучения их морфологии, структуры и биологической активности. Методы применяются также для выделения таких биологических молекул, как ДНК и белки из предварительно очищенных препаратов. Аналитическое центрифугирование применяется главным образом для изучения чистых или практически чистых препаратов макромолекул или частиц. Метод позволяет получить данные о чистоте, молекулярном весе и структуре материала. Дифференциальное центрифугирование метод основан на различиях в скорости седиментации частиц, отличающихся друг от друга размерами и плотностью. Различный материал центрифугируют при ступенчатом увеличении центробежного ускорения (g), которое выбирается так, чтобы на каждом этапе на дно пробирки осаждалась определённая фракция (g1 Основные виды препаративного центрифугирования Зонально-скоростное центрифугирование метод заключается в наслаивании исследуемого образца на поверхность раствора с непрерывным градиентом плотности. Затем образец центрифугируют до тех пор, пока частицы не распределятся вдоль градиента в виде дискретных зон или полос. Благодаря созданию градиента плотности удаётся избежать смешивания зон, возникающего в результате конвекции. Этот метод применяется для разделения гибридов РНК-ДНК, субъединиц рибосом. Изопикническое центрифугирование. Если центрифугирование проводится не в градиенте плотности, препарат сначала центрифугируют так, чтобы осели частицы, молекулярный вес которых больше, чем у исследуемых частиц. Они отбрасываются, и образец суспендируется в среде, плотность которой такая же, как и у фракции, которую хотят выделить, а затем центрифугируют до тех пор, пока исследуемые частицы не осядут на дно пробирки, а частицы меньшей плотности не всплывут на поверхность жидкости. Другой способ заключается в наслаивании образца на поверхность раствора с непрерывным градиентом плотности, охватывающим диапазон плотностей всех компонентов смеси. Центрифугирование проводят до тех пор, пока плавучая плотность частиц не сравняется с плотностью соответствующих зон, т.е. пока не произойдёт разделение частиц по зонам. Формирование градиентов плотностей. Для создания градиента плотности используют соли тяжёлых металлов, например, рубидия или цезия, а также растворы сахарозы. Для создания градиентов плотности растворов чаще всего применяются растворы сахарозы, иногда с фиксированным рН. В некоторых случаях хорошее разделение получается при использовании обычной воды D2O. Препаративные центрифуги можно разделить: Центрифуга общего назначения максимальная скорость 6000 об/мин, центробежное ускорение до 6000 g Скоростные – до 25.000 об/мин и 89.000 g. Камера снабжена системой охлаждения. Препаративная ультрацентрифуга – до 70.000 об/мин, 510.000 g. Снабжена холодильной и вакуумной установкой. Аналитическое центрифугирование применяется в основном для изучения седиментационных свойств биологических макромоекул. При этом в конструкции применяют роторы и регистрирующие системы: они позволяют непрерывно наблюдать за седиментацией материала центробежном поле. Могут развивать скорость до 70.000 об/мин, создавая центробежное ускорение до 500.000g. Снабжены оптической системой, которая через заданные промежутки времени фотографирует седиментационный материал. Применяется для определения молекулярных весов макромолекул, проверки чистоты получаемых образцов, а также для исследования конформационных изменений в макромолекулах. 15. Потенциометрическое титрование: принцип, визуальное и инструментальное установление точки окончания титрования, определение биологических значимых молекул. Потенциометрическое титрование основано на регистрации изменения потенциала индикаторного электрода в процессе титрования в соответствии с изменением концентрации титруемого вещества в процессе прибавления титранта. Принцип: Одним из наиболее часто применяемых методов определения рН растворов является потенциометрический метод. Он основан на измерении электродвижущей силы (ЭДС) гальванического элемента. В таком гальваническом элементе имеются два электрода, погруженные в анализируемый раствор. Потенциал одного из электродов зависит от концентрации, а точнее от активности ионов водорода в растворе. Этот электрод называется измерительным или индикаторным. Потенциал второго электрода постоянен и не зависит от концентрации ионов водорода, он называется электродом сравнения. ЭДС гальванического элемента равна разности потенциалов двух электродов и соответственно она связана с концентрацией определяемых ионов, и эту ЭДС можно измерить. Установл. точки окончания: В потенциометрическом титровании индикация точки эквивалентности проводится по резкому скачку величины измеряемой ЭДС, которая изменяется благодаря изменению равновесного потенциала индикаторного электрода (Eинд.) в результате химической реакции с участием потенциалопределяющего компонента. Потенциометрическое титрование обладает большей точностью, чувствительностью позволяет анализировать окрашенные и мутные растворы, допускает возможность дифференцированного определения веществ в одном растворе и позволяет автоматизировать процесс титрования. 16. Комплексонометрическое титрование: принцип, визуальное и инструментальное установление точки окончания титрования, определение биологически значимых молекул. Комплексонометрическое титрование основано на реакциях образования хелатных комплексов при взаимодействии катионов металлов с аминополикарбоновыми кислотами (комплексонами). Из многочисленных аминополикарбоновых кислот наиболее часто используют этилендиаминтетрауксусную кислоту (H4Y). Вследствие низкой растворимости в воде сама кислота не подходит для приготовления раствора титранта. Для этого обычно используют дигидрат ее динатриевой соли Na2H2Y2H2O (ЭДТА, трилон Б). Молярная масса эквивалента ЭДТА и определяемого иона металла равны их молекулярным массам. Степень протекания реакции зависит от рН и константы устойчивости комплексоната. Катионы, образующие устойчивые комплексонаты, например, Fe(III), могут быть оттитрованы в кислых растворах. Ионы Са(II), Mg(II) и другие, образующие сравнительно менее устойчивые комплексонаты, титруют при рН ≈ 9 и выше. Конечную точку титрования определяют с помощью металлоиндикаторов – органических веществ, изменяющих свою окраску (или флуоресценцию) в зависимости от концентрации катионов металла в растворе. Чаще всего в анализе используются так называемые металлохромные индикаторы, образующие с катионами металлов внутрикомплексные соединения, окраска которых отличается от окраски 105 свободного индикатора, причем комплекс определяемого металла с комплексоном прочнее комплекса этого металла с индикатором. Наиболее распространенный металлохромный индикатор – эриохром черный Т (хромоген). Его используют в твердом виде: индикатор смешивают в отношении 1:200 с каким-либо индифферентным наполнителем, например, NaCl или KCl. 17. Основные законы светопоглощения. Спектры поглощения. При прохождении через слой раствора вещества светового потока с интенсивностью I0. Его интенсивность в результате явления поглощения в слое отражения и рассеяния уменьшается до значений I (I0>I). Связь между интенсивностями световых потоков I0 и I устанавливается законом Бугера-Ламберта, согласно которому однородные слои одного и того же вещества одинаковой толщины поглощают одну и туже долю бадающей на них световой энергии (при постоянной конц растворенного вещества): I= I0*е-aL a- коэф. Поглощения, e= 2.37 Отношение Т= I/ I0 называется пропусканием, выражающимся в % или диапазоном значения от 0 до 1. Величину пропускания отнесенную к толщине 1 см называют коэф. пропускания. Поглощение излучения характеризуют оптической плотностью (А) А= Ig I0/I =-IgT. Связь между конц поглощающего раствора и его оптической плотностью выраж законом Бера, согласно которому А раствора прямо пропорциональна конц растворенного вещества (c) при постоянной толщине слоя: А= Ig I0/I = k1*c , k1- коэф пропорциональности Зависимость интенсивности монохроматического светового потока, прошедшего через слой окрашенного раствора от интенсивности падающего потока света, конц окрашенного раствора и толщины слоя раствора опред осн законом Бугера-Ламберта-Бера: I= I0*10-k*c*L k- коэф светопоглощения, зависящий от природы растворенного вещества, растворителя, температуры, длины волны света Если конц растворенного вещества с выраж в моль/л, а толщина поглощ слоя L в см, то k представляет собой молярн коэф светопоглощения при длине волны (λ) и обозначается ελ. В этом случае уравнение принимает вид: I= I0*10- ελ*c*L При соблюдении основного закона светопоглощения оптическая плотность раствора прямо пропрциональна молярному коэф светопоглощения, конц поглощ вещества и толщине слоя. При графическом изобр зависимости А от конц при пост знач L получ прямая линия, кот проходит через начало координат при отсутствии поглощ света растворителем или погрешностью работы. Спектры поглощения представляют собой зависимость количества поглощаемого света от длины волны. Длина волны при которой наблюдается максимальное поглощение света называется λ макс. Положения максимума спектра поглощения является важной оптической характеристикой вещества, а характер и вид поглощения характеризует его качественную индивидуальность. Группа в молекуле, которая вносит вклад в спектр ее поглощения, называется хромофором (карбонильные группы АК, пептидные группы, остатки ароматических АК в белках, азотистые основания в нуклеотидах). При образовании сопряженных связей в молекуле энергия возбужденного состояния электронов уменьшается и хромофор начинает поглощать свет большей длины волны (батохромный сдвиг). Сдвиг в коротковолновую область именуется гипсохромным. Увеличение и уменьшение экстинкции называется гиперхромным и гиппохромным эффектами. 18. Спектроскопия в видимой и УФ-областях. Фотометрические методы определения концентрации вещества в растворе. Молекулярные спектры исследуются с помощью двух типов спектрометров – УФ (объединённого с видимым) и ИК. УФ спектроскопия включает получение, исследование и применение спектров испускания, поглощения и отражения в ультрафиолетовой области, т. е. в диапазоне длин волн 10-400 нм (волновых чисел 2,5 • 104 — 106 см-1). Спектрофотометрическое исследование спектров молекул в видимой и УФ областях позволяет установить вид электронных переходов и структуру молекул. При этом часто исследуют влияние различных типов замещения в молекулах, изменения растворителей, температуры и других физико-химических факторов. Инфракрасная спектроскопия изучает спектры поглощения и отражения электромагнитного излучения в ИК области, т.е. в диапазоне длин волн от 10—6 до 10—3 м. 1. Метод градуировочного (калибровочного) графика: для опред содержания вещества готовят серию из 5-8 стандартных растворов разн конц (в не менее 3х параллельных повторов каждой точки). При выборе интервала конц стандартных растворов: 1. интервал должен охватывать область возможных изменений конц исследуемого раствора желательно, чтобы оптическая плотность (ОП) исслед раствора соответствовала примерно середине градуировочной прямой; 2. необходимо чтобы в данном интервале конц при выбранной толщине кюветы (L) и длине волны (λмакс) соблюд основной закон светопоглощения и график зависимости ОП от конц был линейным: А=f(c) Соблюдая перечисленные условия измерения ОП стандартных растворов относително растворителя строят график зависимости ОП от конц. Полученный график имеет вид прямой выходящей из начала координат и наз калибровочным графиком. Этот метод позволяет определить содержание вещества в окрашенном растворе даже в тех случаях, когда основной закон светопоглощ не соблюдается. Для построения калибровочной прямой в этих случаях готовят большое количество стандартных растворов отлич др от др по конц не более чем на 10%. Такой график , имеющий на пологом участке угол наклона не менее 150, позволяет определить содержание вещества в растворе, не смотря на то что воспроизводимость опред в этом случае ниже чем при соблюд линейной зависимости. 2. Метод сравнения оптических плотностей стандартного и исследуемого растворов Для определения концентрации вещества берут аликвоту исследуемого раствора, приготавливают из нее окрашенный раствор для фотометрирования и измеряют его оптическую плотность. Затем аналогично приготавливают 2-3 стандартных окрашенных раствора определяемого вещества известной концентрации и измеряют их оптические плотности при той же толщине слоя (L). СХ= (АХ*Сст)/Аст Метод сравнения применяют при однократных определениях, соблюдая основной закон светопоглощения. 3. Метод ограничивающих растворов Для определения концентрации вещества методом ограничиваюших растворов готовят два стандартных раствора с концентрациями С1 и С2, так, чтобы оптическая плотность первого из них А, была меньше оптической плотности раствора с неизвестной концентрацей вещества АХ.а оптическая плотность (A) второго стандартного раствора была бы больше, чем АХ. Неизвестную концентрацию исследуемого вещества (CХ) рассчитывают по формуле: СХ=С1 + (C2 - С1) + (АХ-А1)/(A2-А1). 19. СПЕКТРОФОТОМЕТРЫ. ФОТОЭЛЕКТРОКОЛОРИМЕТРЫ Спектрофотометры. Структурная схема спектрофотометра: источник света, монохроматор, кюветное отделение, фотоэлемент, регистрирующее устройство. Световой пучок от источника света попадает в монохроматор через входную щель и разлагается дифракционной решеткой или призмой в спектр. В монохроматический пучок излучения, поступающий из выходной щели в кюветное отделение, поочередно вводятся контрольный и исследуемый образцы. Излучение, прошедшее через кювету, попадает на фотоэлемент, который преобразовывает световую энергию в электрическую. Электрический сигнал затем усиливается и регистрируется. Монохроматор – оптическая система (дифракционная решетка или призма), выделяющая из всего спектра источника света излучение определенной длины волны. Обычно в монохроматорах сначала выделяют пучок света с определенным диапазоном длин волн с помощью призмы, а затем разлагают его еще раз дифракционной решеткой. Кювета – оптически прозрачный сосуд для измерения оптической плотности исследуемого раствора. Для измерений в видимой области спектра (400–760 нм) используют пластиковые или стеклянные кюветы, для проведения измерений в ультрафиолетовой области – только кварцевые, так как стекло поглощает ультрафиолетовый свет. Царапины и грязь на стенках кюветы сильно рассеивают и поглощают свет, искажая результаты измерений. Протирать кюветы нужно мягкой тканью или сложенной вдвое марлей, но не фильтровальной бумагой. Мытье кювет осуществляется дистиллированной водой, растворителем, в котором растворено исследуемое вещество, мягкими детергентами. Запрещается мыть пластиковые кюветы концентрированными кислотами и щелочами, хромовой смесью. Заполнение кювет осуществляется до такого уровня, чтобы поток излучения проходил целиком через слой раствора. Обычно для проведения измерений используют кюветы с оптическим путем 1 см и объемом 4–5 мл. Фотоэлементы обеспечивают преобразование световой энергии в электрическую. Фотоны, бомбардируя поверхность фотоэлемента, выбивают из него электроны, количество которых пропорционально интенсивности света. Эти электроны летят к положительному электроду, в результате в замкнутой цепи возникает электрический ток, который регистрируется по падению напряжения на сопротивлении, находящемся в этой цепи. Напряжение можно усилить, и после компенсации сигнала потенциометром, отградуированным в единицах поглощения, на датчике регистрируется непосредственное поглощение образца. |
