Методы аналитической биохимии. 1. Правила проведения работ в лаборатории при проведении биохимического анализа с использованием лабораторных животных
 Скачать 1.66 Mb. Скачать 1.66 Mb.
|
|
35. Общие принципы хроматографии. Основные узлы приборов для хроматографического анализа. Хроматографический метод анализа разработан русским ботаником М. С. Цветом в 1903 г. В первых же работах с помощью этого метода ученый установил, что считавшийся однородным зеленый пигмент растений – хлорофилл – на самом деле состоит из нескольких веществ. При пропускании экстракта зеленого листа через колонку, заполненную порошком мела, и промывании петролейным эфиром, он получил несколько окрашенных зон, что с несомненностью говорило о наличии в экстракте скольких веществ. Этот метод он назвал хроматографией (от греч. хроматос – цвет), хотя сам же указал на возможность разделения и бесцветных веществ. Работы М. С. Цвета довольно долгое время оставались забытыми и не привлекали внимания, что в известной степени было связано с отрицательной оценкой его работ, которую дали некоторые авторитеты того времени. Заметное развитие хроматографических методов началось в 30-е гг. XX века. Хроматография продолжает бурно развиваться и в настоящее время, она является одним из перспективных методов анализ. О значимости хроматографии говорит тот факт, что за работы, выполненные с применением хроматографических методов, было присуждено 14 Нобелевских премий. Теоретические основы метода. Хроматографию можно определить как процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента (неподвижной фазы). Сорбцией (от лат. sоrbео – поглощаю) называют процесс поглощения твердым телом или жидкостью (сорбентом) газообразного или растворенного вещества (сорбата), обратный процесс называют десорбцией. Сорбцию подразделяют на адсорбцию – поглощение вещества (адсорбата) поверхностью твердого или жидкого адсорбента и абсорбцию — поглощение вещества (абсорбата) поверхностью абсорбента. Поглощение вещества сорбентом с образованием химических соединений называют хемосорбцией (химической сорбцией). Вещество подвижной фазы непрерывно вступает в контакт с новыми участками сорбента и частично сорбируется, а сорбированное вещество контактирует с новыми порциями подвижной фазы и частично десорбируется. При постоянной температуре адсорбция увеличивается с ростом концентрации раствора или давления газа. Зависимость количества поглощенного вещества от концентрации раствора или давления газа при постоянной температуре называют изотермой адсорбции. Типичная изотерма адсорбции приведена на рис.1. Математически эта зависимость может быть выражена уравнением Лэнгмюра (1) 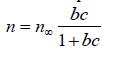 где n – количество адсорбированного вещества при равновесии; n∞ – максимальное количество вещества, которое может быть адсорбировано на данном адсорбенте; b – постоянная, с – концентрация. 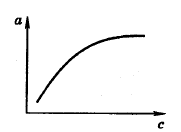 Рисунок 1 – Изотерма адсорбции По Лэнгмюру на поверхности твердого тела имеется некоторое число мест с минимальной энергией, расположенных через определенные интервалы по всей поверхности. Их число равно n∞. На этих местах могут адсорбироваться молекулы из раствора или газа. В области небольших концентраций изотерма линейна. Действительно, при bс<<1 уравнение (1) переходит в (2) Это уравнение линейной адсорбции. Оно соответствует уравнению Генри (Г – коэффициент Генри). Область линейной адсорбции иногда называют также областью Генри. При высокой концентрации bc > 1 и уравнение (2) принимает вид что соответствует так называемому насыщению: изотерма адсорбции выходит практически на прямую, параллельную оси абсцисс. Однако известны случаи, когда зависимость количества адсорбированного вещества от концентрации раствора или давления газа существенно отличается от изображенной на рис. 1. Изотерма адсорбции может быть, например, вогнутой или S-образной. Это может быть вызвано образованием на поверхности адсорбента не моно-, а поли-молекулярного слоя, что не предусматривается теорией Лэнгмюра. Все хроматографические системы состоят, как правило, из двух фаз. Одной из них является неподвижная фаза, которая бывает твердой, жидкой или представляет собой смесь твердой и жидкой фаз. Вторая, подвижная фаза, может быть жидкой или газообразной; она обычно течет по неподвижной фазе или пропускается через нее. Фазы для хроматографического разделения выбирают так, чтобы коэффициенты распределения компонентов смеси в них были различными. В хроматографии под коэффициентом распределения понимают отношение концентрации вещества в подвижной фазе к его концентрации в неподвижной фазе. Термином эффективный коэффициент распределения обозначают отношение общего количества вещества (в отличие от концентрации) в одной фазе к общему количеству этого вещества в другой фазе. Известно несколько теорий хроматографического процесса. Существенное значение имеют метод теоретических тарелок и кинетическая теория. В методе теоретических тарелок Мартина и Синджа хроматографическая колонка мысленно делится на ряд элементарных участков – «тарелок» и предполагается, что на каждой тарелке очень быстро устанавливается равновесие между сорбентом и подвижной фазой. В результате этих процессов хроматографируемое вещество распределяется на нескольких тарелках, причем на средних тарелках его концентрация оказывается максимальной (рис. 2).  Рисунок 2 – Схема разделения веществ (теория теоретических тарелок) Кинетическая теория хроматографии основное внимание уделяет кинетике процесса, связывая высоту, эквивалентную теоретической тарелке, с процессами диффузии, медленным установлением равновесия и неравномерностью процесса. Производится большое число хроматографов самых различных типов. Однако сложные хроматографические установки требуются не всегда. Для проведения хроматографического разделения методами бумажной, тонкослойной и некоторыми другими видами хроматографии используются простые установки, которые могут быть собраны в любой химической лаборатории. Независимо от сложности устройства основными узлами хроматографической установки являются: - дозатор (система ввода пробы), - хроматографическая колонка, - детектор. Кроме того, в установке имеются устройства для подачи газа-носителя или растворителя, для преобразования импульса детектора в соответствующий сигнал и некоторые другие. Дозатор предназначен для точного количественного отбора проба и введения ее в хроматографическую колонку. Одним из основных требований к дозатору является воспроизводимость размера пробы и постоянство условий ее введения в колонку. Газообразные и жидкие пробы обычно вводят с помощью специальных шприцев, прокалывая в месте ввода пробы каучуковую мембрану. Применяются газовые шприцы для газообразных проб и микрошприцы для жидких. Нередко в лабораторной практике в качестве дозатора применяется медицинский шприц. Твердые пробы вводятся в хроматограф или после перевода их в раствор, или непосредственным испарением пробы в нагретом дозаторе, куда она вводится с помощью игольного ушка. В хроматографической колонке происходит разделение компонентов. Колонки весьма различны по форме, размерам и конструкционным материалам. Применяются прямые, спиральные и другие колонки длиной от 1-2 м и менее до нескольких десятков метров. Внутренний диаметр колонок составляет обычно несколько миллиметров. В зависимости от свойств анализируемой системы в качестве конструкционных материалов для колонок чаще всего используют сталь, латунь, медь, стекло и др. Материал колонки должен обладать определенной химической инертностью по отношению к компонентам пробы, например, медные колонки будут непригодны при разделении ацетиленсодержащих смесей. В бумажной, тонкослойной и некоторых других видах хроматографии функцию колонки выполняет хроматографическая бумага, тонкий слой сорбента на подложке и т. д. Адсорбент, наполняющий колонку, должен обладать рядом свойств: необходимой селективностью, достаточной механической прочностью, химической инертностью к компонентам смеси. Практически в качестве адсорбентов используются оксид алюминия, силикагели, активированные угли, пористые полимеры на основе стирола, дивинилбензола и т. д. и синтетические цеолиты. Широко используют модифицированные адсорбенты, которые получают обработкой исходных адсорбентов растворами кислот, щелочей, неорганических солей. Выбор адсорбента зависит от агрегатного состояния фаз, методики хроматографирования и других факторов. Большое влияние на сорбируемость вещества оказывает температура, поэтому хроматографические колонки, как правило, термостатируются, используя обогрев жидкостью или парами кипящей жидкости, воздушное термостатирование или какой-либо другой прием. Детектор предназначен для обнаружения изменений в составе газа или раствора, прошедшего через колонку. Показания детектора обычно преобразуются в электрический сигнал и передаются фиксирующему или записывающему прибору, например на ленту электронного потенциометра. Основными характеристиками детектора являются чувствительность, пределы детектирования, инерционность и диапазон линейной зависимости между концентрацией и величиной сигнала. Детекторы подразделяются на дифференциальные, которые отражают мгновенное изменение концентрации, и интегральные, суммирующие изменение концентрации за некоторый отрезок времени. В интегральных детекторах анализируемый газ на выходе из колонки поглощается каким-либо раствором, а затем анализируется или поглощающий раствор или оставшийся непоглощённый газ. Достоинствами интегральных детекторов являются их простота и широкая область линейной зависимости показаний детектора от количества вещества. К недостаткам относятся значительная инерционность и низкая чувствительность, в связи с чем такие детекторы в настоящее время применяются редко. К группе дифференциальных относятся детекторы по теплопроводности (катарометр), по плотности, по электрической проводимости, пламенный, пламенно-ионизационный (ПИД) и другие ионизационные детекторы, термохимический, пламенно-фотометрический и т. д. Детектор выбирают в зависимости от свойств изучаемой системы, агрегатного состояния фаз и других особенностей. 36. Классификация методов хроматографии и их характеристика: тонкослойная, газовая, высокоэффективная жидкостная, ионно-обменная, гель-фильтрация. Различные методы хроматографии можно классифицировать по агрегатному состоянию фаз; способу их относительного перемещения, аппаратурному оформлению процесса и по агрегатному состоянию фаз. Классифицировать методы можно и по типу (механизму) разделения, так, например, разделение может происходить за счет установления: а) адсорбционного равновесия между неподвижной твердой и подвижной жидкой фазами (адсорбционная хроматография); б) равновесного распределения между неподвижной жидкой (или полужидкой) и подвижкой жидкой фазами (распределительная хроматография); в) равновесного распределения между неподвижной жидкой и подвижной газовой фазами (газожидкостная хроматография); г) ионообменного равновесия между ионообменной смолой (неподвижная фаза) и электролитом (подвижная фаза) (ионообменная хроматография); д) равновесия между жидкой фазой на внутренней и внешней поверхностях пористой структуры или «молекулярного сита» (проникающая хроматография); е) равновесного связывания макромолекулы с малой молекулой, по отношению к которой она проявляет высокую биологическую специфичность, а, следовательно, и сродство (аффинная хроматография). Адсорбционная хроматография В основе разделения методом адсорбционной хроматографии лежат различия в степени адсорбции данных веществ адсорбентом и растворимости их в соответствующем растворителе. Эти свойства определяются в основном молекулярной структурой соединения. Колонка для адсорбционной хроматографии – стеклянная трубка, заполненная адсорбентом. На колонку наносят подлежащую разделению смесь веществ, а затем пропускают через нее растворитель (или смесь растворителей). Разделение основано на том, что вещества с более высоким эффективным коэффициентом распределения продвигаются по колонке с большей скоростью, отделяясь, таким образом, от веществ с более низким коэффициентом. Если исследуемые соединения окрашены, то при разделении можно видеть движение по колонке окрашенных полос. Образующиеся в результате разделения зоны извлекают двумя способами. 1) колонку высушивают, окрашенные полосы вырезают, а затем элюируют из зон разделенный материал; 2) растворитель пропускают через колонку до тех пор, пока не соберут все фракции по мере их выхода. Этот метод более пригоден, поскольку при соприкосновении с воздухом, как это имеет место в первом случае, адсорбированный материал может разлагаться. Эффективность разделения чрезвычайно сильно зависит от правильного выбора адсорбента и системы растворителей, он диктуется задачами конкретного анализа. Обычно применяемые адсорбенты – кремниевая кислота, оксид алюминия, карбонат кальция, карбонат цинка и оксид магния. Тонкослойная хроматография (ТСХ). Этот метод особенно успешно применяется для разделения очень малых количеств материала. В своей основе он сходен с колоночной хроматографией; иными словами, тонкослойная хроматография – это по своей сути адсорбционная хроматография, хотя в первом случае могут играть роль и процессы распределения (значит только адсорбция). При ТСХ слой адсорбента наносят на стеклянные пластинки. Применяемые в ТСХ адсорбенты содержат связывающие агенты, например кальция сульфат, что способствует лучшей фиксации их на стеклянной пластинке. Адсорбент наносят на пластинки в виде кашицеобразной суспензии, затем пластинки высушивают в сушильном шкафу при температуре 100-120°С. После испарения воды на пластинках остается тонкий слой адсорбента. При проведении качественного анализа суспензию наносят слоем толщиной в 0,25 мм; в препаративной ТСХ толщина слоя достигает 5 мм. Пробу в виде пятна наносят на пластинку при помощи микропипетки или шприца на расстоянии приблизительно 2,5 см от нижнего края пластинки и примерно на таком же расстоянии от одной из боковых сторон. Затем пробы подсушивают для удаления растворителя, чтобы на это же место можно было повторно наносить новые порции. Все пятна следует наносить на одном и том же расстоянии от кромки пластинки и тщательно следить за тем, чтобы слой адсорбента в месте нанесения пробы не нарушался. Разделение проводят в стеклянной камере. На дно ее наливают растворитель слоем толщиной 1,5 см, затем закрывают стеклянной крышкой и оставляют на 1 ч для насыщения камеры парами растворителя (уравновешивание). После достижения равновесия хроматографическую пластинку помещают в камеру. Ее устанавливают вертикально так, чтобы место нанесения пробы было несколько выше уровня растворителя. Затем камеру снова накрывают крышкой; растворитель поднимается вверх по пластинке и таким образом происходит разделение. Температура в камере в ходе всего процесса разделения должна быть постоянной. Эффективность разделения можно повысить с помощью двухмерной хроматографии. В этом случае пробу наносят в виде отдельного пятна в нижний угол пластинки и проводят разделение в одном направлении. Затем пластинку вынимают из камеры и высушивают, после чего хроматографируют в другой системе растворителей в направлении, перпендикулярном первому (рис. 1). 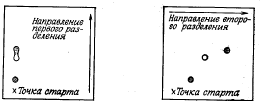 Рисунок 1 – Двухмерная хроматограмма Многие адсорбенты для ТСХ содержат флуоресцирующие красители. После разделения пластинки просматривают в ультрафиолетовом свете, и отдельные компоненты выявляются на них в виде синих, зеленых или темных пятен. Эти пятна отмечают, соскабливают, а затем элюируют соответствующее соединение при помощи растворителя, вымывающего это соединение, но не растворяющего краситель. Если адсорбенты не содержат красителей, то положение соединений на пластинке определяют другими методами: • При обработке пластинок 50%-ным раствором серной кислоты и последующем их нагревании большинство соединений обугливается, в результате чего на пластинках в соответствующих местах проявляются коричневые пятна. • Ненасыщенные соединения хорошо окрашиваются в присутствии паров йода. • Опрыскивание пластинок особыми красящими агентами вызывает окрашивание определенных соединений: так, например, нингидрин применяется для идентификации аминокислот. Действие большинства таких красителей основано на специфических количественных цветных реакциях. Покрывая пластинки более толстым слоем адсорбента (до 5 мм), можно одновременно хроматографировать гораздо большее количество материала (препаративная ТСХ). В этом случае пробу наносят не в виде пятна, а в виде полосы вдоль одной из сторон пластинки; после хроматографирования соединения располагаются на пластинке в виде отдельных полос. Одно из главных преимуществ метода ТСХ – быстрота разделения. Применение в качестве подвижной фазы летучих веществ позволяет сократить время разделения до 30 мин. Распределительная хроматография • на бумаге Этот метод основан на распределении соединения между двумя жидкими фазами. Хроматографическая бумага обладает свойством поглощать воду из атмосферы и задерживать ее между своими целлюлозными волокнами. Эту воду можно рассматривать как неподвижную фазу. Когда по бумаге под действием капиллярных сил движется неводный растворитель (подвижная фаза), молекулы вещества, нанесенного на бумагу, распределяются между двумя фазами в соответствии с их коэффициентом распределения. Чем выше растворимость вещества в подвижной фазе, тем дальше оно продвинется по бумаге вместе с растворителем, и наоборот. Расстояние, пройденное нанесенным на бумагу соединением в направлении движения растворителя, характеризуется величиной RF и определяется следующим отношением:  В стандартных экспериментальных условиях эта величина является для данного соединения постоянной и соответствует его коэффициенту распределения. Для углеводов вместо величины RF для удобства пользуются величиной RG , которая выражается так:  т. е. все величины определяются по отношению к глюкозе. Хроматографирование на бумаге проводят восходящим и нисходящим способами (рис. 2). И в том, и в другом случае растворитель наливают на дно герметичной камеры для насыщения атмосферы парами растворителя, и лишь затем помещают в камеру бумагу. При восходящей хроматографии бумажную полосу либо по-гружают в растворитель вертикально, например, свернув ее труб-кой, либо подвешивают таким образом, чтобы нижний конец поло-сы бумаги был погружен в растворитель. При нисходящей хрома-тографии верхний конец бумажной полосы с образцом, нанесенным недалеко от кромки бумаги, закрепляют в лотке, находящемся в верхней части камеры, а нижний конец бумаги спускают вниз так, чтобы он не соприкасался с налитым на дно камеры растворителем. Перед началом хроматографирования лоток заполняют растворите-лем. Из-за простоты первый вид хроматографии применяется чаще, однако скорость движения растворителя при нисходящей хромато-графии гораздо выше, чем при восходящей. 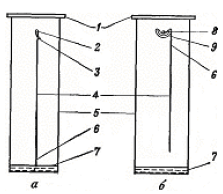 Рисунок 2 – Восходящая (а) и нисходящая (б) хроматография на бумаге: 1 – крышка; 2 – держатель; 3 – зажим; 4 – бумага; 5 – стек-лянная камера; 6 – место нанесения пробы; 7 – растворитель; 8 – стеклянная палочка; 9 – лоток с растворителем Для определения местоположения соединений хроматограммы просматривают в ультрафиолетовом свете или опрыскивают специальными растворами. Опрыскивать хроматограммы 50%-ной серной кислотой не рекомендуется, поскольку при этом разрушается бумага. Использование бумажной хроматографии в препаративных целях весьма ограничено; в тех случаях, когда такое разделение все же производится, участки хроматограммы, содержащие интересующее вещество, вырезают, а затем элюируют материал с помощью соответствующих растворителей. Как правило, при бумажной хроматографии неподвижная фаза является водной, а в качестве подвижной применяются органические растворители. Однако некоторые соединения лучше разделяются в тех случаях, когда неподвижная фаза представляет собой органический растворитель, а подвижная — воду. Хроматографическую бумагу предварительно пропитывают органическим соединением, чаще всего жидким парафином. После нанесения на бумагу образца проводят обычное хроматографирование с помощью водного растворителя. Этот метод применяется также и при разделении соединений методом ТСХ; он называется хроматографией с обращенной фазой. • на колонке В данном виде хроматографии в качестве носителя обычно применяют целлюлозу, крахмал, кремниевую кислоту или какие-либо другие соединения. Чтобы разделение было успешным, носитель должен содержать определенное количество воды, до 50% (вес/объем). Гидратированный носитель смешивают с соответствующим несмешивающимся растворителем до образования суспензии. Суспензию помещают в стеклянную трубку, как и при обычной колоночной хроматографии. Разделяемую смесь наносят сверху и проводят хроматографирование. Вещества с разными эффективными коэффициентами распределения движутся по колонке с разными скоростями и поэтому элюируются в разное время. Следует иметь в виду, что при распределительной хроматографии на колонке может играть роль и адсорбция. Газожидкостная хроматография Метод основан на распределении соединений между жидкой и газовой фазами и благодаря высокой чувствительности и быстроте разделения используется для количественного и качественного анализа широкого круга соединений (рис. 3). Неподвижная фаза должна быть нелетучей и устойчивой к температуре, при которой производится анализ. В качестве неподвижной фазы часто используют органические соединения с высокой температурой кипения, которые наслаивают на носитель в концентрации от 1 до 25%, в зависимости от условий анализа. Неподвижную фазу из «жидкого» материала (например, силиконовой смазки) закрепляют на инертном гранулированном твердом носителе и помещают в узкую стеклянную или стальную колонку, через которую пропускают инертный газ (подвижная фаза), например аргон или азот. Колонку помещают в термостат с температурой, при которой исследуемое вещество испаряется. В основе разделения анализируемых соединений по мере их продвижения по колонке с газом-носителем лежит различие в коэффициентах распределения испарившихся анализируемых веществ между жидкой и газо-вой фазами. После выхода из колонки вещества попадают в детектор, связанный через усилитель с самописцем (рис. 3, б). Неподвижные фазы бывают двух типов – избирательные, когда разделение основано на различиях в химических свойствах разделяемых компонентов, и неизбирательные, когда в его основе лежит различие в температуре кипения компонентов. Выбор температуры, при которой проводят анализ, зависит от природы неподвижной фазы. Слишком высокая температура вызывает испарение фазы, загрязнение детектора и искажение базовой линии. Выбор фазы зависит от природы исследуемого соединения и чаще всего основывается на литературных данных. Одну и ту же колонку можно многократно использовать в течение нескольких месяцев. 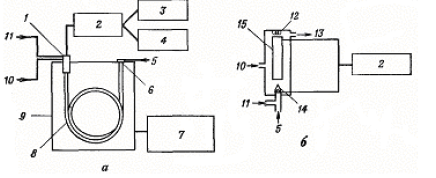 Рисунок 3 – Схема устройства прибора для газожидкостной хроматографии (а) и пламенно-ионизационного детектора (б) 1 – детектор; 2 – усилитель; 3 – самописец; 4 – интегратор; 5 – газ-носитель; 6 – место введения пробы; 7 – устройство, регулирующее температуру термостата; 8 – хроматографическая колонка; 9 – термостат; 10 – воздух; 11 – водород; 12 – запальное устройство; 13 – выходное отверстие; 14 – пламя; 15 – электрод. Качественный анализ. При стандартных условиях (температура, скорость пропускания газа-носителя и т. д.) время прохождения исследуемого соединения через колонку является величиной постоянной и называется временем удерживания. От опыта к опыту условия эксперимента несколько меняются, поэтому вместе с исследуемым образцом обычно хроматографируют стандартное соединение (так называемый внутренний стандарт); иногда такое соединение пропускают через колонку отдельно. Время выхода исследуемого соединения из колонки по отношению к таковому для стандарта называется относительным временем удерживания и является постоянным для данной колонки в различных экспериментальных условиях. Поэтому при проведении качественного анализа, неизвестные компоненты можно идентифицировать, сравнивая величины их временем удерживания с таковым для уже известных соединений. Количественный анализ. Количество вещества определяют по площади (а иногда высоте) пика (рис. 4) на диаграммной ленте самописца. Для установления зависимости между площадью пика и количеством вещества проводят предварительную калибровку прибора с помощью стандартных соединений, концентрация которых хорошо известна. 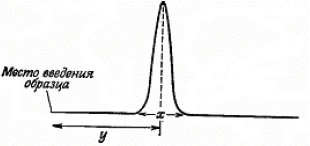 Рисунок 4 – Параметры, характеризующие газожидкостную хроматограмму: Х – ширина пика у основания; У – расстояние от места введения образца до максимума пика Ионообменная хроматография Данный вид хроматографии основан на притяжении между противоположно заряженными частицами. Аминокислоты и белки, содержат способные к ионизации группы, которые обусловливают суммарный положительный или отрицательный заряд соединения; величина заряда зависит от рН и изоионной точки. Разделение веществ с помощью ионообменной хроматографии обычно проводят на колонках, заполненных специальной ионообменной смолой. Существует два типа ионообменных смол – катионообменники и анионообменники. Катионообменные смолы содержат отрицательно заряженные группы, которые притягивают положительно заряженные молекулы. Эти смолы называют также кислотными ионообменниками, так как отрицательные заряды возникают на них в результате протолиза кислотных групп. Анионообменные смолы содержат положительно заряженные группы, притягивающие отрицательно заряженные молекулы. Их называют иногда основными ионообменниками. Многие ионообменные смолы получают путем сополимеризации стирола и дивинилбензола (рис. 5). 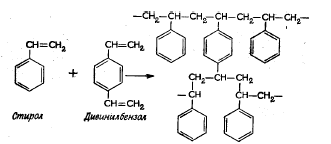 Рисунок 5 – Сополимеризация стирола и дивинилбензола При реакции конденсации стирола с дивинилбензолом между молекулами образуются поперечные связи (сшивки), в результате чего получается нерастворимая смола. Изменяя соотношение стирола и дивинилбензола, можно регулировать степень сшивания. Чем выше содержание дивинилбензола в сополимере по сравнению со стиролом, тем больше число поперечных связей. При обработке поперечно-связанного полистирола концентрированной серной кислотой (сульфирование) получают сульфированную полистирольную смолу, например дауэкс 50 – сильнокислый ионообменник. Сильноосновные ионообменники получают в ходе реакции между попе-речно-связанным полистиролом и хлорметиловым эфиром с последующей реакцией хлорзамещенных групп с третичными аминами. СН2N(СH3)Сl-группы ионизуются при всех значениях рН, за исключением очень щелочных. Катионообменные и анионообменные смолы можно разделить в зависимости от силы их кислых и основных групп. Процесс ионного обмена в процессе хроматографирования предположительно состоит из пяти этапов: 1) Диффузия иона к поверхности смолы. В гомогенных растворах этот процесс происходит очень быстро. 2) Диффузия иона внутрь гранул смолы к ионообменному участку. Скорость диффузии зависит от степени сшитости смолы и концентрации раствора. Эта стадия является лимитирующей для всего процесса ионного обмена. 3) Обмен ионов на ионообменном участке. Этот процесс происходит мгновенно и является равновесным. Чем выше заряд обменивающейся молекулы, тем прочнее она связывается со смолой и тем труднее обменивается на другие ионы. 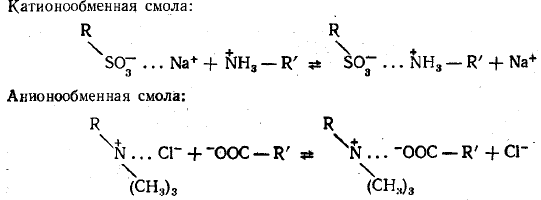 4) Диффузия обмениваемого иона через смолу к поверхности ионообменника. 5) Десорбция элюентом и диффузия обменявшегося иона в окружающий раствор. После работы набухшую смолу помещают в колонку и подвергают регенерации, пропуская через колонку 1 н. раствор НС1 (в случае катионообменника) или NaOH (в случае анионообменника). Затем колонку промывают дистиллированной водой до полного удаления регенерирующего вещества, после чего колонка готова к употреблению. Отработанную смолу можно использовать повторно. Проникающая хроматография Разделение молекул по размерам и форме основано на свойствах молекулярного сита, которыми обладают многие пористые материалы. Для этой цели применяют органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. Разделение веществ при помощи гелей, основанное на различиях в размере молекул, называется гель-фильтрацией. В последнее время в качестве молекулярного сита стали применять пористые стеклянные гранулы, а сам метод разделения получил название хроматографии фильтрованием через стекло с заданным размером пор. Понятие проникающая хроматография включает в себя все виды разделения молекул, основанные на принципе молекулярного сита. Принцип, лежащий в основе метода проникающей хроматографии, весьма прост. Хроматографическую колонку заполняют набухшим гелем или пористыми стеклянными шариками и уравновешивают с помощью соответствующего растворителя. Крупные молекулы, не проникающие в поры сита, проходят между частицами геля, в то время как небольшие молекулы «застревают» в них и движутся с меньшей скоростью. Три стадии такого разделения схематически изображены на рис. 6. 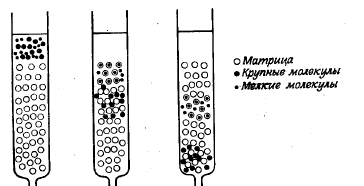 Рисунок 6 – Разделение веществ методом проникающей хроматографии Материалам для проникающей хроматографии являются гели, в том числе и декстраны с поперечными сшивками (торговое название сефадекс), агарозные гели, полиакриламидный гель и полистиролы. Применяются также пористые стеклянные шарики (гранулы), известные под названием биоглас, и пористый кварц – порасил. Декстрановые гели получают поперечным сшиванием полисахаридных цепочек декстрана эпихлоргидрином, благодаря чему растворимый в воде декстран становится водонерастворимым, сохраняя при этом свои гидрофильные свойства и способность к быстрому набуханию в водной среде. Варьируя число поперечных сшивок, удалось получить несколько различных типов сефадексов, различающихся степенью пористости частиц, что позволяет применять их для разделения веществ с различными размерами молекул. Поскольку поперечные связи между цепочками распределены произвольно, размеры пор одного и того же геля варьируют в весьма широких пределах. Это означает, что молекулы, размер которых меньше некоторого критического, могут полностью или частично проникать внутрь частиц геля. Каждый тип сефадекса характеризуется так называемой «величиной поглощения воды», т. е. количеством воды, приходящейся на 1 г сухого сефадекса в полностью набухшем геле. Во влажном состоянии сефадекс можно стерилизовать в автоклаве при температуре 100°С в течение 40 мин; свойства геля при этом не меняются. Вместо гелей в ряде случаев применяются пористые стеклянные шарики из боросиликатного стекла, пронизанные множеством соединяющихся между собой пор заданного диаметра; эти шарики имеют предел молекулярной эксклюзии от 3000 до 9000 000 дальтон и выполняют роль частиц обычного геля, однако обладают по сравнению с ними рядом преимуществ, а именно: а) химически инертны ко всем реагентам, за исключением фтористого водорода и сильных оснований; б) обладают исключительно четкими пределами эксклюзии и поэтому характеризуются большей разрешающей способностью и обеспечивают лучшее разделение; в) дают возможность значительно сократить время подготовки колонки, поскольку не нужно тратить время на их набухание; г) шарики не слипаются между собой, поэтому растворитель можно пропускать с большой скоростью; д) размер пор стеклянных шариков не зависит от растворителя и рН, поэтому можно использовать любые растворители и растворители любой ионной силы, что дает возможность применять их при градиентной элюции; е) стеклянные шарики легко промывать и стерилизовать. Проникающая хроматография используется в основном для очистки высокомолекулярных биологических соединений, их концентрирования. С помощью соответствующих гелей или стеклянных гранул проводят разделение и очистку вирусов, белков, ферментов, гормонов, антител, нуклеиновых кислот и полисахаридов. С помощью колонки, заполненной сефадексом 0-25, можно проводить обессоливание растворов высокомолекулярных соединений. Аффинная хроматография Очистка высокомолекулярных биологических соединений методом аффинной хроматографии основана на уникальном свойстве макромолекул – их биологической специфичности. Именно благодаря этой особенности с помощью аффинной хроматографии теоретически можно получать абсолютно чистые вещества в отличие от таких методов разделения, как проникающая хроматография и электрофорез, основанных на физико-химических свойствах макромолекул. При подготовке к анализу лиганд, который обычно представляет собой конкурентный обратимый ингибитор, ковалентно сшивают с соответствующей нерастворимой матрицей; при этом лиганд не теряет своей способности связываться с ферментом. Затем подлежащий очистке раствор фермента наносят на колонку, заполненную связанной с лигандом матрицей в соответствующем буферном растворе, после чего происходит избирательное связывание фермента. Содержащиеся в ферменте примеси, которые не связались с матрицей, элюируются с колонки. Идеальная нерастворимая матрица для аффинной хроматографии должна удовлетворять следующим требованиям: а) содержать большое число химических групп, способных ко-валентно связываться с лигандом, и при сшивании с ним не разрушаться; б) не разрушаться при связывании и последующей элюции макромолекул; в) как можно слабее взаимодействовать с другими макромолекулами, чтобы неспецифическое связывание было минимальным; г) обеспечивать быстрое протекание растворителя. Обычно в качестве матрицы применяют однородные твердые, сферические гранулы таких соединений, как агароза и поперечно-сшитые декстраны; применяются также синтетические полиакриламидные гели, производные целлюлозы, полистирольные смолы и пористые стеклянные шарики. Лиганд должен содержать определенную химическую группу, которая не участвует в специфическом связывании лиганда с макромолекулой, но посредством которой происходит его сшивание с матрицей. Чтобы в процессе сшивания с матрицей не нарушалась способность лиганда связываться с макромолекулой, целесообразно связывать лиганд с матрицей с помощью удлиняющих «мостиков». Наиболее распространенный способ пришивания лиганда к матрице заключается в предварительной обработке полисахаридной матрицы бромцианом (CNBr) при рН 11,0 (в продаже имеется активированная бромцианом сефароза 4В). Бромциан реагирует с гидроксильными группами полисахарида с образованием карбаматных групп, а также с соседними гидроксильными группами (если они имеются) с образованием имидокарбонатных групп. Одновременно происходит образование поперечных связей внутри матричной структуры геля, что способствует ее стабилизации. Удлиняющие «мостики» вводят несколькими способами, в частности при помощи диаминов типа или ε-аминокапроновой кислоты. Иногда удлиняющий «мостик» является частью самого лиганда; в этом случае он непосредственно пришивается к матрице с помощью бромциана. Некоторые из возможных реакций сшивания лиганда с матрицей приведены на рис. 7. 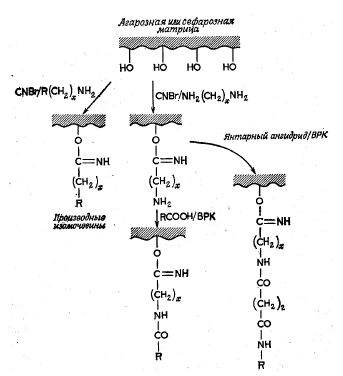 Рисунок 7 – Возможные пути сшивания лиганда с агарозой или сефарозой Буквой R обозначен лиганд, с которым связывается макромолекула, символом ВРК обозначен водорастворимый карбодиимид. Для простоты приведена реакция только с одной из гидроксильных групп. До настоящего времени аффинная хроматография применялась в основном для очистки белков, но ее в равной степени можно использовать и для очистки антигенов и антител, витаминов и гормонов, рецепторов лекарственных веществ, полиферментных комплексов. |
