|
|
Методы аналитической биохимии. 1. Правила проведения работ в лаборатории при проведении биохимического анализа с использованием лабораторных животных
Фотоэлектроколориметр – оптический прибор, в котором монохроматизация потока излучения осуществляется с помощью светофильтров (избирательных поглотителей световых потоков). Светофильтры пропускают лучи лишь в определенном интервале длин волн и практически полностью поглощают лучи других длин волн.
Если спектральные характеристики окрашенного вещества неизвестны, то светофильтр для работы выбирается самостоятельно. Известно, что в видимой части спектра воспринимаемый цвет есть результат избирательного поглощения определенного участка спектра белого света. Цвет раствора является дополнительным к цвету поглощения излучения. Поэтому измерение поглощения проводят в дополнительной для цветной реакции области спектра. Так, если раствор окрашен в сине-зеленый цвет, то нужно измерять поглощение этим раствором красного цвета.
Более точный выбор светофильтра осуществляется следующим образом:
1. Окрашенный раствор наливают в кювету, определяют его оптическую плотность для всех светофильтров.
2. По полученным данным строят кривую, откладывая по горизонтальной оси длины волн, соответствующие максимуму коэффициента пропускания светофильтров (см. табл. 2), а по вертикальной оси – соответствующие значения оптической плотности раствора.
3. Отмечают участок кривой, для которого выполняются следующие условия: оптическая плотность имеет максимальную величину; ход кривой примерно параллелен горизонтальной оси, т. е. оптическая плотность мало зависит от длины волны.
4. Светофильтр для работы выбирают так, чтобы длина волны, соответствующая максимуму коэффициента пропускания светофильтра, приходилась на отмеченный выше участок спектральной кривой исследуемого раствора.
5. Если описанные выше условия выполняются для нескольких светофильтров, выбирают тот, для которого чувствительность фотоколориметра выше.
Выбор кюветы. Предварительный выбор кювет проводится визуально, исходя из интенсивности окраски раствора. Если раствор интенсивно окрашен, следует использовать кюветы с малой длиной оптического пути (0,3–0,5 см). В случае слабоокрашенных растворов измерения проводят в кюветах с большой длиной оптического пути.
Спектрофотометр СФ-26 (рис. 1). Предназначен для измерения оптической плотности и пропускания жидких и твердых веществ в области 186–1100 нм.
Спектрофотометр СФ-46 (рис. 2). Предназначен для измерения оптической плотности и пропускания жидких и твердых веществ в области 190–1100 нм.
Спектрофотометр Solar PV 1251 (рис. 3). Предназначен для проведения спектрофотометрического анализа растворов в диапазоне длин волн 325–999 нм.
20. АТОМНЫЙ И МОЛЕКУЛЯРНЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Атомный спектральный анализ (АСА) определяет элементный состав образца по атомным (ионным) спектрам испускания и поглощения, молекулярный спектральный анализ (МСА) – молекулярный состав веществ по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света.
Методы атомного спектрального анализа основаны на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Испускание света атомами происходит за счет изменения энергии атомов. Атомы могут обладать только строго определенными дискретными запасами внутренней энергии. атомы не могут иметь энергию, промежуточную между значениями. В нормальном, состоянии атомы обладают минимальной энергией. При подведении энергии, атомы возбуждаются. Через очень короткое время (
10–8 с) атом самопроизвольно возвращается в нормальное или какое-то более низкое возбужденное состояние. Освобождающаяся при этом энергия Е излучается в виде светового кванта hv.
Эмиссионный АСА состоит из следующих основных процессов:
1) отбор пробы, отражающей средний состав анализируемого материала или местное распределение определяемых элементов в материале;
2) введение пробы в источник излучения, в котором происходят испарение твѐрдых и жидких проб, диссоциация соединений и возбуждение атомов и ионов;
3) преобразование их свечения в спектр и его регистрация (либо визуальное наблюдение) с помощью спектрального прибора;
4) расшифровка полученных спектров с помощью таблиц и атласов спектральных линий элементов. На этой стадии заканчивается качественный АСА. По яркости линий при визуальном просмотре можно дать грубую оценку содержания тех или иных элементов в пробе.
Основой качественного спектрального анализа является свойство каждого химического элемента излучать характерный линейчатый спектр. Задача качественного спектрального анализа сводится к отысканию линий определяемого элемента в спектре пробы. Принадлежность линии данному элементу устанавливается по длине волны и интенсивности линии. Однако общее число линий в спектре многих элементов очень велико
В основе количественного АСА лежит уравнение Ломакина-Шайбе, которое хорошо описывает концентрационную зависимость интенсивности спектральной линии:
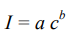
где а – коэффициент, зависящий от режима работы источника возбуждения, его стабильности, температуры и т. д.;
b – коэффициент самопоглощения, учитывающий поглощение квантов света невозбужденными атомами.
Количественный АСА можно осуществлять сравнением интенсивностей двух спектральных линий в спектре пробы, одна из которых принадлежит определяемому элементу, а другая (линия сравнения) – основному элементу пробы, концентрация которого известна, или специально вводимому в известной концентрации элементу ("внутреннему стандарту").
Молекулярный спектральный анализ (МСА)
В основе МСЛ лежит качественное и количественное сравнение измеренного спектра исследуемого образца со спектрами индивидуальных веществ. Соответственно различают качественный и количественный МСА.
В МСА используют различные виды молекулярных спектров:
вращательные [спектры в микроволновой и длинноволновой инфракрасной (ИК) областях],
колебательные и колебательно-вращательные [спектры поглощения и испускания в средней ИК-области, спектры комбинационного рассеяния света (КРС), спектры ИК-флуоресценции],
электронные, электронно-колебательные и электронно-колебательно-вращательные [спектры поглощения и пропускания в видимой и ультрафиолетовой (УФ) областях, спектры флуоресценции].
МСА позволяет проводить анализ малых количеств (в некоторых случаях доли мкг и менее) веществ, находящихся в различных агрегатных состояниях.
Качественный МСА устанавливает молекулярный состав исследуемого образца. Спектр молекулы является его однозначной характеристикой. Наиболее специфичны спектры веществ в газообразном состоянии с разрешенной вращательной структурой, которые исследуют с помощью спектральных приборов высокой разрешающей способности. Наиболее широко используют спектры ИК-поглощения и КРС веществ в жидком и твёрдом состояниях, а также спектры поглощения в видимой и УФ-областях. Широкому внедрению метода КРС способствовало применение для их возбуждения лазерного излучения. Для повышения эффективности МСА в некоторых случаях измерение спектров комбинируют с др. методами идентификации веществ.
Количественный МСА по спектрам поглощения основан на законе Бугера-Ламберта-Бера. Если полоса поглощения исследуемого вещества достаточно изолирована и свободна от наложения полос др. компонент смеси, исследуемый спектральный участок можно выделить. При количественном МСА по спектрам КРС чаще всего интенсивность линии определяемого компонента смеси сравнивают с интенсивностью некоторой линии стандартного вещества, измеренной в тех же условиях (метод "внешнего стандарта"). В др. случаях стандартное вещество добавляют к исследуемому в определённом количестве (метод "внутреннего стандарта"). Особое значение имеет МСА с применением техники замороженных растворов в специальных растворителях, например парафинах.
21. НЕФЕЛОМЕТРИЯ ТУРБИДИМЕТРИЯ
В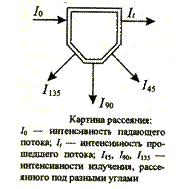 нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии. нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии.
Пробу освещают потоком света с интенсивностью I0, а затем, так же как в молекулярной абсорбционной спектроскопии, измеряют интенсивность прошедшего излучения It или определяют интенсивность излучения, рассеянного под определенным углом (например, I90 при 90°). С ростом числа частиц суспензии отношение It/I0 уменьшается, а отношения вида I90/I0 увеличиваются, во всяком случае, до умеренных концентраций. Для очень разбавленных суспензий измерение под углом гораздо чувствительнее, чем измерения, когда источник и приемник излучения находятся на одной линии, поскольку при этом можно наблюдать слабый рассеянный свет на темном фоне.
Метод, в котором используют интенсивность прошедшего света It, называют турбидиметрией, а метод с измерением под углом 90° (или каким-либо другим) – нефелометрией. При турбидиметрических измерениях величина, называемая мутностью, соответствует оптической плотности.
Для турбидиметрических измерений можно использовать любой фотометр или спектрофотометр. Если растворитель и рассеивающие частицы бесцветны, максимальная чувствительность достигается при использовании излучения голубой или ближней ультрафиолетовой области. Для окрашенных систем оптимальную длину волны необходимо подбирать экспериментально.
Конструкции приборов для нефелометрических и люминесцентных измерений идентичны, поэтому любой флуориметр можно использовать в качестве нефелометра. Поскольку длина волны при рассеянии не изменяется, необходимость во втором монохроматоре или светофильтре отпадает, но если они имеются в приборе, то их следует настроить на длину волны падающего света. Многие серийные флуориметры снабжены специальными приспособлениями для нефелометрических измерений.
Методы лазерной нефелометрии и иммунотурбидиметрии основываются на регистрации протекающей в жидкой среде реакции «антиген - антитело», сопровождающейся образованием соответствующего преципитата. О ходе реакции можно судить как по установлению степени мутности системы «в конечной точке» .
Все определяемые методом нефелометрии (иммунотурбидиметрии) вещества представляют собой белки, содержащиеся в основной внеклеточной жидкости — плазме (сыворотке) крови в относительно большом количестве. Среди них:
1) факторы гуморального иммунитета: иммуноглобулины А, G, М, компоненты комплемента;
2) специфические белки (белки «острой фазы»);
3) другие белки плазмы (альбумин);
4) белки мочи (микроальбумин).
22. ИФА: КЛАССИФИКАЦИЯ И РЕАКТИВЫ.
Иммуноферментный анализ – лабораторный иммунологический метод качественного или количественного определения различных низкомолекулярных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело.
В основу классификации методов ИФА положено несколько подходов:
1. По типу реагентов, присутствующих на первой стадии ИФА, различают конкурентный и неконкурентный методы.
А. Конкурентный вариант ИФА. Лимитирующим субстратом является антитело АТ. Меченый антиген АГ*, будучи добавленным в анализируемый образец в известной концентрации, связывается с антителом, образуя комплекс АГ* – АТ.
В этой реакции АГ* будет конкурировать с немеченым антигеном АГ, содержащимся в образце. Концентрация комплекса АГ* – АТ будет обратно пропорциональна концентрации АГ. Таким способом по заранее известной концентрации АГ* можно определить неизвестную концентрацию АГ.
Б. Неконкурентный вариант ИФА. Из антигена АГ, находящегося в тестируемом образце, и меченого антитела АТ*, добавленного в концентрации, превышающей концентрацию АГ, образуется комплекс АГ – АТ.
Количественный анализ реакции может быть проведен по образованию комплекса АГ – АТ*, выявляемого с помощью ферментной метки, или по АТ*, оставшемуся в свободном состоянии.
2. Все методы ИФА делятся на гомогенные и гетерогенные.
Если все три стадии ИФА проходят в растворе, и между основными стадиями нет дополнительных этапов разделения образовавшихся иммунных комплексов от непрореагировавших компонентов, метод относится к группе гомогенных. В основе гомогенного ИФА, применяемого, для определения низкомолекулярных субстанций, лежит ингибирования активности фермента при его соединении с антигеном или антителом. Активность фермента восстанавливается в результате реакции антиген-антитело.
При связывании антитела с антигеном, содержащим ферментную метку, происходит ингибирование активности фермента на 95 % по отношению к высокомолекулярному субстрату, что обусловлено стерическим исключением субстрата из активного центра фермента. По мере увеличения концентрации антигена связывается все больше антител и сохраняется все больше свободных конъюгатов антиген-фермент, способных гидролизовать высокомолекулярный субстрат.
Для гетерогенных методов характерно проведение анализа в двухфазной системе с участием твердой фазы-носителя, и обязательная стадия разделения иммунных комплексов от непрореагировавших компонентов (отмывка), которые находятся в разных фазах (образовавшиеся иммунные комплексы находятся на твердой фазе, а непрореагировавшие комплексы – в растворе).
3. По принципу определения тестируемого вещества – прямое определение концентрации вещества (антигена или антитела) по числу провзаимодействовавших с ним центров связывания и определение концентрации вещества по разности общего числа мест связывания и оставшихся свободными центров связывания:
А. Прямое определение концентрации вещества (антигена или антитела) по числу провзаимодействовавших с ним центров связывания. В этом случае ферментная метка будет находиться в образовавшемся специфическом комплексе АГ – АТ. Концентрация определяемого вещества будет прямо пропорциональна регистрируемому сигналу.
Б. Определение концентрации вещества по разности общего числа мест связывания и оставшихся свободными центров связывания. Концентрация определяемого вещества при этом будет возрастать, а регистрируемый сигнал снижаться, следовательно, в данном случае прослеживается обратная зависимость от величины регистрируемого сигнала.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение нашли, пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами:
– высокая активность и стабильность фермента в условиях анализа, при модификации и в конъюгате с антителами или другими белками;
– наличие чувствительных субстратов и простота метода определения продуктов или субстратов ферментативной реакции;
– возможность адаптации субстратных систем к дальнейшему усилению;
– отсутствие фермента и его ингибиторов в исследуемой биологической жидкости.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, т.к. реакция ферментсубстрат высокоспецифична. Основные требования к субстрату:
‒ обеспечение высокой чувствительности метода при выявлении фермента в конъюгате;
‒ образование хорошо учитываемых (например, окрашенных) продуктов реакции фермент-субстрат;
‒ субстрат должен быть безопасным, дешевым, доступным и удобным для применения.
АГ и AT, используемые в ИФА, должны быть высокоочищенными и высокоактивными. Кроме того, АГ должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант (эпитоп), чужеродностью и гомогенностью. Многие синтетические и рекомбинантные АГ вирусов и бактерий хорошо себя зарекомендовали при использовании в ИФА.
Существуют разные виды антител:
1. Антиинфекционные или антипаразитные антитела – как минимум мешают жизнедеятельности возбудителя инфекции в организме, как максимум – вызывают его гибель.
2. Антитоксические антитела – нейтрализуют токсины, которые вырабатывают вирусы, попав в организм человека.
3. Антитела-«свидетели» – «узнают» тот возбудитель инфекции, который попал в организм, и подают об этом сигнал.
4. Аутоагрессивные или аутологичные антитела – способны травмировать и разрушать здоровые ткани в организме человека.
5. Аллорективные или гомологичные антитела, занимающие главную роль в отторжении организмом органов, которые в него трансплантируют, и в негативной реакции организма на вливание несовместимой крови.
6. Гетерологичные или изоантитела, которые противостоят клеткам других биологических видов и антигенам тканей.
7. Антиидеотипические антитела – противостоят тем антигенам, которые вырабатывает сам организм человека.
Конъюгат – это антиген или антитело, меченные ферментной меткой. Образование коньюгата – один из важных этапов проведения ИФА.
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и др. вещества.
23. ИФА: ПРИНЦИП, СТАДИИ, ПРЕИМУЩЕСТВА И НЕДОСТАТКИ
Иммуноферментный анализ (ИФА) — один из видов иммунохимического анализа. Он основан на высокоспецифической иммунологической реакции антигена (АГ) с соответствующим антителом (АТ) с образованием иммунного комплекса. При этом один из компонентов конъюгирован с ферментом. В результате реакции фермента с хромогенным субстратом образуется окрашенный продукт, количество которого можно определить спектрофотометрически.
Любой вариант ИФА содержит 3 обязательные стадии:
Стадия узнавания исследуемого соединения специфическим антителом;
Стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
Стадия превращения ферментной метки в регистрируемый сигнал.
|
|
|
 Скачать 1.66 Mb.
Скачать 1.66 Mb.
 нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии.
нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии.