|
|
Методы аналитической биохимии. 1. Правила проведения работ в лаборатории при проведении биохимического анализа с использованием лабораторных животных
27. ВЫСОКОВОЛЬТНЫЙ, НЕПРЕРЫВНЫЙ, ДИСК-ЭЛЕКТРОФОРЕЗ, ИММУНОЭЛЕКТРОФОРЕЗ, ИЗОЭЛЕКТРИЧЕСКОЕ ФОКУСИРОВАНИЕ.
Высоковольтный электрофорез
При разделении низкомолекулярных веществ с помощью низковольтного электрофореза на бумаге наблюдается значительная диффузия. Это нежелательное явление можно исключить, если применять значительно более высокие напряжения; при этом улучшается разрешение, а разделение происходит очень быстро, за 10-60 мин. Для этой цели используют источники питания, обеспечивающие напряжение до 10 000 В, силу тока до 500 мА.
При высоковольтном электрофорезе выделяется такое большое количество тепла, что требуется эффективная система охлаждения. Охлаждение можно осуществлять двумя способами – «полным погружением» или с помощью охлаждающих пластин.
При «полном погружении» насыщенную буфером бумагу с нанесенным образцом погружают в большой объем охлаждающей жидкости, которая действует как жидкий теплообменник, отводя от бумаги тепло.
Охлаждающая жидкость должна быть электрически инертной и не смешиваться ни с буфером, ни с образцами. Для этих целей широко применяются органические растворители, например толуол или варсол (уайт-спирт). Обычно в охлаждающую жидкость погружают змеевик, по которому циркулирует вода, что обеспечивает дополнительное охлаждение. Метод «полного погружения» достаточно эффективен и технически легко осуществим, однако охлаждающие жидкости, как правило, токсичны и легковоспламеняемы.
Система охлаждающих пластин безопаснее и более эффективна. Две пластины (как правило, алюминиевые) плотно, под давлением прижимаются надувной прокладкой к изолированному от них полимерным материалом носителю.
Непрерывный (проточный) электрофорез
Образец, растворенный в буфере, непрерывно наносят в верхней части вертикально расположенного листа бумаги. Образец увлекается вниз буфером, стекающим под действием силы тяжести, одновременно с этим заряженные компоненты образца под влиянием электрического поля перемещаются в горизонтальном направлении. Аппарат помещают в камеру из плексигласа. Стационарность потока буфера обеспечивается тем, что буферный раствор в сосуде поддерживается на постоянном уровне. Разделившиеся вещества собирают в пробирки, расположенные под нижним зубчатым краем листа бумаги. Разделение продолжается до 2 сут. Оптимального разделения в каждом частном случае добиваются путем эмпирического подбора места нанесения образца, скорости движения буфера и образца, а также применяемого напряжения.
Диск-электрофорез
Прибор состоит из двух сосудов с буфером – верхнего и нижнего, соединенных между собой рядом вертикальных цилиндрических стеклянных трубок (рабочие трубки), содержащих гель (рабочий гель и гель-прокладку). В нижнем сосуде находится анод, а в верхнем – катод. Образцы наносят на поверхность столбиков геля при заполненном буфером нижнем сосуде, затем буфером заполняют и верхний сосуд, ставят на место крышку и включают ток. Буферные растворы подбирают таким образом, чтобы разделяемые вещества были в них заряжены отрицательно. По мере их движения через гель вниз, к аноду, происходит разделение, обусловленное различиями отношений заряда к массе. Диск-электрофорез называют еще «прерывистым» электрофорезом (в отличие от непрерывного, проточного). Это название отражает особенность метода, заключающуюся в использовании неоднородной («прерывистой») среды (гелей) и буферов разного состава и с разными значениями рН. Верхняя треть столбика геля состоит из крупнопористого геля-прокладки, или концентрирующего геля, а нижняя – из рабочего, или разделяющего, геля с более мелкими порами. Роль концентрирующего геля заключается в концентрировании образца по мере его прохождения через этот гель; в результате образец подходит к рабочему гелю в виде чрезвычайно узкой полосы. Рабочий гель действует по принципу молекулярного сита. рН буферного раствора в верхнем сосуде меньше, чем буферного раствора, насыщающего гель, и благодаря этому различию образец по мере прохождения через гель-прокладку концентрируется.
Иммуноэлектрофорез
Этот метод, сочетающий электрофорез с иммунодиффузией, дает возможность различить сходные по электрофоретической подвижности вещества с помощью специфической реакции преципитации между антигеном и соответствующим антителом. Метод особенно ценен для обнаружения антигенов в сложных физиологических смесях, например антигенов иммуноглобулинов (рис. 5).
Первоначально смесь антигенов разделяют с помощью электрофореза на тонкой агаровой пластинке. Затем в желобок, вырезанный в агаре, вносят смесь антител. Смесь диффундирует через, пластинку латерально, и в то же самое время происходит радиальная диффузия антигенных компонентов от мест их локализации в агаре. При встрече антигена с соответствующим антителом происходит преципитация в форме дуги. Количество образовавшихся дуг соответствует числу антигенов. Предпочтительнее проводить иммуноэлектрофорез на агаре, однако можно использовать также ацетат целлюлозы, крахмальный и полиакриламидный гели.
Изоэлектрическое фокусирование
В основе этого метода лежит фронтальный, а не зональный электрофорез. Амфотерные вещества, такие, как аминокислоты и пептиды, разделяют на специально предназначенной для этого вертикальной колонке одновременно в градиенте как рН, так и напряжения. Каждое вещество движется к той части колонки, где значение рН соответствует его изоэлектрической точке, и там останавливается (фокусируется).
Выполнение анализа следующее. Вертикальную стеклянную колонку заполняют смесью синтетических низкомолекулярных амфолитов-носителей, индивидуальные изоэлектрические точки которых имеют значения, перекрывающие предварительно выбранную область рН. Амфолиты обычно суспендируют в растворе сахарозы, чтобы среда была плотной и в ней отсутствовали конвекционные потоки. Верхний конец колонки (анод) соединен с сосудом, содержащим сильнокислый раствор (например, фосфорную кислоту), а нижний (катод) – с сосудом, содержащим сильнощелочной раствор (например, этаноламин). При открытии клапанов в сосудах эти растворы начинают диффундировать в колонку каждый со своего конца, и через некоторое время в колонке устанавливается градиент рН с крайними значениями, соответствующими рН кислого и щелочного растворов. После этого клапаны закрывают и включают ток.
Амфолиты в растворе мигрируют до тех пор, пока не достигнут области рН, при которой их суммарный заряд равен нулю. Здесь они прекращают движение, стабилизируя тем самым исходный градиент рН. Затем, открыв кран, вводят в верхнюю часть колонки образец.
Разделение продолжается от 1 до 3 сут; за это время компоненты смеси распределяются по зонам со значениями рН, соответствующими их изоэлектрическим точкам. По завершении разделения выключают ток и фракции, поступающие через кран в нижней части колонки, собирают в пробирки коллектора для последующего анализа.
28. Гель- электрофорез ( полиакриламидный, агарозный)
Использование гелей в качестве разделяющей среды привело к быстрому развитию методов анализа макромолекул. На ранних этапах развития метода использовали крахмальный гель, и, хотя он все еще находит применение, в большинстве методов электрофореза сегодня работают либо на агарозных, либо на полиакриламидных гелях.
Электрофорез в полиакриламидном геле сокращенно называют ПААГ-электрофорезом. Полиакриламидные гели с поперечными связями образуются при полимеризации акриламида в присутствии небольшого количества N,N'-метиленбисакриламида (обычно называемого просто «бисакриламидом» (рисунок 4). В бисакриламиде две акриламидные молекулы соединены метиленовой группой; он используется как сшивающий агент. Мономер акриламида полимеризуется в длинные цепи по типу «Голова к хвосту», и время от времени в растущую цепь встраивается молекула бисакриламида, внося второй участок для наращивания цепи. Образуется поперечная сетка (матрикс) довольно регулярной структуры.
Полимеризация акриламида – пример свободно-радикального катализа и инициируется добавлением персульфата аммония и N,N,N',N'-тетраметилендиамина (ТЕМЕД). ТЕМЕД катализирует разложение иона персульфата, образуя свободный радикал (т. е. частицу с неспаренным электроном):
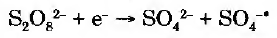
Если свободный радикал обозначить через R • (где точка обозначает неспаренный электрон), а молекулу мономерного акриламида - через М, тогда реакцию полимеризации можно схематически представить следующим образом:

Свободные радикалы обладают высокой реакционной способностью благодаря присутствию неспаренного электрона, которому «Хочется» спариться с другим электроном, чтобы стабилизировать молекулу. Поэтому
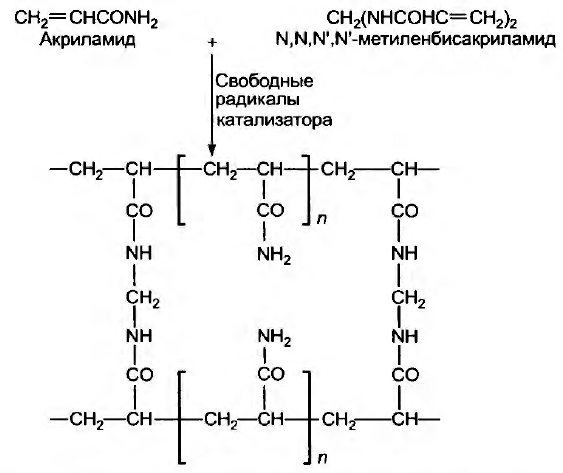
Рисунок 4 – Образование полиакриламидного геля из акриламида и бисакриламида
R• реагирует с М, образуя одинарную связь, объединяя свой неспаренный электрон с другим электроном из внешней оболочки молекулы мономера.
В результате образуется новый свободный радикал R-M – в такой же степени активная частица, способная атаковать следующий мономер. Так образуются длинные цепи акриламида с поперечными связями из-за случайного встраивания в растущую цепь молекул бисакриламида. Кислород уничтожает свободные радикалы, и поэтому раствор геля обычно дегазируют (еще до использования раствор геля помещают на короткое время в вакуум для удаления растворенного воздуха). Дегазирование раствора геля служит и другой цели. Полимеризация акриламида – экзотермическая реакция (т. е . протекает с выделением тепла), и нагревание геля при его отвердевании может сопровождаться высвобождением пузырьков воздуха, которые остаются включенными в полимеризующийся гель. Дегазирование предотвращает это.
Агароза представляет собой линейный полисахарид (Mr
12000), образованный из повторяющихся единиц агаробиозы (рисунок 3), состоящей из чередующихся остатков галактозы и 3,6-ангидрогалактозы.
Раствор агарозы получают путем кипячения сухой агарозы в водном буфере до образования прозрачного раствора. При охлаждении до комнатной температуры образуется твердый гель. Образование геля объясняется наличием внутри- и межмолекулярных водородных связен между длинными агарозными цепями. Такая структура с поперечными связями сообщает гелю хорошие антиконвекционные свойства. Размер пор в геле зависит от исходной концентрации агарозы; большие поры образуются при низких концентрациях агарозы, а малые – при высоких концентрациях. Агароза в основном не несет зарядов, но может происходить замещение остатков сахаров на карбоксильные, метоксильные, пируватные и чаще сульфатные группы. Это замещение может приводить к электроэндоосмосу и ионным взаимодействиям между гелем и образцом, что оказывает нежелательный эффект. Поэтому для продажной агарозы указана степень очистки в зависимости от концентрации сульфата – чем ниже концентрация сульфата, тем выше степень чистоты.
Агарозные гели используют для электрофореза белков и нуклеиновых кислот. Размеры пор 1 %-й агарозы сравнимы с размерами молекул белков. Поэтому агарозные гели применяются в таких методах, как иммуноэлектрофорез или плоскостное изоэлектрическое фокусирование, когда движение белковых молекул в геле обусловлено их зарядом. Гели с большими порами используются для разделения совсем крупных молекул, таких как ДНК и РНК: большой размер позволяет молекулам ДНК и РНК проходить через гель. Однако, так как размеры пор и размеры молекул сопоставимы, при разделении таких молекул начинает играть роль вязкость среды. Следующим преимуществом использования агарозных гелей является возможность использовать агарозу с низкой температурой плавления (62-65°С). Как видно из названия, такие гели можно расплавить при нагревании до 65°С, и образцы ДНК, разделенные в таком геле, можно вырезать, перевести в раствор и выделить из него.
Из-за малой упругости агарозных гелей и связанных с этим проблем, возникающих при извлечении геля из небольших трубок, электрофорез в столбиках геля, который иногда осуществляют с полиакриламидными гелями, не проводят в агарозе. Для изоэлектрического фокусирования и иммуноэлектрофореза используют горизонтальные пластины геля. Они также обычно применяются для разделения ДНК и РНК, хотя в некоторых лабораториях пользуются вертикальными системами.
29. Капиллярный электрофорез: принцип, оборудование
Метод капиллярного электрофореза (КЭ) основан на разделении компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. Микрообъем анализируемого раствора вводят в капилляр, предварительно заполненный подходящим буфером – электролитом. После подачи к концам капилляра высокого напряжения (до 30 кВ), компоненты смеси начинают двигаться по капилляру с разной скоростью, зависящей в первую очередь от заряда и массы (точнее – величины ионного радиуса) и, соответственно, в разное время достигают зоны детектирования. Полученная последовательность пиков называется электрофореграммой, при этом качественной характеристикой вещества является параметр удерживания (время миграции), а количественной – высота или площадь пика, пропорциональная концентрации вещества. На рис. 6 показана схема установки для капиллярного электрофореза.
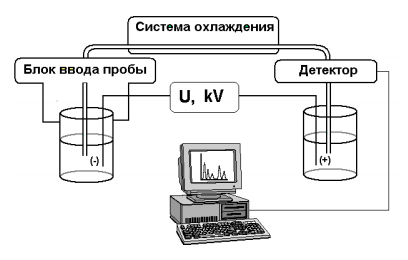
Рисунок 6 – Схема установки для капиллярного электрофореза
При проведении разделения в капиллярах особенно важное значение приобретает электроосмотический поток (ЭОП), связанный с движением диффузной части двойного слоя, образующегося относительно заряженной поверхности внутренней стенки капилляра (рис. 7)
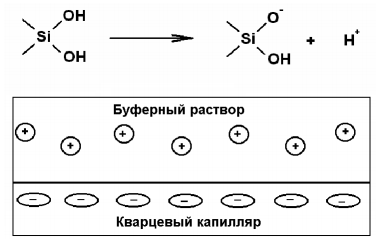 Рисунок 7 – Схема возникновения электроосмотического потока Рисунок 7 – Схема возникновения электроосмотического потока
Как правило, заряд поверхности определяется наличием отрицательно заряженных силанольных групп на поверхности немодифицированных кварцевых капилляров или создается за счет дополнительной модификации поверхности.
Результирующая подвижность частиц µ определяется суммой электрофоретической и электроосмотической подвижностей:
µ = µэф + µэо
Это дает определенные преимущества при анализе смесей противоположено заряженных ионов, поскольку все определяемые компоненты будут двигаться в направлении детектора вследствие ЭОП. Однако скорость передвижения ионов с одинаковым направлением электрофоретической и электроосмотической подвижностей будет увеличиваться, а противоположенным – уменьшаться. Для немодифицированного кварцевого капилляра в диффузной части двойного электрического слоя присутствует некоторая избыточная концентрация катионов, в результате движения которых возникает ЭОП, направленный к катоду. В результате катионы будут перемещаться быстрее и детектироваться до ЭОП, а анионы медленнее и детектироваться после ЭОП, нейтральные молекулы движутся с ЭОП.
В кварцевых капиллярах ЭОП уменьшается при увеличении концентрации электролита и добавлении органических растворителей и возрастает с увеличением рН, а также зависит от вязкости раствора в капилляре и температуры.
Подавляющее большинство разделений в КЭ проводят с использованием кварцевых капилляров имеющих внешнее полимерное покрытие, обычно – полиимидное, улучшающее их механическую прочность, и значительно реже полимерные капилляры, например из тефлона. Внутренний диаметр капилляров колеблется в пределах от 25 до 200 микрон, а длина капилляра в зависимости от поставленной задачи – от нескольких сантиметров до 1 метра. Поскольку внешнее полиимидное покрытие непрозрачно в УФ-области, то участок покрытия удаляют и создают окно для УФ-детектирования. Капилляр закрепляется в специальной пластиковой кассете. Надежное термостатирование капилляра является основным условием получения воспроизводимых времен миграции определяемого соединения и площади результирующего пика, что важно для количественного анализа.
Выбор оптимальных размеров капилляра представляет собой компромиссное решение между требуемой чувствительностью определения и разрешающей способностью. Используют капилляры с внутренним диаметром 25-50 мкм, что является компромиссным решением между достаточно высокой чувствительностью и эффективностью разделения.
Модифицированные капилляры. Первоначально большинство разделений в капиллярном электрофорезе проводили с использованием немодифицированных кварцевых капилляров. Однако, необратимость адсорбции белков, пептидов, фрагментов ДНК, а также электростатические взаимодействия разделяемых соединений с внутренней поверхностью капилляров приводят к значительному снижению эффективности и разрешающей способности, невоспроизводимости разделений. Это требует дополнительных усилий по регенерации капилляров или даже их замене.
Главная цель модифицирования внутренней поверхности кварцевого капилляра состоит в изменении величины и направления ЭОП для улучшения эффективности разделения, а также снижения адсорбции. При этом также достигается ускорение или замедление электросепарационных разделений в зависимости от напряженности и полярности электрического поля; разрешающей способности и чувствительности анализа; движение как анионов, так и катионов в одном направлении, что позволяет проводить их одновременное определение.
Помимо экологического контроля капиллярный электрофорез также используется в пищевой промышленности: для определения катионов, анионов в минеральной воде и водке; консервантов, катионов, анионов, витаминов, антиоксидантов, красителей в напитках и соках; витаминов, аминокислот, микотоксинов в различных продуктах; в фармакологии: для анализа лекарственных препаратов, для технологического контроля; разделения энантиомеров; в биохимия и медицине: для определения белков и аминокислот в биожидкостяхгликозилированного гемоглобина и исследования фармакокинетики;в криминалистике: для выявления следов взрывчатых веществ и наркотических. |
|
|
 Скачать 1.66 Mb.
Скачать 1.66 Mb.



 Рисунок 7 – Схема возникновения электроосмотического потока
Рисунок 7 – Схема возникновения электроосмотического потока