5 Глава Гипертоническая болезнь (эссенциальная гипертензия) и симптоматические гипертензии
 Скачать 2.67 Mb. Скачать 2.67 Mb.
|
|
2.4.1 Антиангинальные препараты В зависимости от преобладающего механизма действия можно выделить следующие группы антиангинальных препаратов: 1) нитраты, 2) блокаторы адренергических рецепторов, 3) антагонисты кальция. 2.4.1.1. Нитросоединения (нитраты) В настоящее время в подавляющем большинстве случаев в клинической практике среди нитросоединений используются нитраты. В последние годы достаточно хорошо изучен метаболизм нитропрепаратов, в частности, нитроглицерина, имеющего три активных группы N-H. Метаболизм этого препарата проходит в печени, причем определяются два его активных метаболита – глицеродинитрат и мононитрат (соедержат две и одну активные группы N-H соответственно). В последующем глицеродинитрат вновь метаболизируется в печени на два мононитрата: изосорбид-5-мононитрат (активный метаболит) и изосорбид-2-мононитрат (малоактивный метаболит). Нитраты и их метаболиты выводятся почками. Активные формы метаболитов нитроглицерина (его производные) выделены в отдельные лекарственные формы - изосорбид-динитрат (глицеродинитрат) и изосорбид-5-мононитрат (мононитрат), выпускающиеся различными фармацевтическими фирмами. Нитропрепараты подразделяются на следующие группы: 1. Нитроглицерин (нитро-тринитрат) – короткодействующий препарат. 2. Препараты депо нитроглицерина (сустак, нитронг, тринитролонг, нитрогранулонг, нитро-мак и т.д.). 3. Производные нитроглицерина: 3.1. Изосорбид- динитрат (кардикет, кардикс, нитросорбид, изо-мак, изокет и т.д.). 3.2. Изосорбид-5-мононитрат (изомонат, кардикс-моно, моно-мак, монолонг, мононит, монизид, монизол и т.д.). 4. Пентаэритритил тетранитрат (эринит). r Механим действия нитратов. Выделяют три основных точки приложения воздействия нитратов: 1. Активизация фактора, расслабляющего сосуды (белок-релаксирующий фактор, расширяющий артериолы и вены). В норме активность белка, релаксирующего сосуды, определяется количествомS-H-групп. В тех случаях, когда он инактивируется, S-H-группы отдают водород и между ними образуются двойные связи - S=S-группы. NH-группы нитратов отдают Н+ белок-релаксирующему фактору и восстанавливают его активность путем перехода S=S-групп в S-H группы. В свою очередь, освобожденный радикал азота соединяется с кислородом, образуя моногоксид азота. 2. Прямое релаксирующее действие монооксида азота, в том числе, высвобождающегося в результате метаболизма нитратов, обусловленное путем его воздействия на стенку коронарных артерий. 3. Повышение выделения при приеме нитратов простагландина Е, расширяющего венечные артерии. В результате вышеперечисленных воздействий нитратов отмечаются следующие изменения функции центральной и периферической гемодинамики. Изменения центральной гемодинамики: уменьшения конечно-систолического и конечно-диастолического давления в левом желудочке, его объема и напряжения стенки сердечной мышцы, что приводит к снижению работы сердца и восстановлению равновесия между потребностью миокарда в кислороде с его доставкой (непрямое действие). Изменения периферической гемодинамики: дилатация, в большей степени, венозных и, в меньшей, - артериальных сосудов, уменьшение венозного возврата крови. Вследствие этого снижается нагрузка на сердце. Прямое расширяющее действие нитратов на коронарные артерии, увеличение числа функционирующих коллатералей и устранение спазма венечных артерий способствуют улучшению перфузии миокарда. Благодаря этим эффектам восстанавливается равновесие между притоком кислорода к миокарду и потребностью в нем, что способствует устранению ишемии миокарда. Различные лекарственные формы нитроглицерина могут применяться сублингвально, внутрь, внутривенно, трансдермально, путем аппликации за щеку, ректально, путем ингаляции и введения в коронарное русло. r Побочное действие нитратов: Головная боль - возникает в начале лечения и при продолжении терапии перестает беспокоить больных. Уменьшение головной боли отмечается при снижении дозы нитратов, применении анальгетиков или валидола. Постуральная гипотензия - проявляется головокружением, слабостью и, реже, кратковременной потерей сознания. Толерантность к нитратам - гипо- или ареативность, связанная с предшествующим приемом этих препаратов и проявляется учащением приступов стенокардии, увеличением использования пациентами дозы нитропрепаратов. В настоящее время выделяют два основных механизма развития толерантности к нитратам: ложная и истинная сосудистая. К ложным механизмам толерантности относят следующие: активация ренин-ангиотензиновой системы, повышение уровня альдостерона, вазопрессина или катехоламинов, признаки перегрузки объемом. К механизмам внутрисосудистой толерантности относят нарушение биотрансформации органических нитратов, внутриклеточное истощение сульфгидрильных групп, десенситизация фермента гуанилатциклазы, повышение активности фосфодиэстеразы (приводящее к усиленному распаду цГМФ). Для предупреждения толерантности к нитратам рекомендуют начинать лечение нитропрепаратами с минимальных доз, при развитии толерантности - пропускать очередной прием нитратов (Packer M et al., 1987), добавлять к терапии препараты, содержащие SH-группы, например, S-ацетилцистеин, унитиол, антиоксиданты или отменять нитропрепараты до восстановления их эффективности. Кроме того, используют низкоинтенсивное лазерное излучение (лазерное облучение венозной крови) параллельно с применением нитропрепаратов, которое повышает активность антиоксидантной системы, в частности увеличивает содержание в крови и тканях SH-групп (Корочкин И.М. и соавт., 1984, 1986, 1989, 1990, 1991, Кипшидзе Н.Н. и соавт., 1986, 1988, 1990, Олесин А.И. и соавт., 1990, 1991, 1994, Бабий Л.Н. и соавт.,1994, Катюхин Л.Н. и соавт., 1996). Подробное описание методики, использование наиболее эффективных диапазонов длин волн лазерного излучения для лечения толерантности к нитратам представлено ниже (см. главу 2.4.4.). Противопоказания к нитратам: индивидуальная непереносимость, гипотония, коллапс, кровоизлияния в мозг, повышение внутричерепного давления, гипертрофическая кардиомиопатия, глаукома. 2.4.1.2. Бета-адреноблокаторы и антагонисты кальция Основные характеристики, показания и противопоказания применения -адреноблокаторов и антагонистов кальция, в т.ч. используемых для лечения стенокардии, представлены в главе1, «Гипертоническая болезнь». 2.4.1.3. Ингибиторы ангиотензинпревращающего фермента Основные характеристики, показания и противопоказания к применению ингибиторов АПФ, в т.ч. используемых для лечения стенокардии, представлены в главе 1, «Гипертоническая болезнь». Многочисленные исследования показали, что уменьшение посленагрузки с помощью этих препаратов снижает работу левого желудочка и соответственно снижает потребность миокарда в кислороде. 2.4.1.4. Антиагреганты Среди антиагрегантов наиболее эффективным и широко используемым является ацетилсалициловая кислота, используемая в дозе 200-250 мг в сутки. Основной точкой приложения действия препарата является циклооксигеназа, тромбоксан- и простациклинсинтетаза тромбоцитов. В больших дозах этот препарат блокирует циклооксигеназу сосудов, что приводит к снижению синтеза простациклина, и антиагрегантный эффект нивелируется. В тех случаях, когда аспирин противопоказан (при наличии язвенной болезни, гастрита, дуоденита и других заболеваний желудочно-кишечного тракта), назначают дипиридомол (курантил, персантин) в дозе 75 мг в сутки и т.д. Механизм действия этих препаратов заключается в угнетении агрегации тромбоцитов за счет ингибирования фосфодиэстеразы и аденилатциклазы, тесно связанных с метаболизмом арахидоновой кислоты и синтезом простагландинов. 2.4.2. Выбор препаратов при лечении стенокардии r Стабильная стенокардия I - II функционального класса. Больным стенокардией I - II функционального класса показано соблюдение общих мероприятий для пациентов этим заболеванием (см. выше), в частности, устранение факторов риска ИБС, соблюдение гипохолестериновой диеты, нормализации труда и отдыха и т.д. Наиболее важным фактором для этих пациентов является ограничение нагрузок физического и эмоционального характера, а также предупреждение повышения артериального давления у больных с артериальной гипертензией (см. выше) и (или) развитие тахисистолических аритмий. Практически всем больным показано использование аспирина в дозе 200-250 мг в сутки в качестве профилактической терапии. Антиангинальные препараты используются преимущественно только для купирования болевого приступа, если ангинозные боли не купируются при прекращении нагрузки. r Стабильная стенокардия III - IV функционального класса. Больным этой группы показан прием следующих средств: нитраты пролонгированного действия, начиная с препаратов изосорбида-5-мононитрата, а при его неэффективности - динитраты и затем - депо нитроглицерина; антиагреганты - ацетилсалициловая кислота в дозе 200-250 мг в сутки, а в тех случаях, когда она противопоказана, - дипиридамол (курантил, персантин) в дозе 75 мг в сутки и т.д.; -адреноблокаторы и антагонисты кальция - по показаниям (см. выше), с учетом наличия артериальной гипертензии, нарушений сердечного ритма, сердечной недостаточности и т.д.; ингибиторы АПФ: эналаприл (эднит, ренитек и т.д.) и другие в дозе 2,5-10 мг в сутки у больных без гипертонической болезни и 10-40 мг - с артериальной гипертензией. r Нестабильная стенокардия (впервые возникшая и прогрееирующая). Больным этой группы показан прием следующих препаратов: нитраты пролонгированного действия, начиная с препаратов изосорбида-5-мононитрата, а при его неэффективности - динитраты и затем - депо нитроглицерина; поляризующая смесь с внутривенным введением нитроглицерина 1%-1,0; антиагреганты - ацетилсалициловая кислота в дозе 200-300 мг в сутки, а в тех случаях, когда она противопоказана, - дипиридамол (курантил, персантин) в дозе 75 мг в сутки и т.д.; -адреноблокаторы и антагонисты кальция по показаниям (см. выше), причем с учетом наличияартериальной гипертензии, нарушений сердечного ритма, сердечной недостаточности и т.д.; ингибиторы АПФ: эналоприл (эднит, ренитек и т.д.) и другие в дозе 2,5-10 мг в сутки у больных без гипертонической болезни и 10-40 мг - с артериальной гипертензией. При неэффективности вышеуказанной терапии добавляют гепарин, а ряд авторов рекомендует проведение тромболизиса (Чазов Е.И., 1992, Грацианский Н.А., 1996, 1997, 2000, Голиков А.П. и соавт., 2000). Отсутствие эффекта вышеуказанной терапии является показанием к проведению коронарографии и решение вопроса об оперативном вмешательстве. Прединфарктное состояние и острая коронарная недостаточность - терапия нестабильной стенокардии, включая, по показаниям, тромболизис. При неэффективности этой терапии - коронарография с последующим решением вопроса об объеме оперативного вмешательства. 2.4.3. Оперативное лечение больных стенокардией Если медикаментозное лечение не имеет успеха и интервалы между приступами ангинозных болей сокращаются, больному необходимо провести селективную коронарографию и определить возможность проведения оперативного вмешательства. Главной целью хирургического лечения больных стенокардией является облегчение клинических симптомов заболевания, улучшение качества и продолжительности жизни. Вопрос о показаниях к оперативному лечению является достаточно серьезным, поскольку хирургические операции на коронарных артериях могут привести к различным осложнениям и даже летальному исходу. Операционная летальность в лучших клиниках мира составляет 1-4% и значительно возрастает, если утяжеляется контингент больных, направляемых на операцию - смертность увеличивается до 20-45% у пациентов с сопутствующей аневризмой сердца, сниженной сократительной функцией миокарда, нестабильной стенокардией, прединфарктным состоянием (Соловьев Г.М. и соавт., 1990, Wilson R.E. et al., 1986, Kannel W.B. et al.,1986, Myler R.K. et al.,1990). Чем менее тяжел контингент больных, направляемых на операцию, тем лучше эффект (Blevins R.D. et al.,1986). По данным многих авторов, хирургическое лечение у 70-80% больных приводит к значительному урежению или полному прекращению приступов стенокардии на 3-4 года и более в условиях обычной активности организма (Шхвацабая И.К., 1975, Гасилин В.С., Сидоренко Б.А.,1987, Чазов Е.И.,1982, 1992, Halim M.A. et al.,1982, Mabin T.A. et al.,1985). Поэтому основная задача медикаментозной терапии состоит в предупреждении развития инфаркта миокарда, перехода нестабильной стенокардии и предынфарктного состояния в стабильную стенокардию с возможностью в дальнейшем проведения оперативного лечения. В настоящее время используется несколько видов операций: аортокоронарное шунтирование в различных модификациях; баллонная дилатация коронарных артерий; протезирование (пластика) коронарных артерий; чрескожная транслюминарная ангиопластика; удаление бляшки с помощью фокусированного лазерного луча. Аортокоронарное шунтирование. Впервые операция аорто-коронарного шунтирования проведена в СССР Амосовым в 1964 г. Сущность операции заключается в том, что после выявления локализации стеноза венечных артерий на нее накладывается шунт, который в обход стеноза доставляет кровь к сердечной мышце (см. рис. 2.5.). Существуют разные мнения относительно выбора шунта, но некоторые данные свидетельствуют, что применение большой подкожной вены бедра для аортокоронарного шунтирования наиболее оправдано. Однако при ее использовании в качестве шунта иногда в нем наступает развитие атеросклероза и пролиферации интимы, что приводит к нарушению его проходимости. Если в качестве шунта используется внутренняя грудная артерия, то, по данным многих авторов, атеросклеротический процесс в стенке шунта не развивается. В ряде случаев используют в качестве шунта искусственную коронарную артерию (протез). В последние годы применяют сочетание шунтирования с подшиванием внутренней грудной артерии ниже шунта. Показания к проведению аорто-коронарного шунтирования у больных стенокардией: - поражение основного ствола левой коронарной артерии; - стенокардия, развившаяся менее 3 месяцев назад; - поражение трех коронарных артерий; - поражение двух коронарных артерий, включая проксимальную часть левой нисходящей коронарной артерии; - положительная нагрузочная проба (снижение сегмента ST более чем на 2 мм при проведении велоэргометрии (тредмила) или чреспищеводной электрокардиостимуляции), а также патологическиеизменения электрокардиограммы, выявляемые в покое; - снижение сегмента ST в покое в сочетании с анамнестическими сведениями о ранее перенесенном инфаркте миокарда или артериальной гипертензии; либо пациенты III-IV функционального класса сердечной недостаточности по классификации NYHA.  Рис. 2.5. Схема проведения аортокоронарного шунтирования. В обход стеноза наложен шунт, который доставляет кровь к сердечной мышце. С целью сохранения проходимости аортокоронарного шунта назначают аспирин, варфарин и другие антикоагулянты. В настоящее время используют два основных неинвазивных способа оценки проходимости шунта с помощью нагрузочных проб: электрокардиографический и использование радиоизотопов (технеций-99-пирфотех). Установлено, что если у больного после аортокоронарного шунтирования в покое и при проведении нагрузочных проб ишемические изменения не выявляются, то вероятность проходимости шунта составляет, в среднем, 90%, а если ишемические изменения, возникающие во время пробы, нормализуются в покое, то вероятность его проходимости составляет - 80%. Если ишемические изменения длительно не нормализуются или наблюдаются в покое с усугублением при проведении пробы, то вероятность окклюзии шунта составляет, в среднем, 80%. Многочисленные результаты ангиографических исследований, проведенных после аортокоронарного шунтирования, показали, что с каждым годом после операции проходимость шунта уменьшается, в среднем, на 10-20%. Осложнения, согласно многочисленным данным рандомизированных исследований, составляют от 0,2% до 4%. Положительный клинический эффект после аортокоронарного шунтирования (исчезновение ангинозных болей и повышение работоспособности пациентов) наблюдается на протяжении 4-15 лет (в среднем 5-7 лет). Продолжительность клинического эффекта уменьшается, если операция проведена у больных нестабильной стенокардией, сразу после или через 1-2 года после перенесенного инфаркта миокарда. Баллонная дилатация коронарных артерий. Методика баллонной дилатации коронарных артерий была предложена B. Dotter, R. Judkins в 1964 г. Широкое признание методика получила в 1974 г., когда A. Gruntzig предложил баллон-катетер с двумя просветами для дилатации стенозированной артерии. Методика баллонной дилатации заключается в следующем. С помощью коронарной ангиографии определяется точное место стеноза, затем в нее вводится дилатационный катетер, имеющий баллон длиной 2 см и расширяющийся при введении воздуха под давлением до 2-4 мм. Дилатирующийся баллон разрушает атеросклеротическую бляшку и стеноз ликвидируется (см. рис. 2.6.). Показания к проведению баллонной дилатации коронарных артерий такие же, как для аортокоронарного шунтирования. Противопоказания к проведению баллонной дилатации коронарных артерий: - стеноз основного ствола левой коронарной артерии; - субтотальные стенозы коронарных артерий; - вазоспастическая стенокардия. 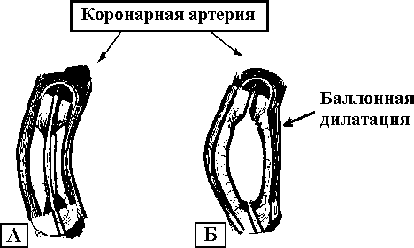 Рис. 2.6. Схема проведения баллонной дилатации коронарной артерии. В коронарную артерию введен катетер с баллоном (А). Дилатирующий баллон разрушает атеросклеротическую бляшку и кровоток в артерии восстанавливается (Б). Если раньше баллонная дилатация коронарных артерий использовалась преимущественно у больных стабильной стенокардией, то в настоящее время эта процедура проводится у большинства больных, при отсутствии противопоказаний, включая пациентов имеющих критическую степень стеноза (более 85-90%) при коронарографии. Осложнения этой процедуры наблюдаются, по данным разных авторов, от 5 до 15%, причем они обусловлены диссекцией коронарных артерий с последующим развитием инфаркта миокарда. Поэтому повсеместно пациентам после проведения баллонной дилатации и восстановления коронарного кровотока рекомендуется в дальнейшем проведение аортокоронарного шунтирования, так как продолжительность клинического эффекта после дилатации намного меньше, чем при аортокоронарном шунтировании, и составляет от 1 года до 2-4 лет. Протезирование (пластика) коронарных артерий. Это оперативное вмешательство предложено в последние годы и заключается в том, что, если у больного коронарные артерии поражены на всем своем протяжении и нет возможности проведения аортокоронарного шунтирования или других каких-либо оперативных вмешательств, их заменяют на искусственные коронарные артерии (протезы). Положительный эффект при проведении этой операции отмечается на протяжении 5-12 лет, а осложнения наблюдаются от 0,4% до 4% случаев. Чрескожная транслюминарная ангиопластика. Эта операция предложена в последние годы и проводится преимущественно при изолированном стенозе 1-2 коронарных артерий крупного или среднего калибра. Метод заключается в том, что в коронарную артерию вводится специальный проводник с утолщением на конце в виде оливы, покрытой алмазной пылью, размером 2-4 мм, который вращается со скоростью 20-100 оборотов в минуту. При прохождении проводника по неизмененным артериям, они расширяются, а на уровне стеноза - не дилатируются и олива, вращаясь, срезает атеросклеротическую бляшку, а место стеноза покрывается специальным составом, чтобы на его месте не образовывался тромб (см. рис. 2.7.). Следует отметить, что продукты распада бляшки меньше размера тромбоцита и они выводятся с почками. Положительный эффект при проведении этой операции в настоящее время изучается, но, по последним данным, отмечается в течение, по крайней мере, 5-8 лет. Осложнения при проведении чрескожной транслюминарной ангиопластики (перфорация стенки коронарной артерии, повреждение субэндокардиальных структур и образование тромба) наблюдаются в 1-2% случаев.  Рис. 2.7. Схема проведения чрескожной транслюминарной ангиоплатики коронарной артерии. В коронарную артерию вводится специальный проводник (зонд) с утолщением на конце в виде оливы, покрытой алмазной пылью, который вращается со скоростью 20-100 оборотов в минуту. При прохождении проводника по неизмененным артериям, они расширяются, а на уровне стеноза - не дилатируются и олива, вращаясь, срезает атеросклеротическую бляшку. Следует отметить, что продолжительность положительного клинического эффекта после проведения вышеуказанных оперативных вмешательств зависит не только от техники проведения и выбора операции, но и от образа жизни пациента: от соблюдения им гипохолестеринемической диеты, от степени физической активности, от регулярности приема антиагрегантов, антикоагулянтов и т.д. Реканализация коронарных артерий (удаление бляшек) и миокарда с помощью фокусированного лазерного луча. Направляемый через гибкое оптическое волокно лазерный луч мощностью в несколько ватт удаляет бляшку, вызывая адсорбцию световой энергии с последующей ее трансформацией в тепловую, которая приводит вначале к плавлению, а затем – к ее испарению. Эффективность лечения с помощью мощного лазерного излучения зависит от состава бляшки (содержания липидов, гиалина, кальция), свойств лазерного луча (длины волны, степени фокусировки луча, мощности и длительности воздействия), а также от умения врача контролировать глубину воздействия и ограничивать термическое повреждение окружающей ткани (Grundfist W.S. et al., 1985). Осложнения этой процедуры наблюдаются, по данным разных авторов, до 20-30%, причем они обусловлены перфорацией и повреждением коронарных артерий с последующим развитием инфаркта миокарда. По этим причинам лазер не применяется в ежедневной клинической практике для лечения больных стенокардией. Прежде чем этот способ лечения будет широко применяться в клинической практике, необходимы дальнейшие исследования и совершенствование технологии. В последние годы для лечения стенокардии стали использовать углекислый и иттритий-алюминиво-рубиновый лазеры для создания новых каналов в миокарде. Этот метод впервые был предложен M.Okada et al. (1986). В его основе лежит реваскуляризация миокарда при воздействии лазерного луча за счет стимуляции ангиогенеза, ангиогенных факторов роста в сердечной мышце. Лазерная реваскуляризация осуществляется при проведении левосторонней торакотомии или торакоскопии. Однако положительный эффект этой процедуры не подтверждается результатами объективного обследования с использованием сцинтиграфии миокарда, а также теста с физической нагрузкой, в частности, не наблюдается увеличения фракции выброса левого желудочка и повышения толерантности к нагрузке, что связывают с частичной денервацией сердца (Gassler N. et al., 1997, Kwong K.F. et al., 1998). Смертность в послеоперационном периоде составляет 9% (Horvath K.A. et al., 1997). Летальность на 30 день и через 12 месяцев состаляют, в среднем, 12% и 22% соответственно, что сопоставимо только в сравнении с результатами медикаментозной терапии (Nagele H. et al., 1998). Поэтому этот метод применяется в сочетании, например, с аортокоронарным шунтированием (Mack C.A. et al., 1997).  Рис. 2.7. Схема проведения чрескожной транслюминарной ангиоплатики коронарной артерии. В коронарную артерию вводится специальный проводник (зонд) с утолщением на конце в виде оливы, покрытой алмазной пылью, который вращается со скоростью 20-100 оборотов в минуту. При прохождении проводника по неизмененным артериям, они расширяются, а на уровне стеноза - не дилатируются и олива, вращаясь, срезает атеросклеротическую бляшку. Следует отметить, что продолжительность положительного клинического эффекта после проведения вышеуказанных оперативных вмешательств зависит не только от техники проведения и выбора операции, но и от образа жизни пациента: от соблюдения им гипохолестеринемической диеты, от степени физической активности, от регулярности приема антиагрегантов, антикоагулянтов и т.д. Реканализация коронарных артерий (удаление бляшек) и миокарда с помощью фокусированного лазерного луча. Направляемый через гибкое оптическое волокно лазерный луч мощностью в несколько ватт удаляет бляшку, вызывая адсорбцию световой энергии с последующей ее трансформацией в тепловую, которая приводит вначале к плавлению, а затем – к ее испарению. Эффективность лечения с помощью мощного лазерного излучения зависит от состава бляшки (содержания липидов, гиалина, кальция), свойств лазерного луча (длины волны, степени фокусировки луча, мощности и длительности воздействия), а также от умения врача контролировать глубину воздействия и ограничивать термическое повреждение окружающей ткани (Grundfist W.S. et al., 1985). Осложнения этой процедуры наблюдаются, по данным разных авторов, до 20-30%, причем они обусловлены перфорацией и повреждением коронарных артерий с последующим развитием инфаркта миокарда. По этим причинам лазер не применяется в ежедневной клинической практике для лечения больных стенокардией. Прежде чем этот способ лечения будет широко применяться в клинической практике, необходимы дальнейшие исследования и совершенствование технологии. В последние годы для лечения стенокардии стали использовать углекислый и иттритий-алюминиво-рубиновый лазеры для создания новых каналов в миокарде. Этот метод впервые был предложен M.Okada et al. (1986). В его основе лежит реваскуляризация миокарда при воздействии лазерного луча за счет стимуляции ангиогенеза, ангиогенных факторов роста в сердечной мышце. Лазерная реваскуляризация осуществляется при проведении левосторонней торакотомии или торакоскопии. Однако положительный эффект этой процедуры не подтверждается результатами объективного обследования с использованием сцинтиграфии миокарда, а также теста с физической нагрузкой, в частности, не наблюдается увеличения фракции выброса левого желудочка и повышения толерантности к нагрузке, что связывают с частичной денервацией сердца (Gassler N. et al., 1997, Kwong K.F. et al., 1998). Смертность в послеоперационном периоде составляет 9% (Horvath K.A. et al., 1997). Летальность на 30 день и через 12 месяцев состаляют, в среднем, 12% и 22% соответственно, что сопоставимо только в сравнении с результатами медикаментозной терапии (Nagele H. et al., 1998). Поэтому этот метод применяется в сочетании, например, с аортокоронарным шунтированием (Mack C.A. et al., 1997). |
